一、通过对法规同品种医疗器械的定义与判定,可得出以下两点:
1、拟申报产品与对照品必须是基本等同:
1)两者对比项目里的内容同时具有相同性和差异性
2)两者对比项目只有相同性没有差异性
3)拟申报产品的安全性与有效性必须要和对照品的安全性和有效性保持一致
2、走通品种对比路径申报的条件:
1)不在《需进行临床试验审批的第三类医疗器械目录里》
2)对照品必须是在中国境内已上市的产品
3)验证两者基本等同
二、验证两者基本等同的要求:
1)数据收集必须是合法渠道获得(如:合法购买(授权)、境内或境外公开文献发表、公司同一产品的更新换代等等)
2)数据可以是非临床研究数据、临床文献数据、临床经验数据、针对差异性在中国境内开展的临床试验数据
3)验证产品差异性是否对产品的安全和有效性产生不利影响,应该通过拟申报产品自身的数据进行验证和/或确认。
温馨提示:以上纯属个人观点,在注册申报中还应具体产品具体分析,建议在走CER路径之前,做一份风险预测。从患者的角度出发,高风险类的产品建议还是做临床试验,一是安全性和有效性更可信,二是更利于产品后期市场推广。
《医疗器械临床试验设计指导原则》
一、医疗器械临床试验适用范围
1、列入《需进行临床试验审批的第三类医疗器械目录》产品
2、创新产品/无已上市同品种产品
3、无法进行同品种对比或同品种对比时需要对差异性进行临床试验验证的产品
4、不在《豁免临床试验目录》的产品
要求:产品的组成、设计和性能已定型的医疗器械。必须已获得医疗器械注册检测合格报告且在有效期内。
二、医疗器械临床试验目的的确认
|
确定医疗器械临床试验目的
|
|
器械类型
|
序号
|
关注点
|
设计
|
主要评价指标
|
|
未上市
|
01
|
医疗器械的疗效
|
确认医疗器械的有效性是否
优于/等效于/非劣于已
上市同类产品,同时确认试验器械的安全性
|
产品的有效性
|
|
02
|
医疗器械的安全性
|
确认医疗器械的安全性是否
优于/等效于/非劣于
已上市同类产品,
同时确认试验器械的有效性
|
产品的安全性
|
|
已上市
|
03
|
增加适应症
|
确认医疗器械对新增
适应症的安全有效性
|
在新的适应症基础上,
结合01与02,
确定主要评价指标
|
|
04
|
医疗器械适用人群发生变化
|
确认医疗器械对新增
适用人群的安全有效性
|
在此基础上结合01与
02确定主要评价指标
|
|
05
|
医疗器械设计变更时
|
确认变化部分对产品
安全有效性的影响
|
根据设计变更的范围,
结合01与02 确定
主要评价指标
|
|
06
|
医疗器械的使用方法或使用环境发生变更
|
确认产品在特定使用情况
下和使用方法下的安全有效性。
|
在此基础上,结合01与02,
确定主要评价指标
|
三、医疗器械临床试验设计的类型
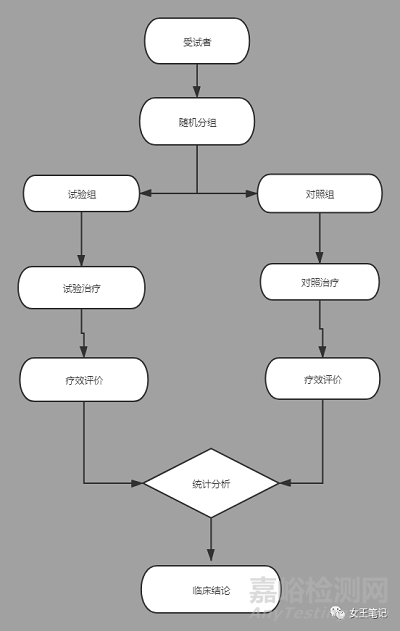
1、平行对照设计
2、配对设计
3、交叉设计
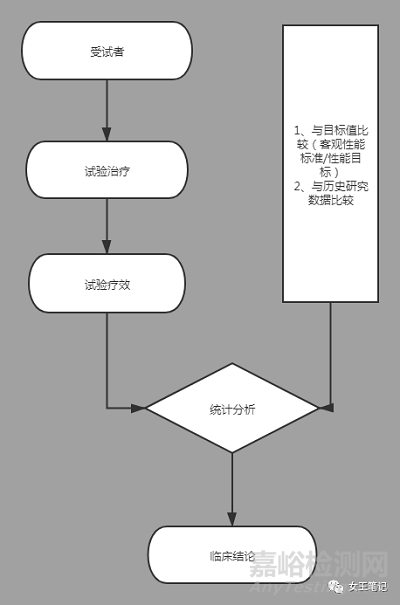
4、单组设计
四、医疗器械临床试验不同类型设计的要素
1、平行对照设计
随机:指临床试验中每位受试者均有同等机会(如试验组与对照组病例数为1:1)或其他约定的概率(如试验组与对照组病例数为n:1)被分配到试验组或对照组,不受研究者和/或受试者主观意愿的影响。
1)随机实施:试验分组随机,试验顺序随机
2)随机的方式:完全随机化、分层随机化/区组随机化、动态随机化
3)随机手段:计算机伪随机数发生、随机数字表与硬币
4)分配隐藏随机:随机信封、中央随机化系统
盲法:盲法是控制临床试验中因“知晓分组信息”而产生偏倚的重要措施之一。目的是达到临床试验中各方人员对分组信息均不可知。
1)不完整设盲:单盲、双盲
2)完整设盲:受试者、研究者、第三方评价均处于盲态
3)不设盲:因器械固有特征及评价方法影响,无法设盲。
紧急设盲:需在试验方案中写明什么情况下需要紧急破盲。
对照:要遵循均衡、专设、同期的原则
1)对照的类型:安慰剂对照、标准治疗对照、阳性治疗对照
2、配对设计
1)同一受试对象的两个对应部位同时接受试验器械和对照器械治疗,试验器械和对照器械的分配需要考虑随机。
2)配对设计适用于器械的局部效应评价,具有一定的局限性
3)对于诊断类的器械,若试验目的是评价产品的诊断准确性,常见的配对设计为同一受试者/受试样品同时采用试验器械和对照器械/诊断金标准方法进行对比诊断
3、交叉设计
1)需要注意,在后一阶段治疗开始前,安排合理的洗脱期,保障受试者恢复到基线状态
4、单组设计
1)是将主要评价指标的试验结果与已有临床数据进行比较,以评价试验器械的安全性和有效性。
2)与目标值比较:需要事先指定主要评价指标有临床意义的目标值,通过考察单组临床试验主要评价指标的结果是否在指定的目标值范围内,从而评价试验器械的安全性和有效性。包括客观性能标准(OPC)和性能指标(PG)。
3)与历史研究对照
五、受试对象
样本与总体:通过对一组样本干预效果的观察,推断试验方法对所有同类患者的干预效果
入选标准:试验方法应用于临床的目标群体,如适应症、疾病的分型、疾病程度和阶段、使用具体部位、受试者年龄范围等因素。
排除标准:去除病情过于复杂、影响疗效评价,不适合参与试验研究的人群
六、评价指标
评价指标:反映器械作用于受试对象而产生的各种效应,根据试验目的和器械的预期效应设定。
指标类型:定量指标、定性指标、等级指标
1)定量指标:血压、血糖、心率、脉搏等
2)等级指标:优、良、中、差
3)定性指标:有效、无效
主要评价指标和次要评价指标
1)主要指标:是与试验目的有本质联系的、能确切反映器械疗效或安全性的指标。主要指标应尽量选择客观性强、可量化、重复性高的指标,应是专业领域普遍认可的指标,通常来源于已发布的相关标准或技术指南、公开发表的权威论著或专家共识等。
2)次要指标:是与试验相关的辅助性指标。
3)一般情况下,主要指标仅为一个,用于评价产品的安全性或有效性。当一个主要评价指标不足以反映器械的疗效或安全性时,可采用两个或多个主要评价指标。
复合指标:将多个评价指标组合构成一个指标称为复合指标。复合指标可将客观测量指标和主观评价指标进行结合,形成综合评价指标。
替代指标:在直接评价临床获益不可行时,可采用替代指标进行间接观察。是否可采用替代指标作为评价指标取决于:
1)替代指标与临床结果的相关性
2)替代指标对临床结果判断价值的流行病学证据
3)从临床试验中获得的有关试验器械对替代指标的影响程度与试验器械对临床试验结果的影响程度相一致的证据
主观指标的第三方评价:由独立的评价小组进行指标评价。
七、比较类型和检验假设
1、比较类型:优效性检验、等效性检验、非劣效性检验
优效性检验:采用安慰对照的临床试验,需进行优效性检验;
优效性检验的目的:确证试验器械的疗效/安全性优于对照器械/标准治疗方法/安慰对照,且其差异大于预先设定的有效性界值,即差异有临床实际意义。
优效性试验,如果设计和执行良好,试验结果可直接确证试验器械的安全/疗效。
等效性试验和非劣效性试验中,试验器械的疗效/安全性建立在对照器械预期疗效/安全性的基础上。
2、界值:
有效性界值:是指医疗器械与对照器械之间的差异具有临床实际意义的最小值。
等效或非劣效界值是指试验器械与对照器械之间的差异不具有临床实际意义的最大值。
优效界值、非劣效界值均为预先制定的一个数值,等效界值需要预先制定优侧、劣侧两个数值。
3、试验方案需要明确检验假设和假设检验方法。
八、样本量的估算
临床试验的样本量基于主要评价指标的相应假设进行估算。
九、小结
在进行产品临床试验方案设计时,有相关同类产品指导原则的,应优先结合相应产品指导原则进行设计。如无指导原则、亦无同类产品做对照,可结合《医疗器械临床试验设计指导原则》进行设计。