固体剂型连续制造( CM) 中,物料通过完全集成设备的装配线,节省操作时间并降低人为错误发生的可能性,已逐渐发展成为药物产品的优选平台。欧美药品监督管理机构已批准了数个商业化连续生产的药品,其生产工艺控制策略的要素是采用科学框架来寻找降低制造过程发生变异的风险。过程分析技术( PAT) 监控方法可实时控制产品质量,促进制造的持续改进和创新,从而实现先进过程控制和产品的实时放行。其最终目标是以更高效和更低的成本将更安全的药品迅速推向市场,实现制药工业 4.0 数据化及过程控制系统集成的目标。本文探讨了过程分析技术在实施连续制造工艺中的模型分类与风险考虑,先进控制策略、当今监管法规关注重点和可能面临的施行挑战,并介绍欧美制药企业基于连续制造的上市新药审批结果与 PAT 应用项目。
传统上国内药品制造一直非常保守,即使高度专业化的产品生产,老式的批量( batch manufacturing)加工模式仍然占据主导地位。批量制造是一个多步骤的过程,其中在每个工艺步骤之后,生产通常会暂停以测试样品的质量,有时物料可以储存在容器中或运送到另一个设施以完成下一步制造。因此处理时间可能会数周,甚至数月,并且还有可能给对环境敏感的活性药物成分( active pharmaceutical ingredients,API) 带来质 量风险。相比之下,连续制造( continuous manufacturing,CM) 是在同一设施内实现不间断药物制造的过程,各步骤之间没有停顿,并且消除了分离中间体的程序。在连续制造中,物料通过完全集成设备的装配线,节省操作时间并降低人为错误发生的可能性。连续制造还具有额外的优点,包括自动监控所涉及的各个设备,在故障发生之前进行检测问题并实时监控。制药行业现在也开始寻求连续制造药品的优势。在连续制造中,生产成品药品所需的所有单元操作都在一个车间内进行,即单一控制系统。而传统的批量制造则是各种操作工艺,如混合、称重、压片和包衣,是在不同的时间点及不同的车间进行,见图 1。
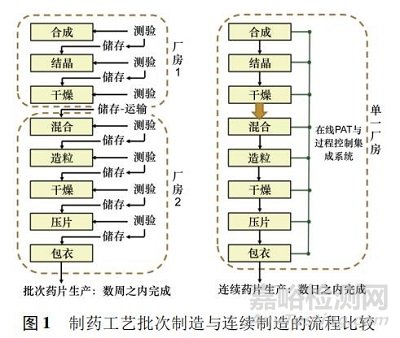
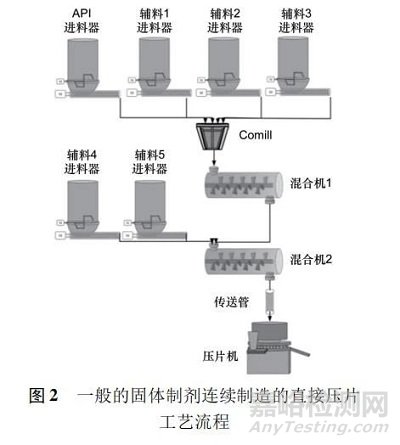
食品、化学和石化行业早已采用了高效的连续化技术来安全地生产其产品。在制药领域,若实施连续制造作为一种常规方法,则需要相关行业、监管机构、学术机构和设备制造商之间的充分了解与合作。依据美国 FDA 的定义,“连续制造”工艺是指物料连续地投入并在工艺中完成转换,同时加工后的物料被连续地从系统中移除。虽然该描述可以应用于单个操作工序或由一系列操作工序组成的制造过程,但连续制造是由一系列 2 个或更多操作工序组成的整体工艺[1]。美国联邦法 21 CFR 210. 3 中定义批次为特定数量的药物或其他物料,预期在指定的限制内具有均匀的特性和质量,并在同一制造周期内根据单一制造订单生产; 因此美国 FDA 认为批次是指物料的数量,并未指定制造方式。由此可见,连续生产的规模可依据生产时间而不是由设备尺寸决定的。一般情况下连续制造可长期运行到120 h,运行期间以 50 kg·h - 1的定额流量,实现制造6 000 kg 的成品,约等同1 500 万片主要成分为400 mg的片剂。事实上一些制药设备本身已是以连续运行为主,如制剂的压片机和连续化发酵罐。但湿式制粒机、包衣机及化学合成反应等其他设备或产品必须进行改造以便符合连续生产。图 2 显示的是典型固体制剂连续制造的直接压片工艺流程。
连续制造为制药行业的改进与创新提供了多种机会,包括: ① 具有精简步骤的集成过程( 例如更安全、更快响应时间、更高效、更短时间) 。② 体积小巧的设备( 例如可能更小量 API 的要求、更高的操作灵活性、更低的成本和更加环保的优势) 。③ 先进的产品开发方法( 基于质量源于设计) 。④ 实时获得产品质量信息。⑤ 更容易改变规模以适应供应需求。由此可见,连续制造能够确保时间、金钱和物料的最少浪费。物料没有等待时间,并且在此过程中不会停止运送。作为连续制造的产品数量可以通过时间戳、产生的物料量或使用的物料量来定义,因此比批量生产更具效益,主要是连续制造可以更准确地跟踪产品流,从而实现质量控制,以精确定位和隔离确切的缺陷物料[2 - 4]。
然而在常规化操作过程中,连续投入的物料属性、工艺条件或环境因素可能存在瞬时工艺波动,因此实时监测质量属性与调整操作参数极为关键。依据美国 FDA 建议在连续制造过程中必须制定控制策略,制造商应考虑连续生产工艺中预期和发生意外的变化[1]。其中控制策略的定义为对当前产品和对工艺理解的一系列计划的控制措施,可确保工艺性能和产品质量。因此控制包括原料药和药物制剂物料与组分相关的参数和特性、工艺和设备的运行条件、在线控制、成品质量标准以及相关方法和监测与控制频率等(参考ICHQ10件) 。而 FDA 鼓励的过程分析技术( process analytical technology,PAT) 就是通过实时监控和过程控制策略使具有预定质量属性的产品达到一致性[5 - 6]。
具体内容包括满足关键质量属性( critical quality attribute,CQA) 的标准来确保所需产品质量的性质; 进一步监控会影响质量属性的关键过程参数( critical process parameter,CPP) 以确保生产出期望质量的产品。而这些变量均是设计控制策略所必须考虑的重点。实施 PAT 可进一步促成连续制造,具体包括: ① 集成化,提供关键过程测量以集成到在线控制系统中。② 数据化,借由收集数据可详细理解过程性能,协助工艺改进和建立模型。③ 控制化,实现异常事件的早期诊断与实时控制。而过程分析技术在连续制造上的应用扩展,可进阶到产品实时放行( real time release) 决策,符合 FDA 和 ICH Q8 指南鼓励实时放行测试( realtime release testing,RTRT) 方法的期待。因此从实践意义上,连续制造技术要求在整个产品生命周期中采用全面的整体控制策略,以可重复性和一致性的标准确保在产品放行时和整个产品保质期内符合预期产品质量[7 - 8]。因此基于过程分析技术在连续制造技术的控制策略及其关键性已从传统制药生产上“可有可无”升级到“必须配置”的层级上。
一、连续制造中的过程分析技术
1、工具考虑
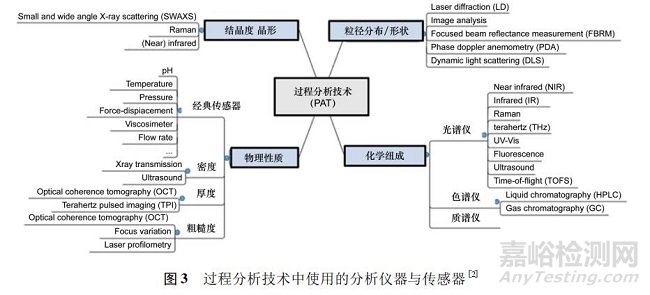
过程分析技术框架体系中要求实现快速采集信息、增强工艺理解、实施连续改进和降低风险[5]; 建议工具包括: ① 多元数学统计手段( 如实验统计设计、响应曲面法、过程模拟和模式识别软件) 的应用及对产品和过程变量进行鉴定和评价的多元统计工具( 如化学计量学) 。② 光谱仪器,如近红外、中红外、拉曼光谱、质谱和高速色谱等,无损检测并能提供待加工物料的生物学、物理特性及化学特性有关信息的过程分析仪器( 见图 3) 。③ 保证对所有关键质量属性的有效控制,包含过程监测和控制策略的过程控制手段。④ 连续改进和知识管理。通过对数据采集和分析得到的知识积累,可作为批准后工艺变动的建议与评价依据。由此可见,PAT 项目开展必须是“软( 件) 硬( 件) 兼施”。在固体制剂连续制造中多半采用快速近红外( 如二极管阵列) 与拉曼光谱仪; 而 API 合成的流动化学上,则多半运用中红外、拉曼光谱仪或小型核磁共振仪等。在工具安装时也须评估流量扰动时测量时间与流量差距、探头的数量与位置、探头失效或探头维护等多种因素。一般 PAT 信号受可变流量和粉末密度影响,使得准确计算移动粉末的效力非常具有挑战性。长时间( 通常为 3 ~ 5 d) 的连续测量需要仪器具有高度基线稳定性和特殊探头技术以防止粉末在探头上积聚。
2、动态采样挑战
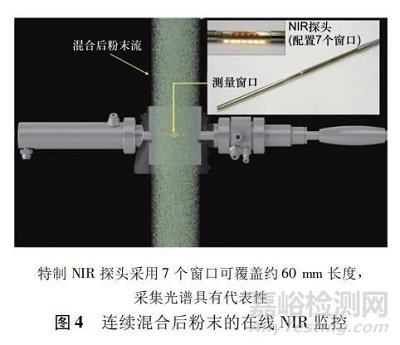
在美国 FDA 推出使用过程分析技术用于药品制造的倡议之后,创新传感技术在过去几年中激增。然而这些技术的开发大部分是基于批量生产,且以生产粉末物料或最终产品是静态并且可以多次测量为主。将过程分析技术纳入药物生产的连续过程,其挑战主要在于必须将传感器/分析仪重新配置到连续框架中,且粉末或液体流是以动态形式呈现,而如何实现动态测量及使抽样具有代表性是必须重视的难题。如何改造设备以便使过程分析技术设备收集到正确的数据是连续制造面对的重点考虑之一。一些简单测量( 如流量、压力和温度) 可较容易从线上传感器获得。其他一些复杂的测量,需要有创新性的设计,如在线近红外光谱( near infrared,NIR) 测量时,须改造采样探头与处理设备的物理接口。图 4 示范在线近红外探头可大面积窗口测量粉末的混合均匀性。
基本上采样探头在测量任何物料的主要成分时必须考虑以下几项关键重点: ① 避免物料覆盖到测量探头窗口。② 确定实际测量样本量,例如在收集光谱期间测量的粉末取样重量或体积。③ 优化探头的装设位置,确定探头不会阻挡或影响粉末流; 同时应该放置在可测量到移动粉末流,而不是只测到黏着在漏斗壁上的粉末( 即当发生流动通道) 。④ 选定取样量或频率应具代表性,采用适当的统计方法证明采样与其衍生方法的分析合理性( 如置信度和覆盖范围) 。当前 PAT 所需探头可商业化订制,一般粉末包覆探头的解决方案包括自动刮除、空气吹扫或自动清洗等。使用者可以通过针对消除附着探头窗口的解决方案来提高其在线检测效率。Sierra Vegaa 等[9]在最近研究中,使用 NIR 法评估连续直接压片工艺混合均匀性的取样位置。该研究包括开发 2 种在线偏最小二乘( partial least square,PLS) 校正模型,一种是在混合过程后的过渡滑槽中,另一种是在压片机的进料架中。实验结果表明,在连续搅拌器的旋转速度下,粉末的药物浓度明显受到影响。滑槽中的粉末均匀性不能代表片剂的含量均匀性。该研究证明了进料架内的混合效应有助于降低粉末混合物的不均匀性。
在线光谱分析时对于预测模型的优化,多倾向采用大样本量的统计建模方法来改进。然而在建模过程中为了降低主要成分药品的消耗,避免大生产的额外资源浪费,可考虑采用更多的可变通方案建立稳健模型。例如美国礼来公司 Hetrick 与 Shi 等为了更有效开发 NIR 定量 API 的 PLS 校正模型,创新开发了使用小尺度“离线进料架桌”的方法收集更具代表性的校准光谱。据估计进料架桌上进行校准可达到相同的模型稳健性,但所消耗的活性药物成分比完整的 CM 工艺设备上进行校准时减少 95%。
此外,借着模拟整个连续制造过程中压片机进料架中粉末差异,可获取影响连续制造过程设备预期的动态变化。该文进一步描述了各种光谱预处理方法对多变量模型的误差统计的影响。进料架桌方法成功用于连续药品生产过程中压片机进料架的过程监控,证明了光谱监测中的小尺度进料架桌与完整大生产连续制造过程之间的等效性[10]。
3、模型的分类与风险考虑连续制造过程变化性
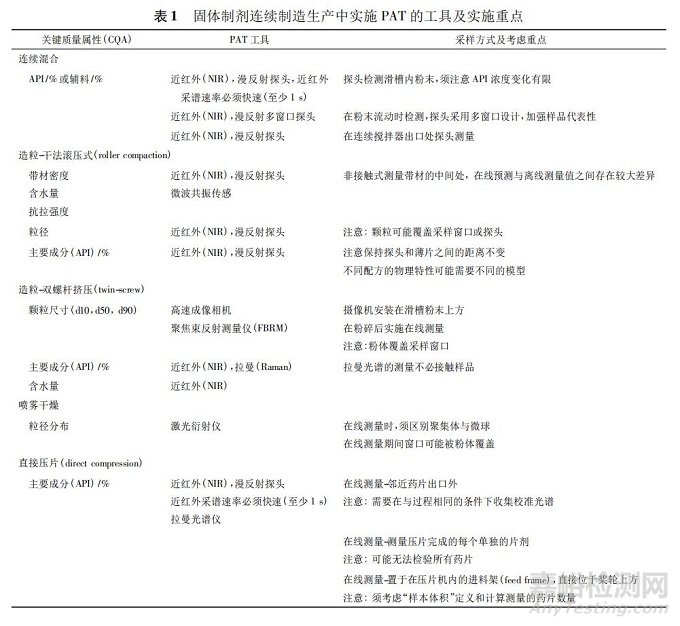
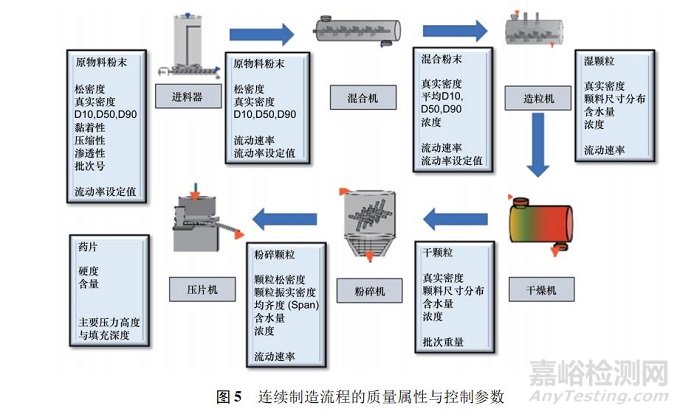
源于 CPP 和关键物料属性( critical material attribute,CMA) ,这些变化将影响 CQA 和整体过程性能。完全实现理解工艺的特性,包括区别和解释产生可变性的所有关键来源,过程中能控制可变性及根据所用物料、工艺流程参数、生产、环境和其他情况所建立的设计范围,可促成准确且可靠地预测出产品质量属性[11]。在固体制剂连续制造上,事先鉴别各单元操作的原料与质量属性以及相对应的操作条件为重点( 见图 5) 。表 1 列出固体制剂连续制造生产中实施 PAT 的工具及实施重点。如何具体从关键物料属性、CPP 与 PAT 数据中预测关键质量属性并立即做出控制决定是关键,而且能够兼顾预测模型理论、开发流程与验证原则的正确性。如果设计适当,稳健及可靠的模型预测可以使得工艺过程始终保持在受控状态。一般作为控制策略的模型有 3 种类别: 机理模型、经验模型和两者结合的混合模型。
在连续制造领域中,可以见到这 3 种模型均有应用。机理模型是以科学依据理解变量之间关系,可用于识别和表征 CPP 和质量属性的变化。建模以决定性演算为主,以第一原则、基础理论或基于物理原理为依据。一般多采用总体平衡模型( population balance model) ,配合停留时间分布( residence time distribution) 的计算判断,可用于测量连续混料器中的粉体流量与控制物料均匀分布。经验模型则是通过经验认识关系,建模以数据为依据,工具包括统计分析、实验设计、多变量分析与机器学习。典型的例子是运用 NIR 结合工艺过程监测的多变量数据分析模型。而混合式模型结合了机理模型,配合经验式化学计量学模型。开发模型时须依据科学合理的原则和条件,并能够反映常规商业化大生产的规模。一般应用在连续制造的 PAT 模型多为中影响( 如中控) 或高影响模型( 如实时放行测试) [3]。注意传统的建模策略可能需要仔细评估,尤其是样品的代表性,例如,在动态流动条件下,无法将单一测量点的 NIR 数据与总体取样参考样品的液相分析结果相关联。
4、 过程监控的控制策略与实时放行
制药生产过程必须配合有效的控制策略,其目的是取得投入物料、中间体和成品中监控工艺参数和属性的实时信息,并在物料移送中可以检测瞬时干扰和工艺偏差,实现更准确主动工艺控制,降低这些潜在干扰产品质量的风险。美国 FDA 的 Lee 等[3]在讨论连续制造的质量重点中,具体说明了 3 种不同等级的控制策略。
一级控制为主动性自动控制。利用过程控制系统实时监控物料的质量属性。自动调整过程参数反应干扰,确保质量属性始终符合既定的验收标准。例如,NIR 混合监测并反馈控制进料过程中的物料主要成分。
二级控制为选择性分析控制,包括适宜的最终产品测试以及在已建立的设计空间内灵活操控原物料属性和工艺参数。产品和工艺理解可借着建立多变量设计空间而识别可能影响产品质量的原物料和工艺可变性的潜在来源。例如,使用过程监控来移除不合格物料。
三级控制为传统性规格控制。由于对原物料和工艺可变性如何影响产品质量的理解可能有限,因此控制须依赖严格约束的物料属性和过程参数,并通过广泛的最终产品测试降低放行劣质产品的风险。三级控制通常不适用连续制造的监控,部分原因是制造期间存在瞬态过程扰动的风险。
多数连续制造系统的特征混合模式采用一级与二级的混合控制策略,结合不同控制水平的方法,其中包括过程参数限制( 设定点和警报) 、过程监视( 包括 PAT 数据) 、过程控制( 反馈和前馈) 、物料移除和实时放行测试的集成。对于中控分析过程中物料,评估其在过程中的变化并确定一致性/不一致性的警告限制。实施上则着重在中控范围内采取控制措施,确保符合验收标准以及在中控验收标准内设置调整工艺的限制措施,并加以实时监控。其目标是唯有通过中控的所有物料才可在批次分析中放行。如果物料的可追溯性方法、过程监控和物料移除机制已建立,生产过程中可实现隔离和去除不符合中控验收标准的物料,不致影响该批次的其他部分。
在质量源于设计与 PAT 的倡议中,ICH Q8 制剂开发文件定义了实时放行测试( RTRT) 原则: “基于过程数据,评估与确保中间品和最终产品的质量”[12]。这些数据可用于构建反馈和前馈控制回路。这意味着当完全理解工艺并且可以随时确保最终产品质量时,产品可以在生产后直接放行到市场。运用成熟的过程分析技术可保证产品质量,在生产后直接放行产品,而不是在批次完成后等待产品测试完成后做出决定。实时放行可以用于批次生产,因为批次中若没有偏差,则可以直接放行。而在连续制造中的实时放行,则是在没有偏差的情况下实现连续放行产品。从运行角度而言,在线测量可识别不合规格的产品,并允许在产品超出规格之前将其隔离甚至识别其相对应关键质量属性的变化。从过程理解的内涵上,实时放行测验还应评估在多批次生产阶段性所观察到关键质量属性的差异,以确定其在批次内和批次间的差异性作为持续改良的依据。从研发目标上,实时放行测验实施前,其相关方法开发、模型验证及控制步骤必须完全确立,系统中的所有 PAT 工具都已安装并确验,必要时须了解系统的开环动态,并估计必要的时间滞留常数。从法规角度,如果将在线 PAT 方法作为常规方法( 无备选方案) 提交给药监部门时,药企应制定实时放行测验计划,内容包括解决 PAT 数据中的潜在差距,描述当 PAT 分析仪无法使用时的后续操作( 如 PAT设备失效故障) 等要点。虽然连续生产工艺并不一定涵盖实时放行测验,但欧美药监部门鼓励制药行业实施部分或全部成品质量属性的实时放行检测,尤其是鼓励大型创新药厂将实时放行作为连续制造商业化后高效率与经济效益的重要目标。
5、PAT 和过程控制系统集成
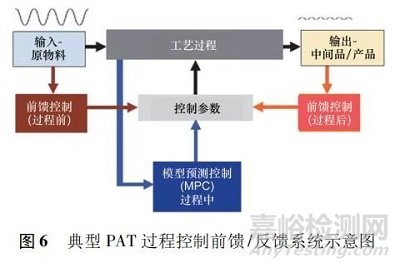
在现代商业化批次处理过程中,制药单元操作大多以“自动化孤岛”的模式运行,但连续制造的目标是通过使用总体过程控制系统将多个单元控制在同一个单元内。在进入制业工业 4. 0 的前提下,制药行业正在从人工决策的控制转向先进的过程控制,其中以过程数据和建模软件实现自动控制过程化,以集成 PAT 方法为连续过程中的监测工具,进一步将监测数据整合到过程控制中。当连续过程与实时分布式控制系统集成时,可参考其他化工行业中成功使用的“闭环过程”架构,借助闭合循环过程系统可保证所需预定产品质量的实现。因此在前馈/反馈或闭环控制系统中,实现动态调整关键工艺参数并回馈到控制器中,确立过程保持在规格之内,可实时测量原始和中间 CMA,CPP 和最终产品关键质量属性参数( 见图 6) 。
最近 Singh 等[13]在连续进料器和搅拌器系统中设计了集成控制硬件和软件,在搅拌器出口处采用 PAT 系统读取 NIR 谱数据并配合多变量分析模型执行主成分分析和偏最小二乘法,提供主成分浓度和相对标准偏差值。这些关键质量属性作为过程控制系统中模型预测控制( model predictive control,MPC) 的输入值。在此设计中,MPC 概念包括线性过程模型与当前过程测量( 配合 PAT) 的组合,以预测未来既定步骤的过程输出。在此研究中使用2 组关键质量属性输入值来驱动进料比例和搅拌器速度。MPC 的进料比例输出产生进料器的流量设定值,然后由从属比例-积分-微分控制器( proportional integral derivative,PID) 控制,最终实施的控制方案利用 PAT 数据管理系统来集成数字自动化系统[13]。
美国新泽西 Rutgers 大学特别成立 C-SOPS研究中心专注于与大型制药公司合作运行特定配方作为案例研究,以建立关于如何将光谱数据用于实时放行测试的知识工具箱。他们与英国 GSK 公司进一步在进料器和连续双螺杆制粒机的单元操作上设计了控制回路,其中回馈线由内置比例-积分-微分控制器和前馈/反馈控制器组成。设计重点是以前馈控制器排除对产品扰动的影响,同时再以反馈控制器纠正过程扰动。自仿真研究证明,基于在线NIR 测量 API 的 MPC 表现比 PID 控制器更好[14],因此整合过程控制的挑战是确认 PAT 仪器 /设备数据可以无缝接轨闭环控制系统。其目的是完全实现制药智能化主动控制,确保预期生产结果并支持实时放行策略。例如,美国辉瑞公司的 Chantix 药品,其申报的实时放行应用程序已在所有主要市场和世界其他大部分地区完成。辉瑞公司相信实时放行测试的价值在于取样送到实验室的传统测试将会减少,降低人力与资源成本,有助于实现供应链现代化,灵活应对市场操作,并保持较低的库存量。
二、固体制剂连续制造的 PAT 实施概况
通过连续过程制造固体口服药物产品是欧美药企新药开发与应用的重点,而国内药企也逐步展开评估与应用。在固体制剂连续制造中,物料将定期计量加入过程中,并重复生成产品。进入物料通常具有较短的停留时间( residence time) 以转换成所需产品( 如药物、中间体、药物产品混合物、成品剂型) 。因此原物料的特性与进料过程是关键操作,其重点包括: ① 限制进料在上限和下限附近,以生产符合质量的原料。② 评估操作变化的影响( 例如,在进料器补充期间从重量转换为体积流量) 。③ 评估辅料进料变化对产品性能( 如溶出度) 的影响。由于所需的物料是不间断生产的,因此进料期间须不断确认物料质量,必要时调整其工艺参数以保持一致的产品质量。通常整体系统中的传送过程可能引起一定程度的扰动( 如粉末的分离或聚集) ,过程中物料沿着管线传送后,系统中产生的扰动将随着传送而趋于平缓。在解决方案中,系统对扰动的动态行为除了利用在线光谱分析外,尚可通过停留时间分布( residence time distribution,RTD) 方法评估物料流动趋势,确定其数学机理模型。例 如,Rehrla 等[15]开发了 3 种常用连续工艺( 直接压片、湿法制粒、热熔挤出) 的数学模型,根据从进料器数据计算的 API 浓度预测混合步骤后的 API 浓度。这项研究提出了一种软传感器( soft sensor) 模型,该模型捕获了上述 3 条生产线的混合步骤的停留时间分布,允许整体分析系统并支持整体控制策略的开发。

在适合条件下,开发停留时间分布模型可替代昂贵的 NIR 设备,甚至可提供已装置 NIR 仪器后可能的故障或信号漂移信息[15]。使用 NIR 监测旋转式压片机中的进料架内循环粉末的活性成分已成为新兴的 PAT 应用项目,原因是可直接检视粉末物料在压片前的质量情况。设计上是将 NIR 探头安装在进料架上,紧接在压片模具的填充器之前,可在片剂压片过程前进行活性成分测定,计算压成片剂的物料测量值( 见图 7) 。美国礼来公司与辉瑞公司的研究报告发现,压片过程参数包括桨轮转速和 NIR 探头位置,必须针对不同的压片机的几何形状进行优化,以确保 NIR 过程信息可与片剂活性成分相关。他们认为在线 NIR 技术可用于鉴定粉末从中间散装容器( intermediate bulk container,IBC) 排放粉末期间的分离情况,进一步理解在进料架内粉末混合的动力学,并可成为压片过程中故障检测片剂的诊断工具。该 PAT应用还可以与压片机控制系统集成,成为片剂通过或拒绝的装置,也可以通过在进料架内连续监测粉末循环中活性成分和均匀性的实时放行测试[16]。
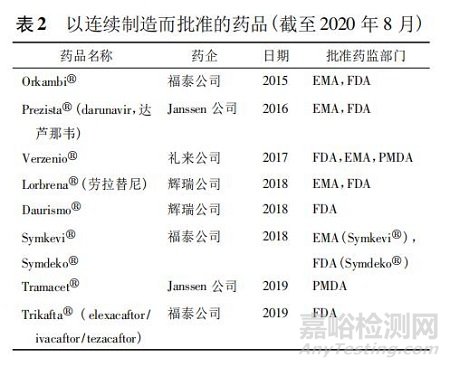
截至目前,采用 PAT 技术的连续生产实施上,至少已有 8 种新药通过欧美或日本药监部门的审批程序( 见表 2) 。2015 年美国福泰公司( Vertex) 提交第一个新药申请( new drug application,NDA) 批准使用在连续制造技术生产。为此还在美国波士顿附近建造了一个占地 370 平方米的连续生产车间。申请的药品 Orkambi 是基于 PAT 控制策略生产的连续制造药物产品,含有 2 种活性药物成分 lumacaftor和 ivacaftor 的固定剂量组合片剂。福泰公司以连续制造和 PAT 用于控制和实时产品放行,已经通过欧美药监部门检查和审批。此连续制造的工艺是将辅料连续分配、混合、湿法制粒、干燥、粉碎、终混、压片和薄膜包衣。据报道有 3 项位置使用连续湿法制粒工艺生产药品,系统和 PAT 功能在不同位置之间略有差异。


图 8 中显示其中一个生产现场连续模式下操作的系统,包含从单个组件进料到薄膜包装的药片单元操作。表 3 中也列出 PAT 工具和相关的测量结果与放行标准。福泰公司将各个测量结果组合在一个控制策略中,该策略允许连续监控整个过程,这样可以根据需要进行工艺调整,以确保物料符合规范,并可隔离不合格物料或中间产品。此外福泰公司的囊性纤维化三联疗法 Trikafta( elexacaftor/ivacaftor/tezacaftor) 于 2019 年 10 月获批。在此申报中,采用PAT 技术有助于 FDA 认同申报者的产品质量一致性和即时控制能力,可促使注册流程的简化,审评批准时间从一般 10 个月降低至 3 个月。
2016 年美国 Janssen 公司出品的 Prezista 600 mg片剂是第一个从批次制造变更成连续制造过程的新药补充批准。Janssen 公司选择直接压片的连续制造技术,药片采用直接压片的连续制造平台生产。原物料通过真空输送到进料器、混合、压片和包衣的系统,采用全自动和 PAT 控制的连续过程中进行,其中混合均匀度是由在线多探头阵列 NIR 监控,含量均匀度由临线 NIR 预测。与批次生产比较,连续制造产生 1 000 kg 所需的产品从传统 13 d 缩短至2 d 内,而设施面积仅占传统批次生产的一半,其中测试和放行时间也从 30 d 缩短至 5 d[17],由此可证明连续制造的经济效益不容忽视。
美国礼来公司的 Verzenio 产品则是在 2017 年获得 FDA 批准连续制造。其系统是一个半集成的直接压片连续制造平台,包括高精度的粉末进料、混合和压片。独特的创新升降系统支持主流程系列,便于操作、清洁和转换。礼来公司开发并部署进料架 PAT 工具,达到实时确认药品连续制造过程时 API 在最终混合物的浓度。此处的 PAT 工具是指能够测量粉末形式的 API 浓度的 NIR 技术,其实时放行测验的控制策略包括确保在进料框架内收集片剂并使片剂重量和NIR预测的API浓度( 混合均匀性) 处于预定限制内,超出这些限制的可疑药片通过压片机的卸料斜槽触发自 动清除。
美国辉瑞公司在 2015 年就开发出原型阶段的便携式、连续式、微型和模块化( portable,continuous,miniature and modular,PCMM) 连续制造系统,使用GEA 药机厂的 ConSigma 处理系统,该系统可以使用 G-CON POD 预制洁净室并安装在“集箱”设施。此设计连同需要的 PAT 仪器可以在一个地点快速安装,必要时将系统移动到另一个地点。辉瑞公司于2015 年在康涅狄格州格罗顿安装了第一台 PCMM 装置,2018 年在德国弗莱堡安装了相同的加工设备。
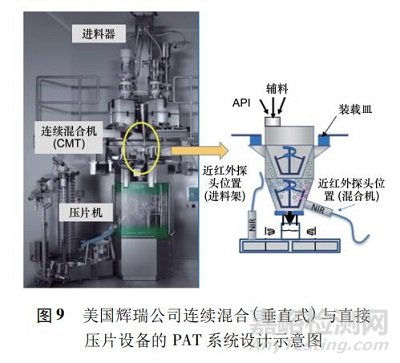
在 PAT 系统设计上,辉瑞公司运用近红外光谱仪监控连续混合过程与旋转式压片机进料架内粉末的活性成分,从而保证所得片剂的含量均匀性( 图 9) 。他们也在 2018 年使 DaurismoTM ( glasdegib) 获得美国 FDA 新药申请批准。
三、结论
连续制造比传统的药物批次生产具有显著的自动化监控与质量一致性优势,符合制药工业 4.0的概念。在欧美监管部门、高校研究中心、先进制药公司和药机设备供应商的共同努力下,已激发了连续制造药物的新范例。但是在连续制造的具体实施上必须调研配方选择、工艺设计、设备开发、工艺放大、过程控制、在线质量保证以及新兴技术的经济成本等因素。但值得关注的连续制造控制策略必须配合PAT 技术的运用,以完成工艺开发、质量改进和产品生命周期管理等关键要素。PAT 在连续制造中的核心角色为其工艺控制策略,研究人员应该评估最适合监测所需关键属性的 PAT 工具,并熟悉其技术与商业化成熟度。而多变量数据分析、过程模型的风险评价、前馈/反馈或闭环监控和大型数据库管理来实时分析,支持中控或实时放行测验。基本上 PAT涉及多元化的学科,需要吸引具有许多科学和工程领域背景的专家,以鼓励当前与未来的发展领域,并依赖于软/硬件的运用与合规要求。预测未来PAT 应用范例将会持续增长且运用经验也更加成熟,商业化硬件可以即插即用,预测模型可以转移,为制药连续或批次制造工艺问题上提供更专业的解决方案。与此同时,如何在国内制药行业中将 PAT变得更容易在车间实现,并合规或符合标准要求,将会是行业、监管与学术界积极努力的方向。
参考文献
[1] CENTER FOR DRUG EVALUATION AND RESEARCH. Quality
considerations for continuous manufacturing guidance for industry
[EB/OL]. [2020 - 04 - 14]. https: / /www. fda. gov /Drugs/
GuidanceComplianceRegulatoryInformation /Guidances/default. htm.
[2] KHINAST J,RANTANEN J. Continuous manufacturing of pharmaceuticals[M]. John Wiley & Sons Ltd,2017.
[3] LEE SL,O'CONNOR TF,YANG XC,et al. Modernizing pharmaceutical manufacturing: from batch to continuous production
[J]. J Pharm Innov,2015,10: 191 - 199.
[4] 王芬,徐冰,刘雨,等. 中药质量源于设计方法和应用: 连续制
造[J]. 世界中医药,2018,13( 3) : 566 - 573.
[5] CENTER FOR DRUG EVALUATION AND RESEARCH. Guidance for industry PAT-A framework for innovative pharmaceutical
development,manufacturing,and quality assurance[EB /OL].
( 2004 - 09) . https: / /www. fda. gov /media /71012 /download.
[6] 省盼盼,罗苏秦,尹利辉. 过程分析技术在药品生产过程中的
应用[J]. 药物分析杂志,2018,38( 5) : 748 - 757.
[7] VARGASA JM,NIELSENB S,CRDENASA V,et al. Process
analytical technology in continuous manufacturing of a commercial
pharmaceutical product[J]. Int J Pharm,2018,538( 1 - 2) :
167 - 178.
[8] FONTEYNE M,VERCRUYSSE J,DE LEERSNYDER F,et al.
Process analytical technology for continuous manufacturing of solid-dosage forms[J]. Trends Anal Chem,2015,67: 159 - 166.
[9] SIERRA-VEGAA NO,ROMN-OSPINOB A,SCICOLONEB J,
et al. Assessment of blend uniformity in a continuous tablet manufacturing process[J]. Int J Pharm,2019,560: 322 - 333.
[10] HETRICK EM,SHI ZQ,BARNES LE,et al. Development of
near infrared ( NIR) spectroscopy-based process monitoring methodology for pharmaceutical continuous manufacturing using an offline calibration approach[J]. Anal Chem,2017,89: 9175 -
9183.
[11] 常恩浩,过芳,陈宇雷,等. 过程分析技术在流化床制粒,包衣
过程监控中的应用[J]. 今日药学,2019,29( 12) : 857 - 860.
[12] ICH Q8 ( R2) . Pharmaceutical development[S]. 2009.
[13] SINGH R,IERAPETRITOU M,RAMACHANDRAN R. Systemwide hybrid MPC-PID control of a continuous pharmaceutical tablet manufacturing process via direct compaction[J]. Eur J Pharm
Biopharm,2013,85( 3) : 1164 - 1182.
[14] PEREIRA GC,MUDDU SV,ROMN-OSPINO AD,et al. Combined feedforward /feedback control of an integrated continuous
granulation process[J]. J Pharm Innov,2018,14( 15) : 1 - 27.
[15] REHRLA J,KARTTUNENB AP,NICOLAC N,et al. Control
of three different continuous pharmaceutical manufacturing processes: Use of soft sensors[J]. Int J Pharm,2018,543: 60 - 72.
[16] HOWARD W. WARDA,DANIEL. BLACKWOODA,MARK POLIZZI,et al. Monitoring blend potency in a tablet press feed frame
using near infrared spectroscopy[J]. J Pharm Biomed Anal,
2013,80: 18 - 23.
[17] WARMAN M. Control strategy in continuous manufacturing of
drug product[C]. Washington,DC,USA,2014.