临床研究的数据是论证研究器械/药品安全有效的最重要实证,良好规范的数据管理是保证临床试验质量的关键,是获取完整、准确、真实、可靠的临床研究数据的前提和保障。
国际上通常将临床研究数据评价分为数据质量和完整性两个方面,美国FDA对数据的质量和完整性的标准做了明确的定义。2012年国内的SFDA起草的《临床试验数据管理工作技术指南》也对数据的质量评估作了明确的规定,指南中同样引用了该标准。虽然数据的质量和数据的完整性有着密切的联系,但是在概念上它们之间是相互独立的。
临床研究的数据质量评价有多个方面,CSUCT指南对于数据质量的要素作了明确的定义,包括归属性、可读性、实时性、原始性和准确性。合称为ALCOA原则。除此之外,良好的数据质量还应达到留存的持久性、采集的完整性和内外的一致性,以上三点与ALCOA原则合称为ALCOA+原则,数据质量的高低取决于数据对于这些属性的展现程度。
一、ALCOA+原则
1、归属性
首先是数据点自身的归属问题,每一个数据点都应能够清楚地标明其出处和意义。例如对于心率30次/分钟的数据点,应能够明确该数据点属于哪个受试者,哪个访视期所采用集到的观测值。
其次,对于归属性的理解还包括数据的创建历史,每一个数据都应能追溯到其源数据及其创建者,能清楚地反映是谁观察并记录了该数据。也就是和一个具体成因或者来源相联系,数据的归属性是稽查者重点关注的内容。对于电子数据采集系统,电子签名数据的创建者更明了。
数据的归属性也是数据完整性的重要内容,能够清楚地表明何时、何人及其对数据操作的类型,包括对数据的增、删、改,这些内容也是稽查痕迹的主要结构。
2、可读性
所谓可读性,首先是要求记录的数据信息字迹必须清楚可辨,任何不能被清楚阅读的数据可能导致误解,因此不能被认读和理解的数据均不应该被采用。
对于字迹清楚可辨的要求,实际上也暗含了对文档保存的要求。对于数据记录的纸质文档必须要用钢笔或水笔来写,这样随着时间推移字迹不会因为变淡或褪色而模糊难辨。对于采用电子采集的数据,FDA明确要求存档的内容和数据同时能够被人和系统阅读,这也对EDC系统做了明确的技术要求。
对于可读性的要求,还包括对修改数据的操作要求。若需要对数据进行修改,原始的首次记录必须被清楚地保留,因此对于修改后的原始数据建议用删除线表示,而不应该涂黑导致不可读。因此,做任何更正时应保持原记录清晰可辨,由更正者签署姓名和时间。
3、实时性
实时性对数据记录和数据观测的时间节点提出了要求。任何数据的延迟记录或录入均会由于回忆偏倚而导致数据记录的偏差和错误。因此,对于观测数据,越早越及时的记录,数据质量也就越高。
实时性也包括整个数据库的更新情况,只有实时的数据采集和数据更新才能为数据的实时分析和管理提供可能,为临床研究决策的及时得出提供有力支持。此外,对于EDC系统,实时性对数据的及时录入采集也提出了要求。
实时性实际上暗含了对数据录入时间节点记录的要求,任何数据的录入都应当有录入的日期和时间。21CRF也提出了数据点时间标识的要求。
4、原始性
第一次采集的数据叫源数据。源数据是唯一的,任何数据不可能有多重源数据。源数据作为最早记录的数据,通常被视为更准确和可靠。
数据的原始要求:源数据必须完整地记录和保存在原始文档中。原始文档也叫源文档,也叫源文件,是指制作副本或翻译的原本。临床研究中通过复制、扫描的文档,应注明复印件等标注以示与源文件区分。GCP也规定了研究病历作为临床试验的原始文件,应完整保存。
对于EDC系统,FDA已有药政法规认可和接受的电子源数据和电子源文件。
5、准确性
准确性是数据质量的最基本要求,要确保录入的数据能完整准确无误地反映临床研究过程和结果,准确性无法保障的数据是无法用于研究分析的。
准确性还包括临床研究的数据采集是否符合研究方案的需要,只有正确按照方案设计来实施临床研究,保证方案的依从性,才能够确保数据的准确性。
准确性也暗含了数据在转录和传输过程中保持数据可靠性的要求。
6、留存的持久性
持久性是指数据能长时间保存。实验结束后所有的数据信息都应被做到载体中长期保存,包括数据采集过程中产生的稽查痕迹,在数据需要被审阅和稽查时能及时获取和访问。对于EDC项目电子备份的数据更易于保存和读取。
7、采集的完整性
数据采集过程中缺失的数据越少,数据的整体越好,数据的质量越高。缺失的数据包括未做(ND)、未知(UN)、无法获取(NA)等导致的空白数据点。
保存的数据库中应涵盖所有的临床研究数据,除了整套的试验研究数据外,还应包括数据创建、修改等操作轨迹及时间标识的信息。
8、内外的一致性
数据的一致性还包括内部的一致性和外部的一致性。
内部的一致性是指数据点之间的逻辑关系。例如性别和妊娠试验的逻辑关系,男性受试者不应该有任何妊娠试验的数据。因此数据内部一致性越高,临床试验的数据就越准确,数据质量也就越高。采用EDC技术,系统内部附带的编辑核查功能可以在数据输入的第一时间发现数据之间的逻辑问题,并自动发疑问和添加标注来提醒录入者。
外部的一致性是指数据标准的应用,目前临床数据交换标准协会(CDISC)建立的临床试验存储和交互标准越来越普及,CDISC标准涵盖多个模块,从病例报告表CRF设计到最后数据建立,从数据分析报告到结果的提交,目前EMEA和FDA已接受CDSIC标准的数据报告提交。
数据的一致性,还涉及数据编码标准的应用,比如对于不良事件合并用药的编码,采用《药事管理的标准医学术语集》和世界卫生组织药物词典WHO Drug 字典进行编码是国际上广泛认可的术语编码标准。
二、数据的完整性
数据完整性是判断数据可靠性和准确性的重要标志。它涉及临床研究的多个方面,从数据采集开始,到数据的录入、转移、存储、恢复、报告、申报到存档。因此,数据的完整性应当贯穿于第一个记录的出现,直至试验结果的获得和数据存储过程的各个方面。对于应用EDC系统进行数据采集的试验研究,该特性尤为重要。因为数据中的数据是从外界输入的,而数据输入由于种种原因,会发生输入无效或错误信息。因此,EDC数据必须符合纸质数据的质量标准,并能对电子源数据进行有效正确的采集和维护。所以,为了确保数据的完整性,临床研究中电子化系统和程序必须经过严谨的设计、测试、认证、维护和管理。
广义上,数据完整性包括两个属性,即物理完整性(比如自然灾害、硬件/软件错误、计算机病毒、物理损坏、系统过热死机、掉电等,这些都可能造成数据的丢失和损坏)和逻辑完整性(例如稽查痕迹的留存、数据在各数据库平台转移过程中不会发生变更等)。因此,要保证物理完整性,应急预案和数据容灾技术的应用对于EDC系统是非常重要的,而稽查痕迹的完整产生和留存也是逻辑完整性的有力保证的,只有这样才能够确保数据在任何传输过程中都能保持稳定不变的特质,使源数据值和输出数据值在整个研究过程中,乃至未来的任何时候都具有可匹配性。
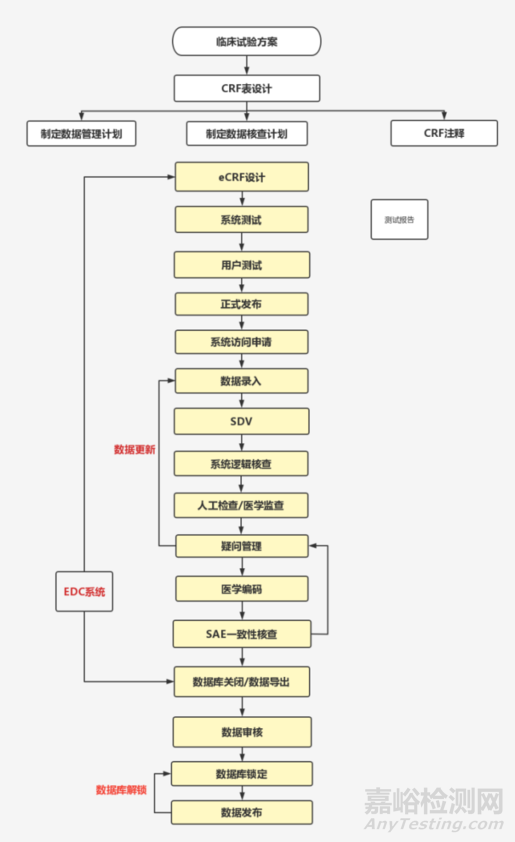
三、临床研究数据管理的一般流程
临床研究数据管理工作贯穿整个临床试验过程,决定着临床研究数据的质量。数据管理的一般流程为:
制定数据管理计划→设计数据采集工具(研究病历/CRF表)→建立数据库 → 制定数据核查计划,实现系统逻辑检查功能 → 为临床研究人员提供数据管理培训与帮助 → 数据采集 → 源数据现场核查 → 数据清理→ 盲态审核 → 数据库闭合→ 数据管理文件归档。
如下图示: