摘要
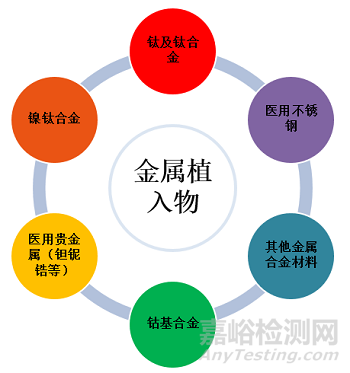
金属植入医疗器械产品植入人体后,离子析出评价是评价其临床使用安全性的重要内容,也是国内审查要点之一。
本文以镍钛合金心血管植入物为例,深入挖掘植入医疗器械产品金属离子析出试验研究的技术重点。
对镍钛合金心血管植入物进行金属离子析出试验研究,主要包含:毒理学允许限量的建立,浸提条件和时间的确认,方法学验证,离子析出含量的测定以及毒理学风险评估。
1、研究背景
人体是由化学元素组成的,组成人体的元素有60多种。人体过量摄入金属离子可能会导致神经损伤,呼吸紊乱,癌症发病率升高等。金属植入医疗器械在人体内由于磨损、腐蚀等原因会导致金属离子缓慢释放。因此植入物植入人体后,离子释放速率和释放量是评价其临床使用安全性的重要内容。
基于《介入类医疗器械产品化学性能要求的说明》技术要求和指导原则,镍钛合金心血管植入物植入人体后,镍钛合金的镍离子释放速率和释放量是评级其临床使用安全性的重要内容。
由于存在体内测试时间长、成本高,测试结果准确率低(机体对实验结果的干扰较大)等因素,在临床前评价阶段,宜通过建立镍离子体外释放模型,形成镍离子释放评价的体外试验方法,可以更方便评估离子释放风险,更好地保证相关产品临床使用安全性。在临床前评价阶段,哪些金属植入物产品需要进行金属离子析出研究呢?
2、研究方法
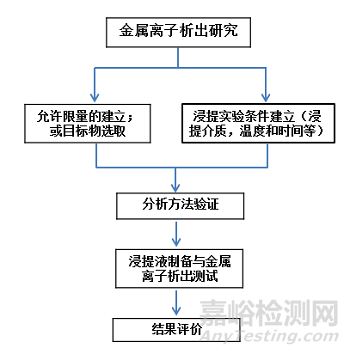
金属离子析出研究和毒理学风险评估依据ISO10993-1、ISO 10993-15、ASTM F3306、YY/T 1823-2022 《心血管植入物 镍钛合金镍离子释放试验方法》和YY/T 1802-2021《增材制造医疗产品 3D打印钛合金植入物金属离子析出评价方法》等进行,项目研究流程图如下:
3、植入物金属离子析出试验研究实例
3.1 允许限量(AL) 的建立
依据ISO 10993-17和YY/T 1823-2022 附录A等毒理学评估方法,以镍钛合金支架产品为例,进行产品允许限量的建立。
3.1.1 分析步骤



其中:
NO[A]EL:No Observed [Adverse] Effect Level,无可见[有害]作用水平;
LO[A]EL:Lowest Observed [Adverse] Effect Level,最小可见[有害]作用水平;
MF:Modified Factor,即修正因子;
POD:Point of Departure,关键评估终点。
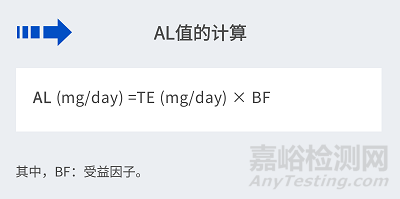
3.1.2 推导和计算过程
其中:
TI ( Tolerable intake):可耐受摄入量;
TE (Tolerable exposure): 可耐受接触量;
AL (Allowable limit): 允许限量。
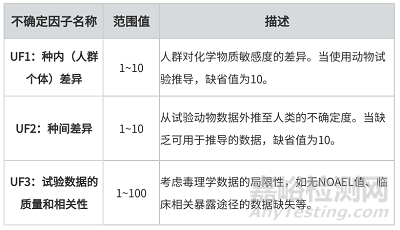
表1 不确定因子UF1~UF3描述


基于以上推导和计算过程,以及结合镍钛合金支架产品的临床使用情况,建立镍钛合金支架产品中Ni元素允许限量。
3.2 浸提实验条件建立
依据镍钛合金支架产品的接触风险,对样品整体浸泡,同时进行平行试样、空白对照试样和阳性对照试样制备。主要的浸提条件如下:
1)浸提样品:镍钛合金支架
2)浸提介质:PBS缓冲溶液(pH=7.4)
3)浸提比例:1c㎡/ml
4)浸提温度:37±1℃
5)取样时间点:1d、2d…60d
6)振荡频率:72±2rpm
3.3 金属离子析出量综合评价
通过ICP-MS 设备进行Ni 元素测试的方法学设计和开发验证,主要研究内容包括专属性、线性、检出限、 定量限、准确度、精密度(重复性和中间精密度)及耐用性。
通过使用已验证的方法对Ni金属离子析出量进行测试,从而获得Ni金属离子的阶段释放量,即Ni离子析出结果,进而进行毒理学风险评估。根据Ni离子析出结果综合评估镍钛合金支架产品在不同阶段的估计暴露量。即Ni元素前1天释放量小于mdev,1d;前30天释放量小于mdev, 30d;前60天释放量小于mdev, 60d;因此,在镍钛合金支架产品中,Ni元素的毒理学风险被认为是可接受的。
4、总结与展望
为了更好地保证相关产品临床使用安全性,金属植入物的离子析出评价将是大势所趋,也是国内审查要点之一。
本文以镍钛合金支架产品为例,依据YY/T 1823-2022 《心血管植入物镍钛合金镍离子释放试验方法》对产品中Ni离子析出评价方法进行了梳理。该标准主要是针对镍钛合金心血管植入物,包括血管支架、心脏封堵器、腔静脉滤器、心脏瓣膜等等产品。总的来说是通过金属离子体外释放模型,通过Ni元素的允许限量(AL)与估计暴露量进行比较,综合评估产品的毒理学风险是否可接受。
目前针对金属植入物的离子析出评价标准,主要是YY/T 1802和YY/T 1823,但这两个标准的适用范围相对整个医用钛合金材料及其器械产品来说还是比较窄,目前国际参考ASTM F3306已经推行多年,但国内金属离子析出评价方法还未出现具备整体指导作用的通用标准,因而对于金属离子尤其是人体必需元素的安全性评价还有较长的路要走。
【参考文献】
[1] ISO 10993-1, Biological evaluation of medical devices Part 1: Evaluation and testing within a risk management process (2018).
[2] ISO 10993-12, Biological evaluation of medical devices-Part 12: Sample preparation and reference materials (2012).
[3] ISO 10993-15:2019,Biological evaluation of medical devices — Part 15: Identification and quantification of degradation products from metals and alloys
[4] ISO 10993-17, Biological evaluation of medical devices Part 17: Establishment of allowable limits for leachable substances (2002)
[5] ISO 10993-18, Biological evaluation of medical devices-Part 18: Chemical characterization of medical device materials within a risk management process (2020).
[6] ICH Q2 (R2) Validation of analytical procedures: Text and Methodology.
[7] ICH Q3D(R2), Guideline for elemental impurities.
[8] ChP<0412>, Inductively Coupled Plasma Mass Spectrometry (2020).
[9] ChP<9101>, Guideline for analytical methods of pharmaceutical quality standards (2020).
[10] USP <232> Element Impurities-Limits
[11] USP<233>Element Impurities-Procedure
[12] ASTM F3306-19 Standard Test Method for Ion Release Evaluation of Medical Implants.
[13] YY/T 1802-2021《增材制造医疗产品 3D打印钛合金植入物金属离子析出评价方法》
[14] YY/T 1823-2022《心血管植入物 镍钛合金镍离子释放试验方法》
[15] T/CSBM 0011-2021 医用钛合金植入物金属离子析出评价方法