摘 要 Abstract
目的:基准评估作为一种提升监管能力的手段,已经被监管机构广泛运用于推进药品监管能力建设。本研究旨在基于国际监管能力基准评估方法和工具,系统性地梳理推进药品监管能力的评估指标和分析相关的国际应用经验。方法:将发布了具体的监管能力基准评估方法或工具的世界卫生组织、欧洲药品监管机构负责人组织、经济合作与发展组织、国际监管科学创新研究中心、美国政府问责办公室纳入研究,分析上述组织/ 机构官网报告和相关文献,采集、剖析相关数据。结果与结论:本研究综合对比、分析了现有的基准评估指标体系,建立了全面评估框架及指标,为药品监管机构建立基准评估工具提供重要的参考依据。药品监管能力基准评估工具通过多元化指标体系,整体评估国家监管体系、利益攸关方参与、监管效果评估和事后行为,同时从药品全生命周期中各运营层面细化评估注册及上市批准、上市后监测、药物警戒、许可申请及发放、监管稽查、实验室规范、临床试验监管和批签发。从应用层面看,不同发展阶段的国家监管机构已分别运用不同的基准评估工具进行内部基准评估、外部基准评估、职能基准评估或流程基准评估识别监管绩效,从而提升监管实践。基于基准评估结果,有针对性地配置资源进行持续的质量改进,对推进监管能力建设至关重要。
Objectives: As a means to enhance regulatory capacity, benchmarking has been widely used by drug regulatory agencies (DRAs) to promote regulatory capacity building. This study is aimed at systematically analyzing the regulatory capacity benchmarking indicators and exploring international benchmarking experiences in advancing drug regulatory capacity. Methods: The relevant initiatives from the World Health Organization (WHO), Heads of Medicines Agencies (HMA), Organization for Economic Cooperation and Development (OECD), Center for Innovation in Regulatory Science (CIRS) and U.S. Government Accountability Office (U.S. GAO) were thoroughly studied to analyze the specific regulatory capacity benchmarking programs or tools, together with a literature review to collect and analyze the latest data on the utilization of benchmarking by DRAs. Results and Conclusion: This study comprehensively compared and analyzed the existing benchmarking indicators system and a systematic assessment framework was proposed to provide a reference basis for DRAs to develop their own benchmarking tools. The comprehensive collection of benchmarking indicators of the drug regulatory capacity is mainly used to assess the national drug regulatory system, stakeholder engagement, regulatory impact assessment, and ex-post evaluations at a system level covering major functionalities throughout a drug life cycle such as drug administration and marketing authorization, post-market surveillance and control, pharmacovigilance, license application approval, regulatory inspections, laboratory practices, supervision of clinical trials, and lot release at the operational level. Furthermore, different DRAs have used different benchmarking tools for internal, external, functional or process benchmarking to identify the performance of their regulatory practices. For DRAs to achieve the goal of benchmarking, continuous assessment to identify areas of improvement to inform targeted resource allocation and actions is critical to advancing regulatory capacity building.
1、 背景
近年来,我国药品监管改革持续推进,坚持改革创新和科学发展,推动出台及修订多部药品监管法规。《中华人民共和国国民经济和社会发展第十四个五年规划和2035 年远景目标纲要》[1]和《“十四五”国家药品安全及促进高质量发展规划》[2] 均明确提及促进药品高质量发展,推进药品监管体系和监管能力现代化,表明党中央、国务院高度重视药品监管工作和监管能力建设。2021 年2 月,习近平总书记主持召开中央全面深化改革委员会第十八次会议,会议审议通过了《关于全面加强药品监管能力建设的实施意见》(以下简称《实施意见》)[3]。《实施意见》是首个专门针对药品监管能力建设的文件,强调了6 个方面工作和18 项重点任务,旨在破解药品监管体系和监管能力存在的瓶颈制约问题,促进药品监管事业对标国际通行规则,进一步提升药品监管工作科学化、法治化、国际化、现代化水平。
自《实施意见》发布以来,我国药品监管部门持续加强药品监管体系和监管能力建设,但与发达国家相比,我国药品监管水平和医药产业发展仍存在差距。基准评估(benchmarking) 是持续提升监管能力的一种有效方法,已广泛应用于药品监管机构的能力建设与评估中。随着全球药品监管趋同的快速发展,基准评估及相关工具已被国际上多个监管机构采用,对各国药品监管措施进行评估和优化。因此,本研究基于国际监管能力基准评估方法或工具,系统性地梳理推进药品监管能力的相关衡量指标,比较、分析相关的国际应用经验,以进一步提升我国药品监管能力建设现代化、国际化,持续推进药品监管创新。
2、监管能力基准评估
国家药品监管机构在医药体系中发挥着不可或缺的作用,旨在确保公平,获得质量、安全性、有效性和成本效益有保证的医药产品或医疗技术,保障科学合理并具有成本效益的使用[4]。运用基准评估,能够使相关组织/ 机构通过衡量和比较关键规范指标,了解在管理流程中需要改变什么、如何改变以及从哪些方面着手改进以提高绩效。
2.1 基准评估的起源和目的
基准评估的概念来源于企业管理行为中的“标杆管理”(又称“基准管理”)。事实上,“标杆管理”是一种通过不断将组织流程与公认标杆企业比较,利用标杆企业的最佳实践来改善自己公司绩效的方法[5-6]。1979 年,美国施乐公司最先提出了“标杆管理”的概念,即“参照行业内最强的竞争对手或行业领导者,不断地测试产品、服务和实践”[7]。从1983 年开始,该方法被广泛应用在多个方面,如工程制造质量改进、员工培训效率提升、计算机性能评估等方面,甚至在亚洲进行企业绩效比较[8-11]。在“标杆管理”概念的基础和实践运用上,给予“基准评估”更具有操作性的定义——“认定和实施最佳实践”,即通过学习其他机构的“最佳实践”来改进实践、服务或产品[12]。
自1987 年以来,基准评估一直是马尔科姆· 波多里奇国家质量奖(Malcolm Baldrige National Quality Award) 标准的主要组成部分,在总共1000个马尔科姆·波多里奇国家质量奖评价要素中,“标杆管理”的概念一直影响着500 多个核心要素[13]。此外,在对管理工具和趋势多年的调查中,基准评估一直保持在前十位,在最受关注的20个管理工具中排名第四[14]。除此之外,基准评估在六西格玛过程、准时制系统、ISO9000 认证和供应链管理中得到了广泛应用[15-18]。过去40 余年,基准评估已经应用于企业、政府、医院和教育等各个领域[7]。
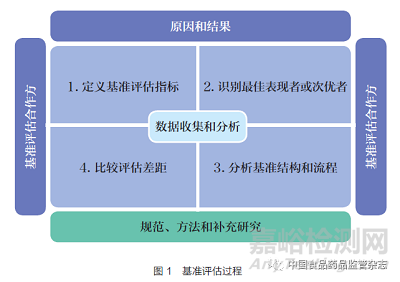
基准评估的目的是建立更可靠的目标和追求持续的改进,尤其是发现和理解实现新目标所需方法的过程,如图1 所示[19]。基准评估是全面质量管理和持续质量改进的基础之一,在外部导向的基础上,基准评估建立了相应的目标和方向,即评价内部过去做法和预测未来趋势。由于外部环境的变化速度远远快于预期,既定的目标往往会失败或难以达成。因此,基准评估强调应持续关注外部环境,以更好地满足不断变化的需求。总体来看,基准评估非常有助于一个组织进行行为改变,且可以衡量这些改变的有益影响,因而被广泛用作解决问题、改进质量和优化团队管理等场景。
2.2 药品监管能力基准评估
基准评估被越来越多的国家药品监管机构所采用,以强化药品监管和实现全民健康[20]。借鉴基准评估方法和公共部门基准评估的经验[21-23],药品监管能力基准评估的做法很复杂。药品监管机构无论是作为降低与药品相关的公共风险的守护者,还是促进药品创新和发展的推动者,监管者为了取得有意义的基准评估结果,必须对药品监管机构的目标终点做出切实可行的决策。
基准评估在药品监管领域中的应用主要分为两种途径:一种是从应用于评估药品监管的某一个环节或某一个技术要点开始,以达到全行业统一的监管要求和技术标准;另一种是应用于整体药品监管框架的评估,以提升监管部门整体监管质量,进而实现全球监管趋同。创新和技术进步以及重大公共卫生事件等因素带来了诸多挑战,进一步提高了对监管实践的要求。通过将绩效能力与衡量指标进行比较,国家监管机构可以确定监管行动的绩效、弱点和优势,以及如何确定行动的优先顺序,以根据当地实际情况不断提高药品的高质量使用[24]。
3、药品监管能力基准评估工具及其评估指标
世界卫生组织(World Health Organization,WHO)、欧洲药品监管机构负责人组织( Heads of Medicines Agencies,HMA)、经济合作与发展组织(Organisation for Economic Cooperation and Development,OECD)、国际监管科学创新研究中心(Center for Innovation in Regulatory Science,CIRS) 和美国政府问责办公室(Government Accountability Office, GAO)均正式发布了全面或专项的监管能力衡量工具。本研究将上述组织/ 机构纳入涵盖范围,并对相关政府文件和文献进行系统性的分析和审查,以获取相关基准评估工具、衡量指标和评估方法。监管能力衡量工具均从对应管理机构的官方网站上找到公开信息:WHO( https://www.who.int/),OECD (https: //www.oecd.org/),HMA(https://www.hma.eu/),CIRS(https://www.cirsci.org/),GAO (https://www.gao.gov/)。
3.1 WHO 发布的全球基准评估工具
WHO 从1997 年开始关注医药产品监管体系的评估,采用了一套评估疫苗监管计划的指标对监管体系进行审查。随后,对监管体系的评价指标系统不断地演进和优化,并引入了多种工具,在150 多个国家或地区的监管体系进行了基准评估和应用。按照世界卫生大会67.20 号决议(WHA67.20)的要求,WHO 出台了一系列加强监管体系结构化的循证方法,为医药产品监管体系的基准化、制定监管机构发展计划的决策或规划提供了明确的指南。
2013 年,WHO 开始制定统一的全球基准评估工具(Global Benchmarking Tool,GBT),旨在评估国家整体监管体系和相关组成部门的监管职能,以确定监管体系的成熟度。2015 年1 月与12 月,WHO 召开两次国际会议,共同磋商GBT 制定的方法与基本原则。经过多次修订与完善,GBT 已覆盖了药品、疫苗、血液制品和医疗器械的基准评估。如今,GBT 已成为WHO 评估医药产品监管体系的重要工具,可以实现对国家、省、州或联邦层级的监管机构进行评估。
GBT 有效帮助监管机构确定优势领域和需要改进的领域, 并利用已有优势制定适宜的机构发展计划(Institutional Development Plan,IDP),同时明确IDP 的资源规划、投资顺序, 并监控IDP 实施进度。GBT 中评估指标主要分为4 个层次,即国家监管体系和监管职能板块、相关指标、子指标、概况介绍。
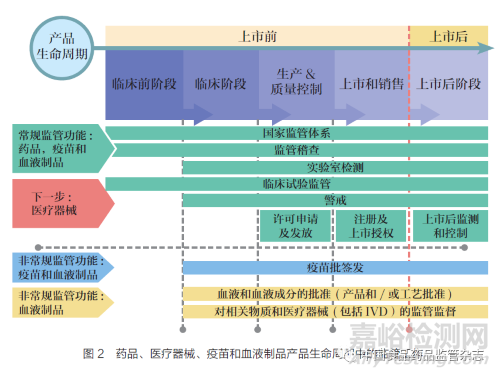
除国家监管体系(National Regulatory System,RS)板块外,GBT 还包括以下监管职能板块:注册和上市许可(Registration and Marketing Authorization,MA)、药物警戒(Vigilance,VL)、市场监管(Market Surveillance and Control,MC)、机构许可(Licensing Establishments,LI)、监督检查(Regulatory Inspection,RI)、实验室检测(Laboratory Testing,LT)、临床试验监管(Clinical Trials Oversight,CT)、批签发(NRA Lot Release,LR)。这些板块涵盖了药品全生命周期管理, 如图2 所示。此外,GBT的评价指标主要有九大类别,其涵盖内容如表1 所示。根据GBT 的评价要求, 且对应于ISO 9004:2018,按成熟度(maturity level,ML) 将国家监管体系划分为4 个等级, 分别是:ML1 仅存在某些监管要素的国家监管体系;ML2 部分实现基本监管职能的国家监管体系;ML3 稳定、运作良好、完整的国家监管体系;ML4 以先进水平运行和持续改进的国家监管体系。
3.2 HMA 建立的基准评估程序
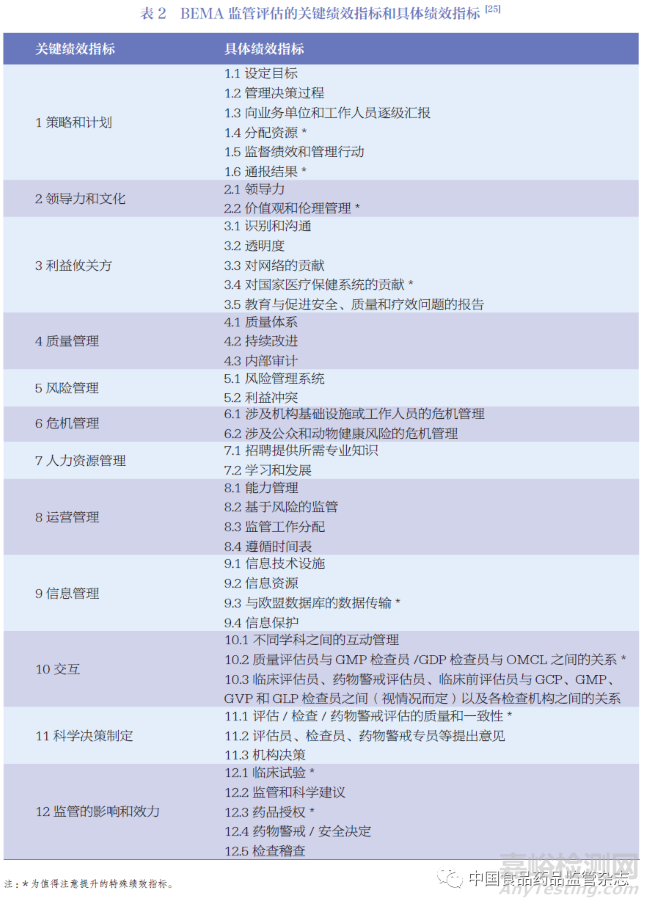
HMA 在人用和兽用药物机构建立了一个基准评估程序,即欧洲药品管理局基准评估(Benchmarking of European Medicines Agency,BEMA)。BEMA 目标旨在推动按照最佳实践标准运作的全球药品监管体系的发展做出贡献。BEMA 基于各个监管机构的体系和流程的评估,已在监管体系、上市许可申请评估、药物警戒和检查稽查领域达成一致,并形成一组成熟的指标。BEMA 制定监管评估指标拥有一套严格的流程,以保证指标的科学性和有效性如图3 所示。在最终报告中,BEMA 报告了其关键绩效指标(key performance indicator,KPI)和值得提升的特殊绩效指标,如表2 所示。
BEMA 评估监管的方法包括自我评估和同行评审评估,并广泛基于ISO 9004 指南。自我评估使机构能够评估自身在绩效指标所针对的领域方面的优势和劣势。同行评审评估允许受过专门培训的评估团队访问每个机构(如从其他机构的志愿者中抽取相关评估人员),以根据绩效指标进行独立评估。评估小组将征得被访问机构同意,把每次访问结果制作成匿名报告。所有结果均存储于中央数据库,并汇总成一份报告供各机构使用,确定最佳实践。
BEMA 是在整个欧洲范围内分享监管机构评价工作中的最佳实践工具,帮助能力欠佳的药品监管机构找到最为适用的方式来优化其监管职能。在欧盟,应用该工具的主要目标是创造一个高质量的监管环境,使欧盟成员国的监管机构都能接受和认可其他成员国的监管工作,以节省资源,并最终为在欧洲建立一个融合的药品市场创造先决条件,从而在欧盟范围内营造出充分保护公众健康的药品监管环境。
3.3 OECD 建立的衡量监管绩效计划
OECD 是一个致力于制定更好的全球化政策以改善公众生活的国际组织[26]。OECD 建立了衡量监管绩效计划,旨在通过两种方式帮助OECD 成员国提高监管质量,一种是改进评估监管绩效的政策、计划和工具,另一种是展示监管治理的改进,以保障企业和公民的利益。
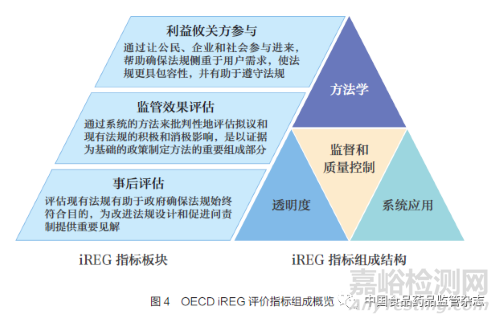
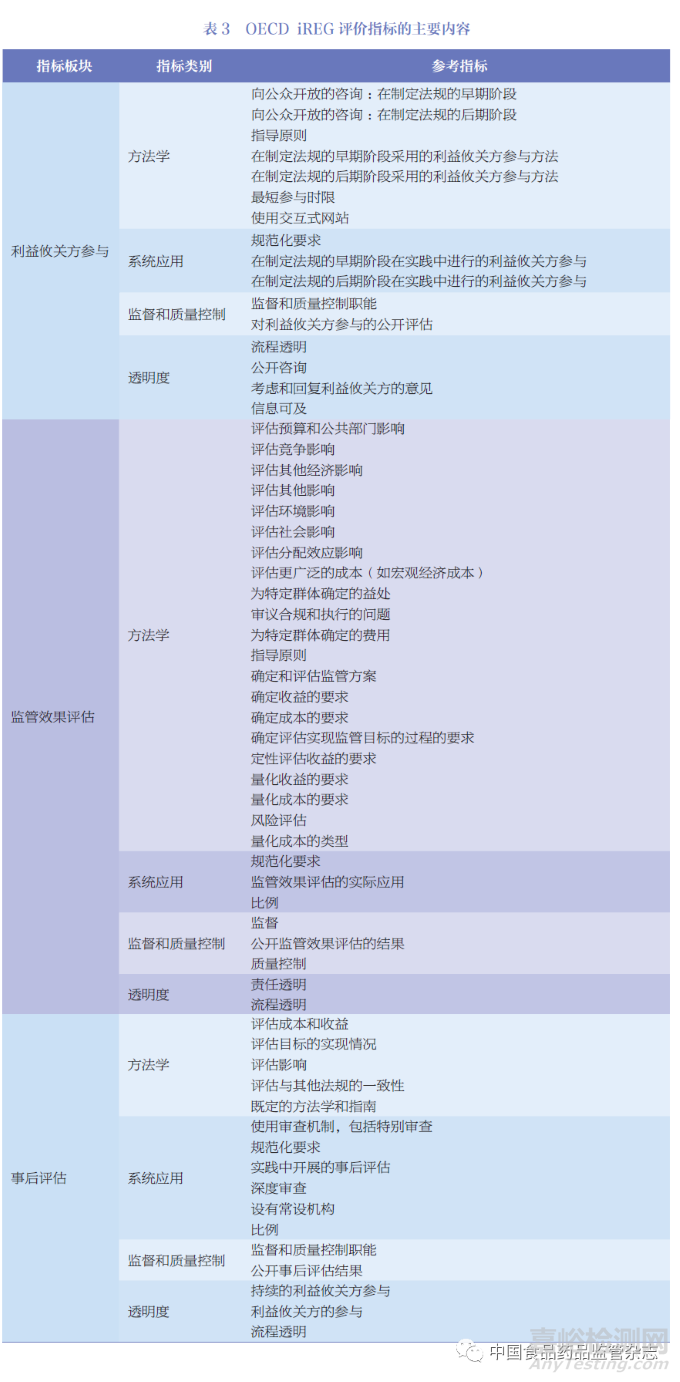
衡量监管绩效主要依赖于OECD 发布的监管政策和治理指标(Indicators of Regulatory Policy and Governance ,iREG),通过关键指标的评估得出监管治理的建议, 为OECD成员国监管政策和治理实践提供最新证据。此外,OECD 基于iREG 定期发布监管政策展望系列白皮书,以介绍成员国提高监管治理的努力并分享良好的监管实践。iREG 包括3 个综合板块,为利益攸关方参与(Stakeholder Engagement,SE)、监管效果评估(Regulatory Impact Analysis,RIA) 和事后评估(Ex-post Evaluation,ePE)。每个综合板块由4 个同等加权的类别组成,如图4 所示:①系统应用(systematic adoption),记录正规要求以及这些要求在实践中执行的频率;② 方法学(methodology), 收集每个领域所用方法的信息的方法, 如评估的影响类型或使用不同形式协商的频率;③ 监督和质量控制(oversight and qualitycontrol), 记录监管机构的作用和公开的评价;④ 透明度(transparency),记录与政府信息公开有关的问题等。OECD 报告罗列了iREG 的主要评价指标,如表3 所示。
3.4 CIRS 启动监管机构效率优化项目
科睿唯安旗下的CIRS 是一家独立运营的中立国际会员组织。CIRS 为各利益攸关方提供了一个沟通对话的平台,通过监管科学的创新应用来讨论和制定监管政策,并通过这些活动提高医药产品的可及性,其已成为监管绩效分析和政策改革的中心之一。
科学的监管系统是确保监管机构为其利益攸关方提供高效服务的关键。在过去的20 年里,CIRS 通过收集绩效指标并将质量纳入审查流程,在药品审查领域发挥了积极作用。基于对ICH成员和观察员的多家监管机构早期基准研究的成功经验,2013年CIRS 与来自亚洲、拉丁美洲、非洲和中东的机构启动了一项独特的指标收集计划,称为监管机构效率优化项目(optimising efficiencies in regulator yagencies,OpERA), 后来在比尔及梅琳达· 盖茨基金会(Bill and Melinda Gates Foundation,BMGF)的资助下扩展了规模。
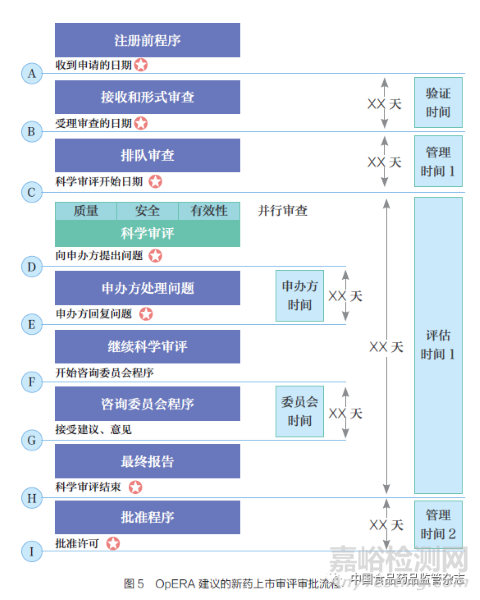
OpERA 目标在于推动评估和批准时间的监管流程、鼓励对药品批准过程开展系统的重新评估、为上市许可审查中使用的不同流程提供比较基础、提供简化流程来采集注册审评和评估流程的基准数据、鼓励开发系统的自我监控和持续改进的方法、帮助监管机构整合适合其授权范围内的最佳实践,以及确保相关产品的安全性、有效性和质量等。自2013 年OpERA 启动以来,已有30 多个国家和多个区域计划参与其中。该项目成功地在参与机构中建立了衡量和改进的基础, 帮助参与机构定义审查绩效目标、优化审评流程。OpERA 对于审评审批流程中的关键绩效指标及流程如表4 和图5 所示。
3.5 GAO 发布对FDA科学诚信程序和培训及医疗人力资源规划评估的关键要素
GAO 是美国国会的下属机构,负责调查、监督联邦政府的规划和支出。GAO 对美国食品药品监督管理局(Food and Drug Administration,FDA) 监管过程中遇到的问题或冲突进行对应的评估,并给出相应的改进建议。FDA 则基于相关建议进行改善,并在GAO 的网站上公布及更新工作进度。在GAO 官网检索对FDA 的主要评估报告后,可以发现GAO 对FDA 的评估几乎涵盖了药品全生命周期,包括药品上市后安全、应对全球化、药物滥用和药品短缺防范等。GAO 发布的FDA 科学诚信程序和培训及医疗人力资源规划的评估中包含了具体的基准评估指标,表5 对评估指标进行了具体地描述。
3.6 基准评估工具综合对比
本研究选取了5 个监管能力基准评估工具及其评估指标进行横向对比。从发布组织/ 机构来看,涵盖了国际组织、第三方专业组织和独立政府部门。除评估国家监管体系外,BEMA 和GAO 发布的评估工具亦可用于对具体机构中监管体系和监管流程的评估。尽管不同的基准评估工具的目的不同,但都致力于促进科学决策和推进监管治理实践。此外,每个评估工具都由不同的衡量指标构成,并辅以独立的衡量方法进行量化评估。具体比较内容如表6 所示。
4、 药品监管能力基准评估工具应用现状
药品监管能力基准评估工具已经在全球范围内进行了不同程度的应用。本研究根据基准评估的4 个发展过程(即内部基准、外部基准、职能基准和流程基准),对基准评估工具应用现状进行梳理,从文献、政府报告、评价组织报告等资源搜集与药品监管能力基准评估工具有关的资料,以分析目前全世界范围内药品监管部门对上述工具的应用现状。
4.1 内部基准
内部基准评估指基于基准评估工具,对国家或地区现阶段药品监管能力建设现状进行评估。内部评估可以是由监管机构自己发起的,也可以是由国际组织或第三方评估机构发起的。
截至2019 年12 月底, 已有26 个国家利用WHO 的GBT进行了正式的内部基准评估,另有54 个国家在WHO 的协助下使用GBT 进行了内部评估[29]。此外, 马来西亚国家药品管理局(National Pharmaceutical Regulatory Agency,NPRA)通过CIRS 发布的OpERA 确定了NPRA 审评审批流程中的时间花费[30],并为其提供了衡量绩效改进的基线时间。参与OpERA不仅帮助NPRA 了解其监管绩效,而且还发现了NPRA 需要努力解决的弱点和能力不足的领域。例如,NPRA 基于科学的目标路径开始审评,并将申请人的响应时间限制为6 个月。
4.2 外部基准
外部基准评估是指将国家药品监管能力建设现状与其他国家进行比较,以了解其与良好监管实践国家的差距。此处主要通过WHO 和OECD 两个国际组织对诸多国家的监管能力评估,以明晰监管能力基准评估工具外部基准的应用现状。
根据WHO 监管体系数据库显示,在其194 个成员国中,只有50 个国家拥有被认为成熟的监管机构( 成熟度ML4 或ML3),而其他144 个国家的监管体系仍不完善[31]。其中,99 个国家处于ML1 成熟度,45 个国家处于ML2 成熟度。2022 年3月,新加坡卫生科学局(Health Sciences Authority,HSA) 成为全球首个取得WHO 最高评级的国家监管机构[32]。WHO 于2021 年10 月25 日至11 月5日派4 名官员及15 名国际评估员,使用GBT 对HSA 进行评估并认定为成熟度ML4。ML4 意味着HSA 必须公布评估报告,详细说明注册药物和疫苗的安全性、有效性和质量,以及利益风险分析,这也进一步提高HSA 监管决策的透明度,也能协助其他国际医药监管机构使用新加坡的报告来审查相关产品。HSA 的创新监测系统也在本次评估中取得了良好的评价,这套创新系统利用全国电子医疗健康记录以及本地医疗专业人员网络,对与药物和疫苗相关的不良反应进行监测,并通过数据分析让监管机构能够迅速采取行动,保护公众健康和安全。2022 年11 月,WHO 宣布韩国食品药品安全部(Ministry of Food and Drug Safety,MFDS) 已达到ML4, 标志着MFDS 正在以先进的绩效水平运作,并不断改进监管质量[33]。
截至2021 年1 月,OECD已经收集到39 个国家和地区的数据。《OECD 监管政策展望2021》( OECD Regulatory Policy Outlook 2021)中提及在成员国评估报告中,iREG 指标得分近年来有所提升但进展缓慢,事后评估和利益攸关方参与的审查结果仍有待改进,监管重点依旧在于对监管效果评估的质量审查[34]。虽然对监管的事后评估的总体进展缓慢,但一些OECD 成员国仍提供了可以借鉴的经验。例如,德国在2019 年采用了一种更加全面和系统的方法,要求对所有内部事后评估和所有年度合规成本的立法提案进行独立质量保证。尽管监管效果评估是多数国家进行监管的基石,但是监管效果评估绩效衡量仍不完全透明和系统化, 大约1/3 成员国的司法机构尚未发布有关监管效果评估体系的报告, 同时通过绩效指标和调查意见来监测监管效果评估系统的作用也仍需完善。
4.3 职能基准
职能基准评估是指将与本行业外具有相同职能的监管机构的职能板块进行评估对比, 涵盖药品全生命周期, 包括注册和上市许可、药物警戒、市场监管等。我国也利用WHO 的GBT 对疫苗监管进行了基准评估。2022 年8 月23 日, 我国正式通过WHO 疫苗国家监管体系评估且达到三级成熟度(ML3)[35]。这表示我国企业生产的疫苗产品具备申请WHO 产品预认证(Prequalification,PQ)的资质,预认证通过后,产品可进入联合国等国际组织采购清单,也表明我国疫苗监管能力和水平稳定和持续进步[36]。WLA 框架的实施促进监管机构依赖国际可信任的产品和决策优化使用有限资源,同时促进全球或区域性监管趋同、监管方法协调和国际合作,进一步改进良好监管实践[37]。
4.4 流程基准
流程基准评估是指将监管机构评估流程与其他拥有创新、示范工作流程的机构进行对比。药品监管能力基准评估中的流程基准多体现在对药品审评审批流程的基准中,CIRS 与沙特阿拉伯食品药品监督管理局(Saudi Food and Drug Authority,SFDA)合作,对其审查流程和实践进行表征,并与加拿大、新加坡和澳大利亚的监管体系进行比较[38]。该研究不仅确定了 SFDA 的关键里程碑和时间表,还强调了改进的机会,包括探索新加坡所使用的依赖模型,以及发布透明地传达机构决策理由的批准摘要。此后,SFDA 根据该研究的建议,在其审查过程中实施了风险分层模型。除此之外,CIRS 组织的年度OpERA 论坛为国家监管机构提供了聚在一起共同分享经验的重要机会。该论坛可帮助与会者确定提高组织效率的新方法,了解建立最佳监管评估实践的工具和流程。
5、 药品监管能力建设基准评估综合框架
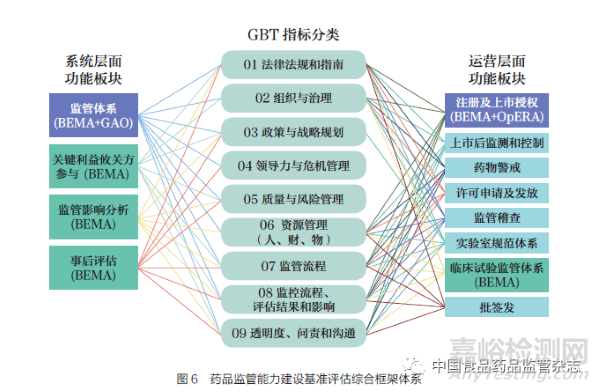
由于各国药品监管体系评估要素和选择的基准评估工具各不相同,根据同一衡量工具中预定的衡量指标收集数据以及进一步分析比较的过程, 增加了不同测量国家监管能力的基准复杂性。本研究结合WHO 的GBT、HMA 的BEM A、OECD 的iREG 构建了药品监管能力综合评估基础体系。为了更完整地体现监管能力建设,本研究还结合第三方独立评估机构所提及的药品监管能力建设评估相关指标,即CIRS-OpERA 对审评审批的评估指标和GAO 对FDA 科学诚信程序和培训及医疗人力资源规划的评估指标。最终,形成了适用于国际药品监管能力建设评价的综合框架及指标体系,所有指标分类后的汇总结果如表7所示。
综合框架包含了GBT 和iREG 的所有指标。GBT 使用9个指标类别,概述了268 个子指标,以衡量整个国家监管体系框架和监管职能的能力。iREG 的3 个核心板块涵盖了61 个子指标。BEMA 的关键绩效指标和特殊绩效指标没有单独列出,因为它们都涵盖在GBT 和iREG 的指标中。OpERA 中关于药品审评审批监管过程的5 个关键指标与GBT MA 06(监测监管绩效和产出的机制)重复,而包含在科学诚信程序和培训及医疗人力资源规划中的指标被纳入GBTRS 06(执行监管活动的人力资源)和RS 10(监测监管绩效和产出的机制)。根据整合所有评估工具中衡量指标的对应关系,每个核心功能中子指标的对应关系如图6 所示。可以看到,iREG的3 个核心板块被评估为全面覆盖了GBT 的9 个指标类别。
6、 结语
基准评估已在国际上被广泛应用于监管机构的能力评估,尤其是在药品监管领域。持续改进绩效、不断优化决策是基准评估的根本目的[39],其有助于药品监管机构进行内部自评以发现自身问题,有助于通过外部对比来找到与其他监管部门的差距,有助于通过设定职能基准来明确需要重点关注的监管内容,也可以通过设定通用流程基准来完善监管流程。基准评估在药品监管领域的应用趋于国际化,促进了全球药品监管水平的提升,使得“制药大国”“制药强国”的先进经验可以系统地分享给监管能力建设较为滞后的国家。一方面提升了监管绩效优秀的国家和地区的国际影响力,助力医药产业发展;另一方面也促进了国际监管协同,保障患者可以及时获得有质量保障的药品[40]。
已有的基准工具被广泛应用于不同场景和需求下的药品监管能力建设,覆盖全球范围。各个评估工具的内容侧重有所不同,如WHO 近年来对中低收入或发展中国家的监管能力建设有较多评估,CIRS 则是更偏向于总结发达国家监管经验来优化成员国的审评审批,iRGE 则是强调从事前事后的模式下评估监管对社会整体的影响。除此之外,HMA的BEMA 更注重分析当下的优势与劣势,从而进一步提高监管能力;GAO 则是主要通过对具体项目实施过程中的问题提出建议,来优化监管部门的决策制定过程。由于基准评估工具的侧重点不同,导致了相关工具的局限性。因此监管机构需要根据自身诉求选择适用工具及相关指标,即选择适当的基准作为参考,以提升自身药品监管能力。本研究提出了融合国际经验的综合基准评估工具,有助于借鉴国际经验推进制定更具国际视野的监管实践战略,同时进一步促进跨国药品监管协调、依赖和认可的监管实践标准,以及在国家层面弹性应对药品全球化趋势所带来的挑战[41-42]。
基准评估并非短暂、阶段性的评估计划,而是通过持续建立更可靠、更科学的监管目标,对标先进实践,以达到长期的、可持续的质量改进的目的,形成成熟的质量管理体系。
根据我国目前的监管能力现状分析来看,需要加强基础能力、技术监督、行政监管、信息化水平等方面的工作[43-44]。因此,可以参考本研究提出的基准评估综合框架,以法律法规、监管流程、人力资源管理、财政资源管理、信息沟通为一级监管基础构建指标;辅以上市注册监管、上市后市场监管、药物警戒、临床试验、疫苗批签发等业务实操指标;并增加事前、事后评估的利益攸关方参与、政策影响、事后评估指标。以基础、实操和评价三位一体的指标体系,全方位评估我国药品监管能力建设,助力药品监管国际化、现代化、科学化。