今日头条
新冠不再构成国际突发公共卫生事件。世卫组织总干事谭德塞5日宣布,新冠疫情不再构成“国际关注的突发公共卫生事件”。他同时强调,这不意味着新冠疫情不再是全球健康威胁,出现新变种的风险仍然存在。自世卫组织2020年1月30日宣布新冠疫情构成“国际关注的突发公共卫生事件”以来,全球向世卫组织报告了近700万例死亡病例,而实际死亡人数可能达2000万。谭德塞表示,新冠疫情不仅仅是一场健康危机,它造成了严重的经济危机与社会动荡,暴露了世界的严重不平等。
国内药讯
1.信达PD-1单抗肺癌Ⅲ期临床见刊《柳叶刀》子刊。信达生物PD-1抑制剂信迪利单抗联合或不联合贝伐珠单抗以及化疗用于EGFR-TKI治疗失败的EGFR突变非鳞状非小细胞肺癌的Ⅲ期临床(ORIENT-31)研究积极结果在线发表在《柳叶刀·呼吸病学》。与化疗相比,信迪利单抗+贝伐珠单抗+化疗方案以及信迪利单抗+化疗方案均显著延长患者PFS,三组患者中位PFS分别为7.2个月(HR=0.51)、5.5个月(HR=0.72)和4.3个月;三联方案显著提高患者总生存期(21.1个月vs19.2个月,HR=0.98)。研究中无新的安全性信号出现。
2.豪森GLP-1/GIP双受体激动剂上II期临床。豪森药业GLP-1/GIP双受体激动剂HS-20094注射液登记启动一项IIa期临床,拟评估多次皮下注射给药在伴或不伴超重肥胖的2型糖尿病(T2DM)受试者中的安全性、耐受性、药代动力学和药效学。该项试验的主要研究者由北京大学第一医院医学博士张俊清和临床药理学博士崔一民共同担任。全球目前同类药物仅有礼来的Tirzepatide(替尔泊肽)获FDA批准治疗2型糖尿病。
3.复宏汉霖LAG-3抗体获批肺癌II期临床。复宏汉霖自主研发、靶向淋巴细胞活化基因3(LAG-3)的创新抗体药物HLX26获国家药监局批准开展II期临床,与PD-1抑制剂斯鲁利单抗和化疗联用,评估用于一线治疗晚期非小细胞肺癌(NSCLC)的安全性和有效性。临床前研究结果显示,HLX26与斯鲁利单抗联合用药恢复T细胞杀伤功能具有协同效应,显示出较为显著的抗肿瘤活性。
4.恒瑞GLP-1/GIP双受体激动剂获批减肥临床。恒瑞医药1类化药HRS9531注射液获国家药监局临床默示许可,拟开发用于减重适应症。HRS9531是一款靶向GLP-1和GIP的双受体激动剂,目前正在多项临床研究中评估治疗2型糖尿病的有效性与安全性。除HRS9531外,该公司还有长效胰岛素+GLP-1类似物HR17031、GLP-1R激动剂诺利糖肽、口服GLP-1药物HRS-7535片和GCGR抗体/GLP-1融合蛋白SHR-1816也已进入临床阶段。
5.本导CRISPR抗病毒基因编辑疗法国内获批临床。上海本导基因公司1类生物制品BD111眼用注射液获国家药监局临床许可,即将在复旦大学附属眼耳鼻喉科医院、华山医院和温州眼科中心开展接受标准治疗后复发的Ⅰ型单纯疱疹病毒性基质型角膜炎的注册临床研究。BD111是全球首个进入临床的CRISPR抗病毒基因编辑药物,已在治疗疱疹病毒型角膜炎的临床试验中获得积极结果,并获得FDA授予孤儿药资格。
6.君实PD-1单抗出海南美、印度与南非。君实生物宣布与瑞迪博士实验室签署合作许可协议,授权后者在巴西、墨西哥、哥伦比亚、阿根廷、秘鲁、智利、巴拿马、乌拉圭、印度及南非开发及商业化特瑞普利单抗注射液(TAB001/JS001)。根据协议,君实生物将获得700万美元的首付款,以及用于潜在扩大许可区域的300万美元的款项,可能多达7.183亿美元的里程碑后期付款,以及产品的销售分成。
7.泽布替尼2023Q1全球销售超14亿元。5月4日,百济神州发布2023年第一季度业绩,总营收30.66亿元,同比增长57.4%;产品销售收入28.08亿元,同比增长69%;研发费用为28.26亿元,同比增长4.8%。其中,核心产品BTK抑制剂百悦泽®(泽布替尼)Q1全球销售额为14.47亿元,去年同期为6.63亿元,同比增长超过一倍。
国际药讯
1.法布里病新药获欧盟批准上市。Chiesi Global Rare Diseases与Protalix公司联合开发的创新聚乙二醇化α-半乳糖苷酶A疗法pegunigalsidase alfa(PRX–102)获欧盟委员会(EC)批准上市,用于治疗法布里病成人患者。在关键性Ⅲ期临床中,与酶替代疗法活性对照组相比,PRX–102治疗组患者24个月时肾功能改善达到非劣效性标准。在美国,该新药正接受FDA监管审查。
2.吉利德丁肝新药获欧盟推荐批准上市。欧洲药品管理局(EMA)人用药品委员会(CHMP)建议授予吉利德首创抗病毒药物Hepcludex(bulevirtide)全面上市许可,用于治疗成人慢性丁型肝炎病毒(HDV)和代偿性肝病。在Ⅲ期MYR301试验中,与没有接受抗病毒治疗的受试者相比,bulevirtide(2mg或10mg)单药组达到病毒学和生化联合反应的患者比例显著更高(45%和48%,vs2%)。2020年7月,该新药已获得EMA有条件上市许可。
3.FRα靶向ADC卵巢癌Ⅲ期临床积极。ImmunoGen公司靶向FRα的抗体偶联药物Elahere(mirvetuximab soravtansine)联合化疗治疗叶酸受体α(FRα)阳性铂类耐药卵巢癌的Ⅲ期临床MIRASOL结果积极。与化疗相比,Elahere联合治疗显著提高患者总生存期OS;两组患者中位OS分别为16.46个月和12.75个月(HR=0.67,p=0.0046);Elahere较化疗降低33%的死亡风险。该公司计划向FDA递交sBLA,将Elahere的加速批准转换为完全批准。
4.FGE-19类似物治疗NASH的IIb期临床积极。NGM公司成纤维细胞生长因子-19(FGF-19)类似物aldafermin治疗非酒精性脂肪性肝炎(NASH)的IIb期ALPINE 4研究达到主要终点。与安慰剂组相比,aldafermin(3mg)治疗组患者的ELF评分降低0.5分(P=0.0003),具统计学意义。Aldafermin(1mg和3mg)队列中分别有21%(p=0.39)和23%(p=0.36)的患者实现纤维化改善,而安慰剂组这一数值为15%,aldafermin没有达成统计学意义改善。Aldafermin的安全性与之前研究一致。
5.光遗传学AAV基因疗法眼科Ⅱ期临床积极。Nanoscope公司在ARVO年会上公布其光遗传学基因疗法MCO-010治疗晚期色素性视网膜炎(RP)的Ⅱb期临床(RESTORE)积极数据。MCO-010旨在利用AAV2载体将光敏多特征蛋白(MCO)基因递送到视网膜细胞中以恢复其检测光线的能力,达到恢复视力目的。单次玻璃体注射给药12个月时,MCO-010治疗组100%患者(安慰剂:55.6%,p=0.007)达到MLYMT、MLSDT或BCVA视力改善;有94.4%患者(vs44.4%,p=0.008)达到MLYMT或BCVA视力改善。MCO-010总体耐受性良好。
6.罗沙司他治疗MDS的III期临床失败。FibroGen公司口服HIF-PH抑制剂roxadustat(罗沙司他)治疗输血依赖性低风险骨髓增生异常综合征(MDS)患者贫血的III期MATTERHORN研究未达到主要疗效终点。与安慰剂相比,罗沙司他未能显著提高前28周治疗期间连续≥56天无需输血受试者比例(47.5%vs33.3%,p=0.217);罗沙司他不良事件发生率与先前研究结果一致。2021年,FDA曾拒接批准罗沙司他治疗CKD相关性贫血。
7.诺和诺德血友病新药收到FDA完整回复函。诺和诺德靶向组织因子途径抑制物(TFPI)的IgG4单抗concizumab的生物制品许可申请(BLA)收到FDA完整回复函(CRL),拟用于预防治疗伴抑制物的A型和B型血友病。FDA要求其提供额外的与患者相关的监测和给药信息,以确保concizumab按预定方案给药;以及额外的concizumab生产过程材料文件。在III期Explorer7研究中,concizumab预防治疗减少了86%(平均ABR1.7vs11.8)的治疗自发性和创伤性出血事件。
医药热点
1.河北绘出中医药强省“数据图”。河北省卫健委日前印发《健康河北建设行动方案(2023—2027年)》,着力实施中医药强省建设等10个专项行动。在中医药强省建设专项行动中,河北省提出,到2027年,实现每个市都有三甲公立中医院,县级中医院实现全覆盖,国医堂乡镇社区全覆盖、中医药人员全配备;引进培育300名高级人才,培养2000名骨干人才、2万名“能西会中”的中西医复合型人才;建设50个省级中医药重点学科、20个中医药科技创新平台。
2.上海同济医院打造集成化创伤救治中心。近日,同济大学附属同济医院打造的上海市首个集成化创伤中心正式运行。患者来了,通过‘绿色通道’直接到创伤中心进行抢救,后续的清创、留观等都可以在这个区域里实现无缝衔接。集成化创伤中心的启用,把以往救治时相对分散的空间紧密组合在一起,为创伤患者赢得了宝贵的救治时间,也提升了救治的效率。
评审动态
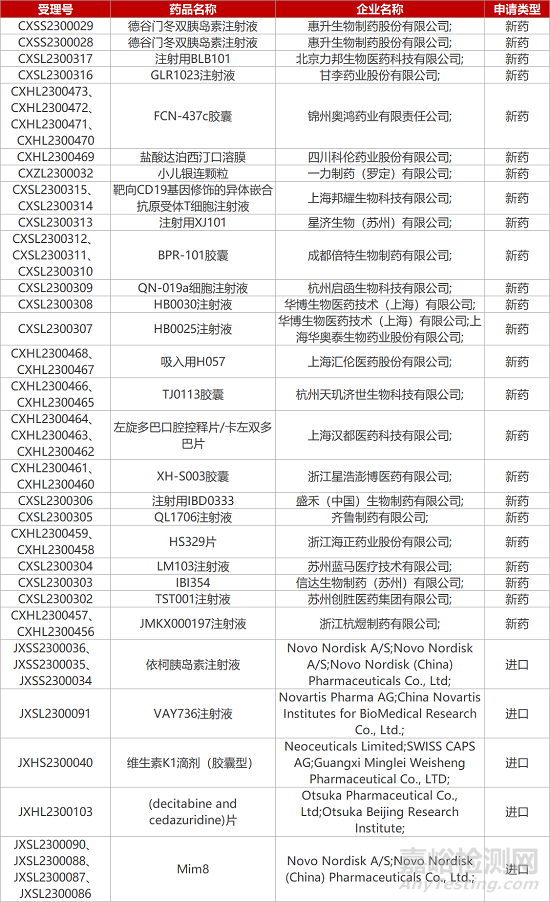
1. CDE新药受理情况(05月07日)
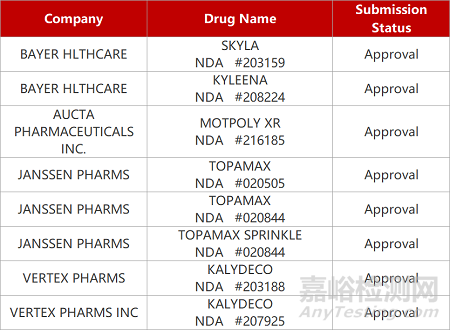
2. FDA新药获批情况(北美05月04日)