近期,密歇根大学Marco C. Bottino教授在科爱创办的期刊Bioactive Materials发表研究论文。该研究报道了具有组织特异性的三维熔体电书写支架,指导人牙周膜干细胞(hPDLSCs)的分化并介导巨噬细胞极化。在500 μm链间距支架上的hPDLSCs,在21天内表现出较高的成骨表达,而随机定向纤维支架上的细胞表现出M1标记的上调。在原位下颌开孔缺损模型中,研究结果显示,组织特异性支架)可以增强对天然牙周组织再生的模拟。
引言
牙周炎是一种非常普遍的慢性炎症,目前治疗牙周炎的方法包括彻底的龈下刮除、根面平整和翻瓣手术,并通过可降解膜引导组织再生。总的来说,尽管有证据表明,在上述治疗后可能会出现一定程度的牙周再生,但由于牙周缺损的多组织复杂性和三维性质,在临床中,模拟原生牙周组织的能力可能是不切实际的。
众所周知,牙周再生需要同时处理软(PDL)和硬组织界面。重要的是,获得定向良好的PDL纤维与牙槽骨再生是至关重要的。增材制造(AM)是一个快速发展的领域,已在再生口腔医学中得到应用。熔体电写入(MEW)是一种替代AM工艺,可以生产具有明确宏观和微观结构特征的纤维支架,如孔隙率(即链间距)、纤维排列和直径。尽管氟化磷酸钙(F/CaP)涂层的MEW聚合物纤维支架在支持PDL新生生物的同时能够实现大量的牙槽骨再生,但最近的文献表明,单相支架策略在骨-韧带界面重建PDL角结构的能力有限。这些结果进一步强调了个性化解决方案的需求,可以指导牙周附着装置的协调生长和发育。
近年来,支架介导的策略提供三维模板和仿生细胞外基质微环境,同时指导人体的免疫反应已被建议在组织工程应用。先天性免疫反应在生物材料植入后发挥重要作用,以减轻促炎反应,并允许巨噬细胞极化。促炎M1巨噬细胞转化为抗炎巨噬细胞(M2)表型对生物材料植入部位的整体炎症反应至关重要。
因此,对于目前使用的可溶性生物分子来说,生物材料介导支架即使不是一种可能的替代品,可以指导祖细胞的反应,以促进组织愈合并最终再生。在这项研究中,我们利用MEW在确定的纤维方向(随机定向或对齐支架)和链间距(即,纤维的交叉锯齿图案,链间距为500 μm和250 μm;下文简称为高度有序的脚手架)。体外研究了纤维取向和链间距对人源性牙周韧带干细胞(hPDLSCs)附着/增殖和分化的影响,以确定用于牙周重建的组织特异性支架中最有利的PDL特异性区域。总的来说,我们探索了一种多功能和创新的平台(即MEW),最终可能能够指导组织特异性(PDL的对齐纤维和牙槽骨高度有序的500 μm链间距氟化磷酸钙[F/CaP]涂层纤维)干细胞分化和巨噬细胞极化的带状智能生物材料支架的发展,作为有效牙周组织再生的潜在个性化治疗。
1. MEW PCL支架的制备与表征
MEW成功地用于制造具有不同设计的3D纤维支架,即高有序(即交叉0/ 90°,250 μm(小)和500 μm(大)的链间距,以及高定向(对齐)和无定向(随机)的纤维配置(图1))。获得的支架具有高多孔性和高选择性呈光滑纤维形态。在收集板上任意沉积PCL纤维,就会产生无定向的随机纤维支架。各种MEW PCL支架的代表性扫描电镜图像显示熔体电印迹聚合物(即聚ε-内酯)支架具有组织特异性属性,如纤维形态(随机vs对齐)和高度有序(0◦/90◦交叉图案)结构,具有明显的链间距(小250 μm和大500 μm)。总体而言,制备的支架的纤维直径(μm)分别为2.3±0.1、2.5±0.2、2.6±0.3和4.2±0.7,在排列、大、小股间距和随机沉积的纤维中,孔隙率分别为52.9%、91.7%、85.5和30.9%。

Fig. 1. Melt electrowriting (MEW) setup to fabricatefibrous scaffolds of distinct fiber configuration andhighly-ordered architectures. Representative SEMimages of the various MEW PCL scaffolds show meltelectrowritten polymeric (i.e., poly(ε-caprolactone)scaffolds with tissue-specific attributes such as fibermorphology (random vs. aligned) and highly-ordered(0◦/90◦ crosshatch pattern) architecture with distinctstrand spacings (small 250 μm and large 500 μm).Overall, the as-produced scaffolds display fiber diameters (in μm) ranging from 2.3 ± 0.1, 2.5 ± 0.2,2.6 ± 0.3 and 4.2 ± 0.7 and porosity of 52.9%,91.7%, 85.5 and 30.9% in aligned, large and smallstrand spacing to randomly-deposited fibers,respectively.
2. hDPLSCs细胞的排列和分化取决于纤维取向和支架结构
纤维组织在组织界面的特定排列在优化生物力学和生物物理反应方面具有重要作用。因此,本研究探索了一种组织特异性引导支架,通过在结构上和成分上量身定制的带状支架(即用于PDL区的高度定向(排列)的纤维和用于骨区的高度有序的(500μm链间距)、纳米结构的氟化帽涂层多孔性支架)的新制造来鼓励牙齿-韧带-骨界面的同时再生。
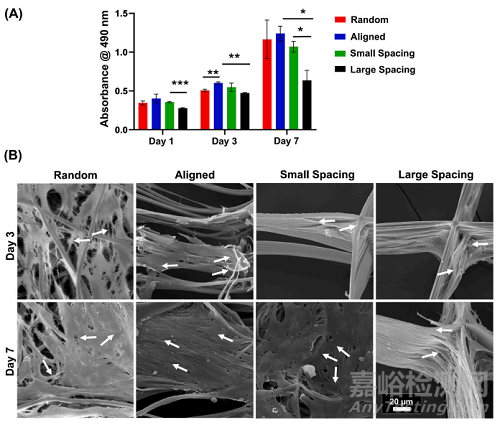
在我们的研究中,hPDLSCs在增殖和分化能力方面对不同的支架结构和纤维配置做出了反应(图2)。而种植在无取向(随机)和高度取向(取向)纤维上的hPDLSCs与具有可变股间距的MEW PCL支架相比显示出更高的增殖率(图2A),在整个体外培养期间,与大链间距相比,小链间距的增殖率明显更高(图2A),这是由于更高的表面积和更小的链间距(孔径),增强了初始细胞附着。
Fig. 2. Attachment and proliferation of hPDLSCs onMEW PCL scaffolds with aligned and randomly oriented fiber configurations, and 250 μm and 500 μmstrand spacings. (A) Cell viability of hPDLSCs seededon the scaffolds using AlamarBlue assay over 7 days.(B) Representative SEM images of hPDLSCs proliferation on the scaffolds after 3 and 7 days. Note thecharacteristic cell stretch along the fibrous walls (AllSEM images have the same scale bar). A more pronounced spreading was detected along the scaffoldswith randomly oriented fibers (white arrows indicatethe direction of filopodia protrusion). (Mean ± SD, n= 3). *p < 0.05, **p < 0.01, ***p < 0.001.
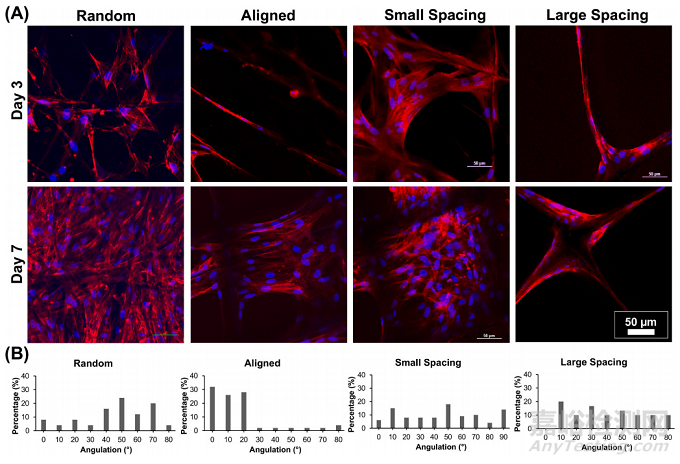
通过SEM(图2B)和荧光(phalloidin染色)成像(图3),可以明显地看到与各种MEW PCL支架诱导的接触引导相关的hPDLSCs形态的直接变化。具有平行沉积纤维的高定向(对齐)支架允许hPDLSCs平行于纤维的长轴方向对齐(图2B),而在随机和高度有序的支架(即小和大链间距)中,hPDLSCs表现出多边形形状,细胞骨架多方向延伸,取向混乱。因此,hPDLSCs在对齐的纤维上培养时采用了典型的纺锤形形态,这是以前在人类成纤维细胞中观察到的特征。
Fig. 3. Patterns of hPDLSCs alignment on the various MEW PCL scaffolds. (A) Representative CLSM images show a variable pattern of cells’ bridging, following thefibers’ arrangements at day 3 and 7. DAPI (blue) and phalloidin (red) fluorescent staining (scale bar = 50 μm). (B) Histograms of PDLSCs nucleus angulation onscaffolds with aligned and randomly oriented fiber configurations as well as crosshatch 0/90◦ arrangement and 250 μm and 500 μm strand spacings corresponding toconfocal images.
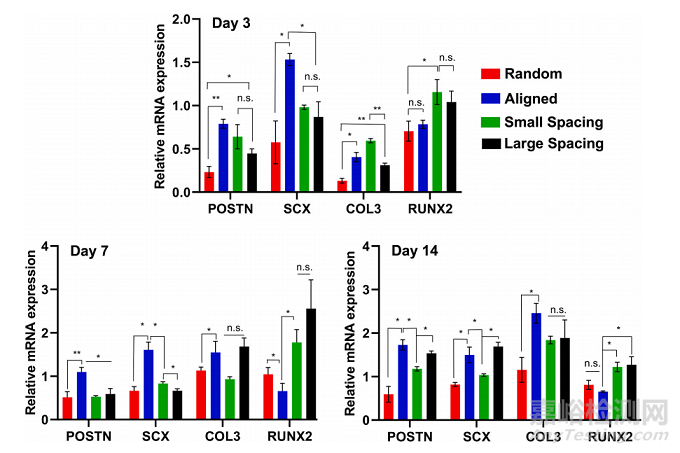
为了评估hPDLSCs在工程支架上的分化潜力,在缺乏分化因子的情况下,评估了特异性编码韧带生成(骨膜蛋白[POSTN]、巩膜[SXC]和胶原III [COL3])和成骨(runt相关转录因子2 [RUNX2])的基因表达(图4)。在第3、7和14天,所选的韧带生成基因(即骨膜蛋白、巩膜和Col3)的mRNA水平在纤维对齐的支架中显著升高,而成骨标记物(Runx2)在横线0/90◦250 μm和500 μm链间距的支架中显著升高。
Fig. 4. Ligamentogenic and osteogenic differentiation of hPDLSCs seeded on the various MEW PCL scaffolds. The mRNA levels at days 3, 7, and 14 of selectedligamentogenic genes (i.e., periostin, Scleraxis, and Col3) were significantly higher in scaffolds with aligned fibers, whereas an osteogenic marker (Runx2) wassignificantly higher in crosshatch 0/90◦ scaffolds with 250 μm and 500 μm strand spacing. (Mean ± SD, n = 4). *p < 0.05, **p < 0.01.
3. 巨噬细胞的伸长和极化取决于纤维取向和支架结构
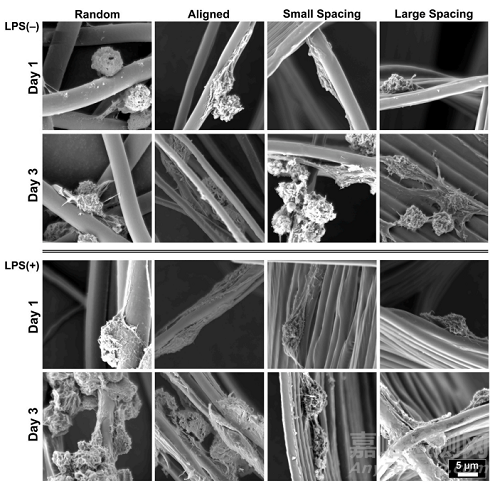
研究通过控制支架结构(链间距)和纤维结构(对齐vs随机),将RAW 264.7细胞(巨噬细胞)接种在确定的支架上,在培养基中加入的炎症标志物表达诱导物——大肠杆菌脂多糖(LPS),通过qPCR和ELISA检测巨噬细胞表型标志物的表达变化。在随机定向的纤维支架上培养的RAW 264.7细胞能够在第1天保持圆形表型,而当巨噬细胞在对齐的支架上培养时,细胞伸长更为突出(图5)。同时,在所有测试支架上,未受到刺激和LPS刺激的RAW 264.7细胞的细胞扩散和伸长保持相当(图5)。值得注意的是,即使在炎症刺激的环境中,纤维排列和链间距倾向于影响巨噬细胞伸长,这被认为是促进表型标记物从M1到M2表达的变化。
Fig. 5. Representative SEM images showing RAW264.7 cells’ morphology of spontaneously differentiated and LPS-stimulated macrophages. MEW scaffoldswith varying fiber orientation and architecture(strand spacing), namely, random, aligned, and scaffolds of 250 μm and 500 μm strands spacing at 0◦/90◦-oriented junctions. The images show mixed patterns of macrophages spreading, the round shapetypical for M1 and more pronounced elongatedpattern typical for M2 phenotype.
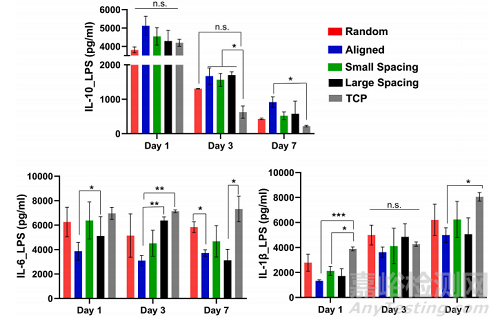
LPS刺激巨噬细胞在不同纤维取向和结构(链间距)支架上的细胞因子释放。使用在不同支架上培养巨噬细胞后提取的上清液测量释放的细胞因子,并将其与对照TCP进行7天的比较(图6)。
Fig. 6. Cytokine release of LPS-stimulated macrophages on scaffolds with different fiber orientation and architecture (strand spacing). Released cytokines weremeasured using supernatants extracted after culturing macrophages on different scaffolds, and they were compared to control TCP over 7 days. (Mean ± SD, n = 3).*p < 0.05; **p < 0.01, ***p < 0.001.
此外,在lps刺激的巨噬细胞中评估了7天的基因表达谱(图7)。qPCR检测M1、IL-1β、IL-6和M2、IL-10 7 d内特异性标记物的表达。我们认为M2表型与M1表型具有不同的功能,通过刺激细胞增殖和ECM沉积上调修复和再生相关因子,以及血管生成效应。总之,我们的数据表明,排列的纤维结构和具有大小链间距的高度有序的支架设计促进巨噬细胞向M2表型极化。
Fig. 7. Gene expression profile of LPS-stimulated macrophages, the level of IL-10, MRC1 and IL-1β. Expression of specific markers was measured using qPCR for M1,IL-1β and IL-6 and for M2, IL-10 over 7 days; data was compared to TCP as a reference sample. (Mean ± SD, n = 3). *p < 0.05; **p < 0.01, ***p < 0.001.
4. 组织特异性支架指导牙周再生的体内评估
为了阐明组织特异性属性的重要性,我们详细制作了一种新型纳米结构氟化磷酸钙(F/CaP) MEW PCL支架。所制备的组织特异性支架具有明显的纤维取向(图8A)。特别是,SEM分析表明,设计的PDL区域在~200 μm高度与原始PDL空间相似,而骨区域在~800 μm高度高度具有高度有序(0/90◦交叉锯齿)和多孔(500 μm链间距)。FTIR光谱数据显示(图8B),F/ cap涂层支架中~565 cm和~960 cm处与磷酸盐相关的化学官能团,而灌注胶原蛋白的支架和胶原蛋白也显示了酰胺基团,证实了胶原蛋白在MEW支架内的成功渗透。扫描电镜(SEM)和红外光谱(FTIR)分析表明,在不改变所使用的基底材料成分的情况下,可以有效地制备胶原灌注支架。
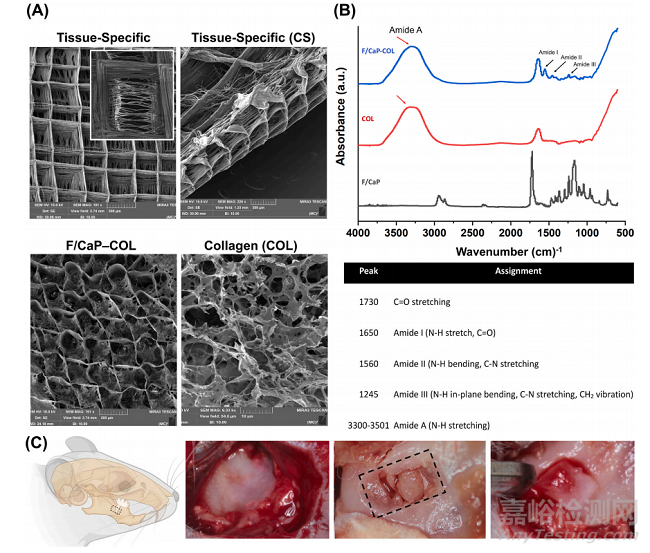
Fig. 8. Fabrication and characterization of tissue-specific zonal scaffolds. (A) Representative SEM images for tissue-specific scaffold with aligned PDL zone and 500μm strands spacing for bone zone, and SEM images for collagen-infused scaffolds. (B) FTIR spectra of collagen, F/CaP-coated MEW PCL scaffold, and F/CaP-coatedMEW PCL scaffold infused with collagen. Data show chemical functional groups related to phosphate at ~565 cm− 1 and ~960 cm− 1 in F/CaP-coated scaffolds, whilecollagen-infused scaffolds and collagen also show the amide groups, confirming successful permeation of collagen within the MEW scaffolds. (*) indicates thepresence of PCL. (C) Generation of the rat mandibular periodontal fenestration model. Photographs of a rat mandible after the incision, flap elevation, creation of thedefect, and implantation of tissue-specific scaffold in the defect region.
利用已建立的大鼠下颌骨牙周开窗缺损模型,对工程纤维支架支持新组织沉积的潜力进行评估(图8C)。根据我们的组织学和免疫组化结果,制备的带式支架的成分(即F/ CaP涂层)和结构组织(纤维排列)导致牙槽骨和PDL同时再生(图9)。microCT分析显示,在所研究的支架组之间,缺损部位的骨形成存在显著差异(图9A)。术后3周和6周,不同组骨容量、骨填充和组织矿物密度的μCT评估。与对照组和非包膜组相比,包膜(F/CaP)组和胶原蛋白的存在进一步显示了骨体积和骨填充的显著差异(图9B)。
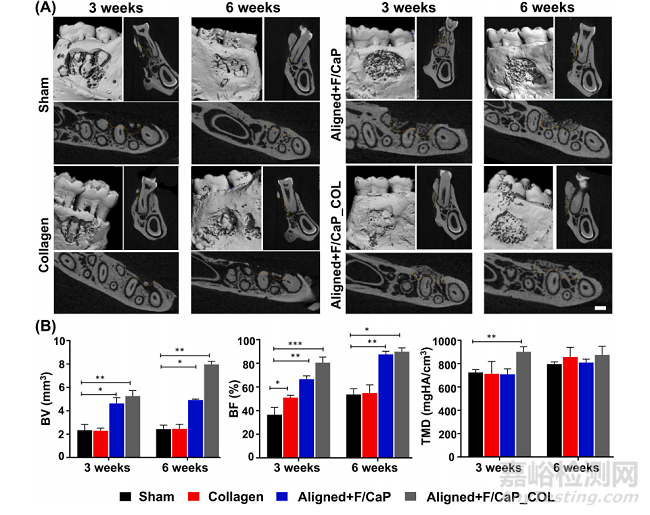
Fig. 9. MicroCT assessment of bone formation. (A) Representative microCT images of the fenestration defect exposing the distal root of the second molar at 3 and 6weeks in the Control (Sham), Collagen, and Biphasic scaffold with Aligned (PDL) compartment and non-coated and coated (F/CaP) and aligned and coated (F/CaP) +collagen. Transverse views highlight the visual differences between the area and density of bone regenerated within the defect. (Scale bar = 1 mm). (B) μCT assessments of bone volume, bone fill, and tissue mineral density at 3 and 6 weeks after surgery, within the different groups. The coated (F/CaP) group and the presenceof collagen further show significant differences for bone volume and bone fill compared to both the control and non-coated groups. Mean ± SD (n = 6). ANOVA: *p< 0.05; **p < 0.01.
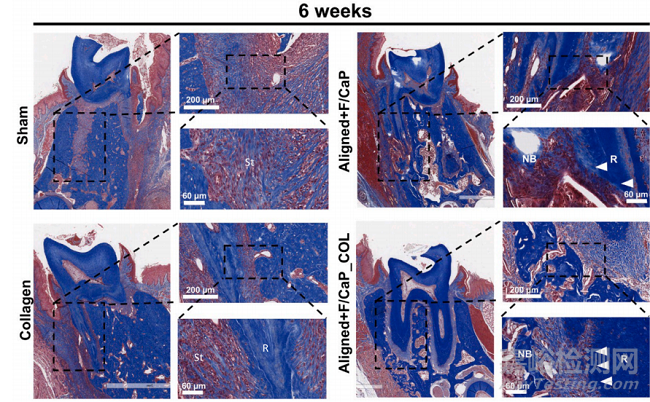
对新形成的牙周组织的组织学评估显示,所提出的组织特异性分区支架(即对齐/ F-CaP涂层支架)在再生能力(图10)。对照组由于上皮组织向下生长,表现为软组织侵犯;单用胶原蛋白均不能促进牙周硬组织和软组织的再生。值得注意的是,我们的组织特异性分区支架为组织形成提供了指导,与假组(对照组)和胶原组相比,对齐/ F-CaP涂层支架的新骨形成量更高。有趣的是,两种组织特异性分区支架(输注和不输注胶原蛋白)都维持了与天然牙周组织相似的PDL空间。总体而言,F/ cap涂层的MEW PCL支架与未涂层(NaOH蚀刻)和原始支架相比,具有更高的抗拉强度和杨氏模量。未来的研究不仅要解决再生组织的生物力学问题,而且要解决循环(咀嚼)负荷下支架性能和整体完整性的问题。
Fig. 10. Masson’s trichrome staining of periodontal defects treated with the distinct scaffolds and evaluated after 6 weeks post-scaffolds implantation. Representative Masson’s trichrome-stained horizontal cross-section of Control (Sham), Collagen, and tissue specific scaffolds with aligned fiber configuration (PDL)compartment and coated (F/CaP) fibers (bone compartment) and tissue specific scaffold infused with collagen at 6-weeks post-implantation. Yellow dashed linehighlights the area of scaffold placement and new bone formation. White arrowhead for PDL, NB: new bone; R: Root surface; St: Soft tissue.
10. 结论
总之,我们的研究结果为支架结构(链间距)、纤维结构和成分(F/CaP涂层)的形态和功能变化提供了证据。具体而言,排列整齐的纤维强烈支持韧带形成,而排列整齐的支架结构(束间距为500 μm)支持成骨,这在牙周组织工程中尚未见报道。此外,纤维方向和链间距被发现与巨噬细胞的形态伸长和向促愈合的M2表型分化直接相关。体内研究结果证实,结构定制的支架具有高度定向(对齐)的MEW PCL纤维形成的PDL区和由F/cap涂层的MEW PCL纤维组成的骨区,其链间距为500 μm,可以在一个成熟的啮齿动物下颌开窗缺损模型中实现协调的牙周组织再生。总之,我们的研究结果表明,MEW最终可能导致区域性生物材料介导支架的发展,能够指导组织特异性干细胞分化和巨噬细胞极化。这种方法可以作为一种个性化的治疗方法,用于炎症驱动疾病(如牙周炎)的有效组织再生。
原文信息: Arwa Daghrery, Jessica A. Ferreira, Jinping Xu, Nasim Golafshan, Darnell Kaigler, Sarit B. Bhaduri, Jos Malda, Miguel Castilho, Marco C. Bottino.
Tissue-specific melt electrowritten polymeric scaffolds for coordinated regeneration of soft and hard periodontal tissues.
Bioactive Materials, 19 (2023) 268–281.