摘要
肠溶制剂的生物等效性试验是仿制药质量和疗效一致性评价的难点之一。本文以质子泵抑制剂类代表药物奥美拉唑为例,总结和分析了奥美拉唑肠溶制剂通过仿制药质量和疗效一致性评价的生物等效性试验情况,就试验内容、试验设计及样本量等提出一些建议,旨在为今后开展奥美拉唑肠溶制剂生物等效性试验提供参考。
根据《国务院关于改革药品医疗器械审评审批制度的意见(国发[2015]44号)》、《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见(国发[2016]8号)》,药品生产企业原则上应采用体内生物等效性试验的方法进行一致性评价。奥美拉唑肠溶制剂作为目前有效的抗溃疡病药物,临床上应用广泛,并被列入2018年版国家基本药物目录。生物等效性试验是仿制药质量和疗效一致性评价的重要内容,奥美拉唑肠溶制剂生物等效性试验有一定的特殊性且不容易得到生物等效性的结果,本文总结、分析已经通过仿制药一致性评价的奥美拉唑肠溶制剂的生物等效性试验情况,提出一些建议,旨在为今后开展奥美拉唑肠溶制剂生物等效性试验提供参考。
一、资料与方法
1、研究资料
在国家药品监督管理局药品审评中心仿制药一致性评价的信息公开栏目中,检索通过仿制药一致性评价的奥美拉唑肠溶制剂的生物等效性试验情况。
2、研究方法
对于二交叉试验,按Schütz[1]的方法,根据样本量、受试制剂与参比制剂药动学参数几何均数比值(GMR)的90%置信区间(90% CI)估算个体内变异系数(CVintra%)。对于三周期部分重复试验和四周期完全重复试验,根据信息公开栏中参比制剂个体内标准差(SWR)计算CVintra% [2]。
二、结果
1、公示信息
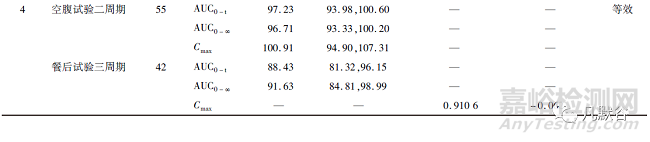
截至2022年3月26日,在国家药品监督管理局药品审评中心仿制药一致性评价的信息公开栏中显示共有1家企业的奥美拉唑肠溶片和6家企业的奥美拉唑肠溶胶囊通过了一致性评价,主要信息总结如下:奥美拉唑肠溶片规格为10mg,奥美拉唑肠溶胶囊规格均为20mg;均以健康受试者为试验对象;试验内容均包括空腹和餐后用药试验;空腹用药试验的试验设计为二交叉试验或三周期部分重复试验,餐后用药试验的试验设计为二交叉试验、三周期部分重复试验或四周期完全重复试验;试验设计为二交叉试验时,采用平均生物等效性(ABE)的方法进行生物等效性评价,试验设计为三周期部分重复试验或四周期完全重复试验时,当SWR≥0.294时采用参比制剂标度的平均生物等效性(RSABE)的方法进行生物等效性评价,当SWR<0.294时采用ABE的方法进行生物等效性评价;空腹用药试验样本量为27~55例,餐后用药试验样本量为38~58例;检测物质均为血浆中奥美拉唑;评价指标均为AUC和Cmax;空腹用药试验均采用ABE的方法进行生物等效性评价;餐后用药试验中4家企业的AUC0-t、6家企业的AUC0-∞和1家企业的Cmax采用ABE的方法进行生物等效性评价,3家企业的AUC0-t、1家企业的AUC0-∞和6家企业的Cmax采用RSABE的方法进行生物等效性评价。评价结果详见表1。


2、生物等效性评价结果分析
空腹用药试验均是采用ABE的方法进行生物等效性评价。AUC0-t 的GMR为97.23%~104.47%,最低的90% CI下限为93.81%,最高的90% CI上限为111.37%;AUC0-∞的GMR为 96.71%~106.66%,最低的90%CI下限为93.33%,最高的90%CI上限为111.78%;Cmax的GMR为 95.74%~111.72%,最低的90%CI下限为86.48%,最高的90%CI上限为122.56%。由此可见,空腹用药试验 AUC0-t,AUC0-∞和Cmax的GMR接近1,AUC0-t和AUC0-∞的90%CI较窄,而Cmax的90%CI较宽。
餐后用药试验中4家企业的AUC0-t、6家企业的AUC0-∞和1家企业的Cmax采用ABE的方法进行生物等效性评价。AUC0-t的GMR为88.43%~114.1%,最低的90%CI下限为81.32%,最高的90%CI上限为121.74%;AUC0-∞的GMR为91.63%~113.8%,最低的90%CI下限为84.81%,最高的90%CI上限为121.34%;Cmax的GMR为112.2%,90%CI为100.84%~124.79%。餐后用药试验中3家企业的AUC0-t、1家企业的AUC0-∞和6家企业的Cmax采用RSABE的方法进行生物等效性评价。AUC0-t的点估计值(point estimate)为1.05~1.1242,AUC0-∞的点估计值为1.09,Cmax的点估计值为0.9106~1.2435。由此可见,餐后用药试验AUC0-t,AUC0-∞和Cmax的GMR或点估计值范围偏大,且其90%CI也较宽。
3、CVintra%分析
试验设计为二交叉试验时,根据样本量、受试制剂与参比制剂药动学参数GMR的90%CI估算CVintra%。试验设计为三周期部分重复试验或四周期完全重复试验时,根据信息公开栏中SWR计算CVintra%,当SWR<0.294时(相当于CVintra%<30%),部分品种未提供SWR,其CVintra%未知,结果见表2。
空腹用药试验结果表明,7家企业奥美拉唑药动学参数AUC0-t,AUC0-∞和Cmax的CVintra%均<30%,其中5家企业试验设计为二交叉试验,可以估算CVintra%,其AUC0-t和AUC0-∞的CVintra%均<20%,其Cmax的CVintra%在18.9%~26.6%。餐后用药试验结果表明,3家企业奥美拉唑药动学参数AUC0-t的CVintra% >30%(32.9%~46.57%),其余4家企业奥美拉唑药动学参数AUC0-t的CVintra%均<30%(1家企业为19.1%,另3家企业未知);1家企业奥美拉唑药动学参数AUC0-∞ 的CVintra%>30%(44.65%),其余6家企业奥美拉唑药动学参数AUC0-∞的CVintra%均<30%(2家企业为18.8%~28.7%,另4家企业未知);7家企业奥美拉唑药动学参数Cmax的CVintra%均>30%(30.3%~86.70%)。
三、讨论
1、临床试验现状
奥美拉唑是质子泵抑制剂类代表药物,通过特异性抑制胃壁细胞的H+⁃K+ATP酶(质子泵),从而阻断胃酸分泌终端步骤,产生强力的抑制胃酸分泌作用。国产奥美拉唑肠溶制剂价格相对低廉,占据了较大的市场份额,由于国内生产厂家众多,竞争较为激烈。在药物临床试验登记与信息公示平台上检索“奥美拉唑肠溶胶囊”,目前共36项药物临床试验,试验状态除了35项在进行中或已完成外,还有1项试验为申办方主动终止。在药物临床试验登记与信息公示平台上检索“奥美拉唑肠溶片”,共4项药物临床试验,试验状态除了3项已完成外,还有1项试验为申办方主动终止。
本文中总结的7个奥美拉唑肠溶制剂的生物等效性试验均采用LC⁃MS/MS检测血浆中奥美拉唑;受试者空腹口服奥美拉唑肠溶胶囊参比制剂后奥美拉唑的Cmax为(436±46)ng·mL-1,RSD仅为10.6%;受试者餐后口服奥美拉唑肠溶胶囊参比制剂后奥美拉唑的Cmax为(262±58)ng·mL-1,RSD仅为22.3%,不同试验得到的Cmax比较接近,这说明临床操作、生物分析方面的误差大大降低,相对于前些年试验的质量有明显提高[3]。
2、试验设计及样本量
奥美拉唑肠溶制剂空腹用药试验的试验设计为经典的二交叉试验或三周期部分重复试验,二交叉试验样本量为27~55例,三周期部分重复试验样本量为48例,Cmax的CVintra%均低于30%(18.9%~26.6%)。基于Cmax的CVintra%较低,推荐采用经典的二交叉试验,按GMR为0.95或1.05,根据Cmax的CVintra%计算的二交叉试验样本量不超过32例。奥美拉唑肠溶制剂餐后用药试验的试验设计为经典的二交叉试验、三周期部分重复试验或四周期完全重复试验,二交叉试验样本量为48例,三周期部分重复试验样本量为38~58例,四周期完全重复试验样本量为46例,Cmax的CVintra%均高于30%(30.3%~86.70%),如果采用经典的二交叉试验评价其与参比制剂是否具有生物等效性,则需要较大的样本量,推荐采用重复试验设计,按GMR为0.90或1.10,根据Cmax的CVintra%估算的三周期部分重复试验样本量不超过45例,按此估算的四周期完全重复试验样本量不超过30例[2]。
3、试验内容
奥美拉唑为生物药剂学分类系统(BCS)Ⅱ类的化合物[4],且奥美拉唑肠溶制剂为迟释制剂,吸收过程容易受进食和食物的影响;另外,奥美拉唑肠溶制剂说明书中规定的服用方法为口服,1~2次·d-1,可每日晨起或早晚各1次,表明患者可能会涉及空腹和饮食2种条件下服药,因此其生物等效性试验应进行空腹和餐后用药试验。
4、试验结果
由于试验结果来自多个品种,且临床试验质量明显提高,综合分析其结果后可得到一些有价值的信息,汇总如下:①上述品种在空腹和高脂饮食条件下均等效。空腹条件下,AUC0-t,AUC0-∞和Cmax的GMR接近1,AUC0-t和AUC0-∞的90%CI较窄,而Cmax的90%CI较宽。高脂饮食条件下,AUC0-t,AUC0-∞和Cmax的GMR或点估计值范围偏大,且其90%CI也较宽,说明高脂饮食条件下试验失败的风险较高。②空腹条件下,不同试验得出的CVintra%差别较小,Cmax的CVintra%在18.9%~26.6%范围内。高脂饮食条件下,不同试验得出的CVintra%差别较大,Cmax的CVintra%在30.3%~86.70%范围内,且CVintra%较空腹条件下明显增加。分析原因,奥美拉唑肠溶制剂为迟释制剂且低溶解性药物制剂,饮食因素对奥美拉唑的CVintra%影响较大[5]。③高脂饮食可使奥美拉唑肠溶制剂的AUC和Cmax分别降低约16%和40%。奥美拉唑的理化性质偏碱性,不耐酸,因此奥美拉唑应做成肠溶制剂,其肠溶制剂能够避免受到胃酸的破坏,进入肠道之后,当pH值接近6.8时快速崩解释放。空腹条件下能够较好地完成这个过程,但餐后条件下受食物pH的影响,部分奥美拉唑释放将受到胃酸的破坏而影响其吸收。因此通常建议奥美拉唑肠溶制剂最好在饭前至少0.5h或饭后2h服用。
5、其他
在人体内奥美拉唑主要由CYP2C19代谢,形成主要代谢产物羟基奥美拉唑;次要经CYP3A4代谢,生成奥美拉唑砜。奥美拉唑的药动学受CYP2C19基因多态性等因素的影响,表现为个体间差异较大。文献报道,45例黄种人和36例白种人口服奥美拉唑肠溶胶囊参比制剂后奥美拉唑的Cmax和AUC0-t个体间差异均较大[6-7]。在交叉设计的生物等效性试验中,若有受试者只完成部分周期的试验,其Cmax,AUC0-t非常高或非常低,如果纳入生物等效性分析,可能会引起生物等效性评价结果产生较大偏差。因此,对于在交叉设计的生物等效性试验中只完成了部分周期的受试者,建议我国不将其纳入生物等效性评价[8-9],美国最近颁布的指导原则未对此进行明确规定[10]。
参考文献:《中国新药杂志》2023年第32卷第6期








