一、引言
药品的微生物限度检查是涉及药品质量和安全的重要项目,各国法规和技术指南对非无菌产品以及原辅料污染微生物的控制要求中,均需要检查不可接受微生物,期望减少不可接受微生物对产品质量以及患者安全带来的风险,确保产品有效性和安全性,但实际执行中重视程度和可操作性不强,且历史上非无菌产品中检出控制菌以外的不可接受微生物导致召回的事件时有发生[1-5]。其主要原因为目前各国药典中虽有原则性要求,但在实际工作中,哪些产品需要进行不可接受微生物检测,如何进行决策,目前没有清晰、明确的规定。另外,从非无菌制剂、原辅料中分离的微生物种类繁多,实际工作中不可能将所有的不可接受微生物全部列举出来,需要评估人员针对具体产品或者辅料进行分析,故如何准确地判断和决策在实际工作中有一定的困难。
本文基于《中华人民共和国药典》(以下简称《中国药典》)[6]、美国药典[7]和欧洲药典[8]以及《中华人民共和国药品管理法》(以下简称《药品管理法》)等关于药品质量安全要求,研讨不可接受微生物判断标准;同时结合三部药典以及ICHQ6A关于质量标准中新原料药和制剂的检测以及可接受标准、化学药物中不同剂型以及原辅料的微生物限度的要求,分析非无菌产品以及原辅料中不可接受微生物控制策略,以期为今后在实践工作中能够准确地确认不可接受微生物,分析识别其风险提供参考。
二、不可接受微生物判断标准
《中国药典》、美国药典以及欧洲药典中关于不可接受微生物描述和判断标准的比对见表1。
表1表明,《中国药典》以“具有潜在危害的微生物”形式描述,美国药典和欧洲药典均以检出“other microorganisms”形式描述,三部药典均只有框架性的定义和评估内容,没有具体的判定标准,所以需要生产企业结合法规要求以及制剂本身特性给出具体的判定标准,实现对不可接受微生物的控制。
王似锦等[9]对不可接受微生物定义进行了梳理,并给出了不可接受微生物的两个特征:(1)可在药品中繁殖,并对其化学、物理性质产生不利影响,且破坏该药品的功能及疗效的微生物;(2)当药品中存在的数量以及致病性会导致特定给药途径下适用该药品治疗的患者发生感染的微生物。此为基于微生物危害性评估给出的定义,本文结合上述定义以及《药品管理法》[10]要求对于药品定义和特殊要求,从不同角度给出不可接受微生物判断标准。
首先不可接受微生物属于非药典规定在产品或者原辅料中不得检出的控制菌,其次存在于非无菌产品且符合以下特征中的任何一项的微生物,可判定为不可接受微生物:(1)分离的微生物造成药品理化特性发生改变;(2)分离的微生物对患者造成危害;(3)分离的微生物干扰药品治疗效果。以上判断标准,既符合不可接受微生物评估的目的,又能够帮助评估人员简单易行地判断分离的微生物是否是不可接受微生物。
三、不可接受微生物的控制策略
目前各国药典仅有不可接受微生物评估内容,没有给出不同的药品以及原辅料的不可接受微生物的控制策略,故需要生产企业依据产品以及原辅料的微生物风险给出具体的控制策略,方便检验人员以及评估人员了解执行。本文比较了ICH Q6A[1]、《中国药典》[6]、美国药典[7]以及欧洲药典[8]关于微生物限度检查要求,梳理出不可接受微生物控制策略。不可接受微生物评估需要针对具体产品以及原辅料进行分析,必要时结合微生物在非无菌产品中污染的可能性以及历史召回事件分析,给出非无菌产品和原辅料在不可接受微生物评估时需要关注的风险点。
3.1 非无菌产品不可接受微生物控制决策树
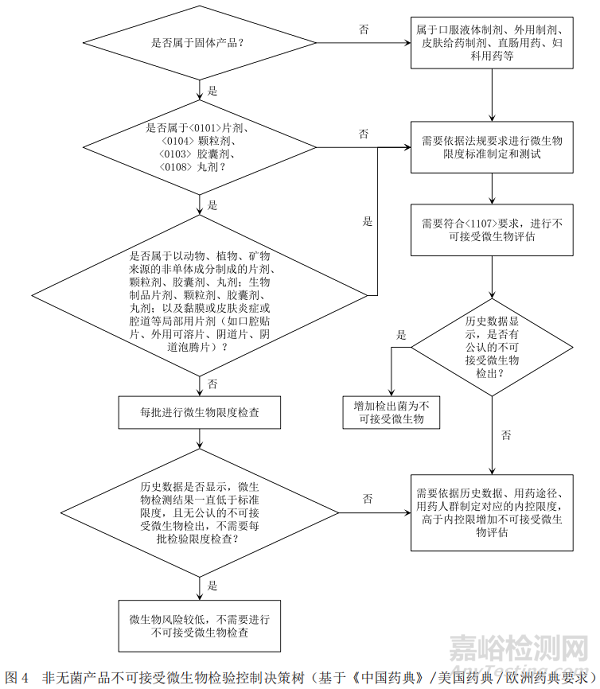
基于ICH Q6A[1](决策树8:非无菌药品的微生物检查),《中国药典》[6]、美国药典[7]以及欧洲药典[8]关于微生物限度检查要求分别给出图1、图2和图3中的产品不可接受微生物策略,通过比对找出共性的特征,最终梳理出非无菌产品不可接受微生物决策树。
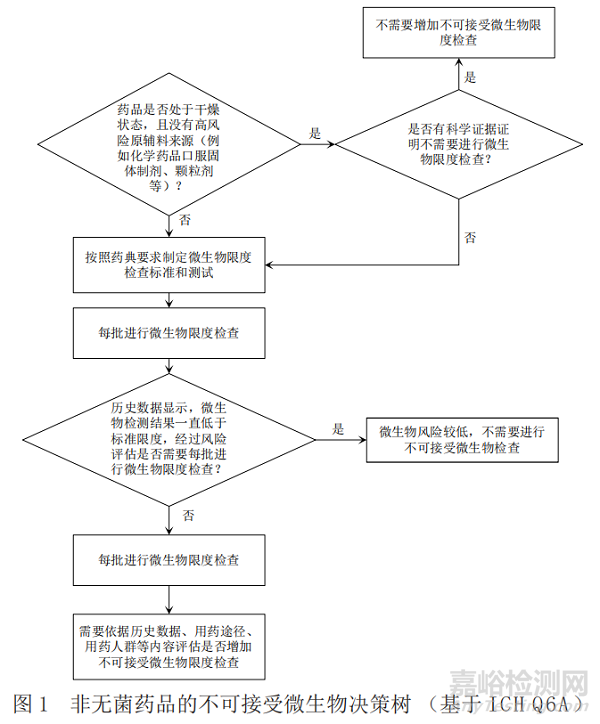
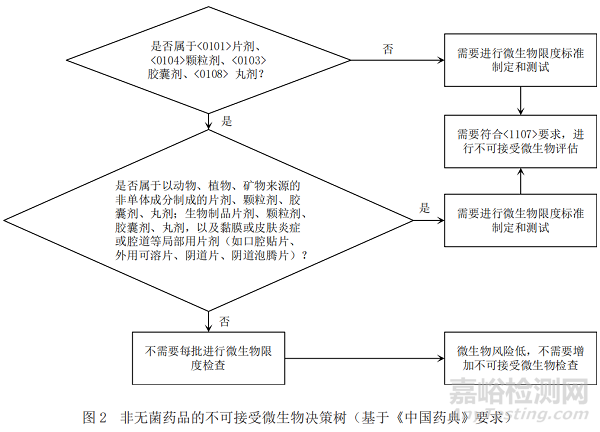
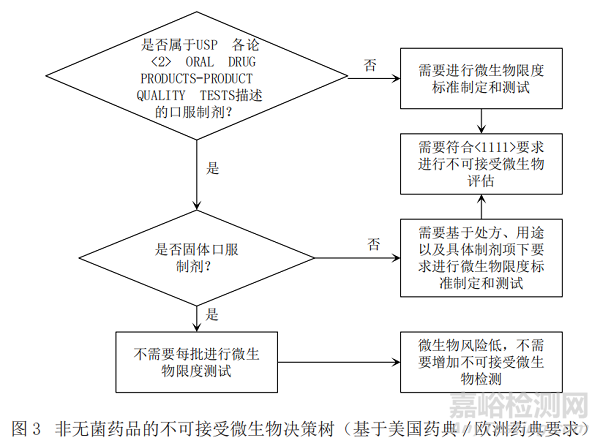
通过比对,依据ICH Q6A所作的决策树可以涵盖中、美、欧三方药典项下的要求,强调了历史数据在决策中的重要性;依据药典所作的决策树明确了各具体剂型要求,故本文形成的决策树主要依据ICH Q6A所作的不可接受微生物风险控制决策树,同时兼顾《中国药典》中的具体剂型要求,可以快速准确地帮助相关人员进行不可接受微生物评估和决策,具体的策略见图4。
对于具体的每一种产品,不可接受微生物风险仅考虑以上因素远远不够,即使水分活度低的固体产品,虽不利于微生物的生长繁殖[3],但是生产中污染的微生物有可能稳定地存在于产品中,超过一定的数量,就有可能增加不可接受微生物的风险;即使同一种制剂,检出同一种微生物,但因用药人群的不同,其风险有可能不同。故在不可接受微生物评估时还需要基于产品工艺、特征、污染微生物的可能性、污染水平以及潜在危害等因素进行识别和评估,给出产品不可接受微生物的内控限和必须控制的不可接受微生物。内控限的设定需要企业根据产品特性是否有利于微生物生长繁殖,产品生产中需要的原材料引入不可接受微生物种类、数量以及生产过程中工艺用水、生产环境、工艺过程中不可接受微生物可能的生长繁殖情况等综合评估产品整个生命周期内污染状况以及污染特性,综合评估得出[4]。在内控限设置时,还需要考虑产品的用药人群。对于用药人群为健康非免疫力低下人群的产品,内控限相比用于免疫力低下或者免疫系统不全的人群的产品高,例如有些企业对于非无菌化学制剂同一种产品,当用药人群为非新生儿、婴幼儿及体弱者等非免疫力低下人群时,将内控限设置为100 cfu·g-1;当用于免疫力低的人群时,内控限设定为50 cfu·g-1,当检验数据高于此内控限时,则需要增加不可接受微生物评估。
另外,不可接受微生物评估还需要关注公认的有害微生物,例如洋葱伯克霍尔德菌群、坂崎肠杆菌、皮斯罗尔斯顿菌等。其中洋葱伯克霍尔德菌群容易存活在水系统以及液体产品中,且能在有强抑菌性的产品中生长繁殖[5,11],可能增加用药人群感染和致病风险,目前美国药典将其列为吸入剂、水溶性口服制剂等制剂中不可检出的微生物,如果产品中检出该微生物,可直接将其作为不可接受微生物。与此类似,美国FDA建议药品生产企业关注水基质药品中洋葱伯克霍尔德菌群污染的问题[12-13]。坂崎肠杆菌对婴幼儿有潜在的风险,如果检出,根据临床经验有可能增加感染风险,则同样需要将其作为不可接受微生物。皮斯罗尔斯顿菌需要考虑用药人群以及用药途径判定其是否作为不可接受微生物进行处理,如丙酸氯倍他索乳膏[14](皮肤外用非无菌产品)检出的皮斯罗尔斯顿菌,对于健康人群、皮肤完整的人群,不太可能存在致病性,但是对于免疫低下、皮肤不完整(例如晒伤、皮癣或者皮肤擦伤),有可能引起系统性的疾病,进入血液后有可能引起败血症、肺炎等。
实际中的情况可能更为复杂,企业在参考以上不可接受微生物检验策略时,不仅需要考虑产品特性、工艺过程,同时还需要对制剂的给药途径、用药人群、剂型特点等因素进行综合考虑,才能得出合理的评估结论。
3.2 原料药和辅料不可接受微生物的控制决策树
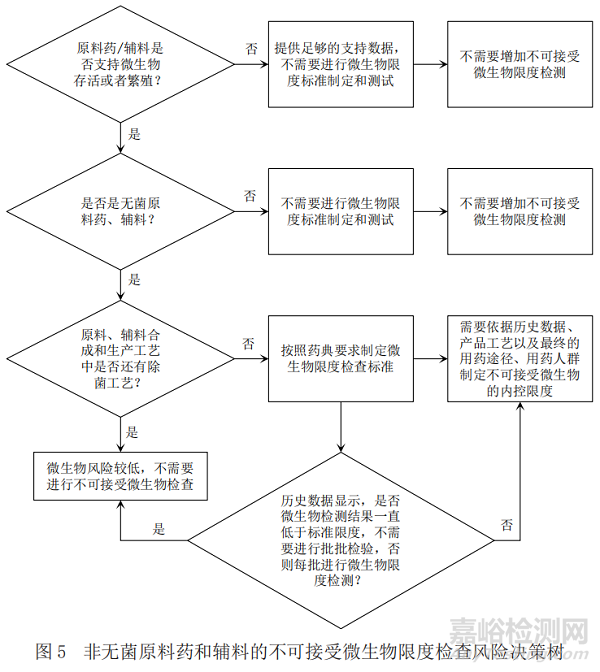
原料药和辅料中不可接受微生物的控制,基于源头和过程控制理念,对于从源头上降低产品中不可接受微生物风险有着重要的意义。其控制策略的制定和终产品一样,同样需要在满足各国药典对于原辅料微生物限度检验要求基础上,根据原辅料来源(特别需要关注天然来源原辅料中可能潜在的微生物)、原辅料及其制剂的特性、原辅料以及所用制剂的工艺过程是否有利于微生物繁殖、原辅料的用途、最终制剂的用药人群、原辅料以及所用制剂的历史数据等因素综合评估,给出不可接受微生物检验策略,确保最终制剂不可接受微生物风险处于受控状态。
为了便于参考,本文在考虑以上评估要素的基础上,同样基于ICH Q6A[6](决策树6:原料药和辅料的微生物限度检查)梳理出图5非无菌原料药和辅料的不可接受微生物的控制策略。
四、结论
不可接受微生物为药品中危害患者用药安全和产品质量的一类微生物,企业应当根据产品属性、工艺特性、患者人群、用药途径、生产过程控制中的风险因素评估,基于产品历史数据、可能的药害事件,给出不同产品的不可接受微生物控制策略,避免不可接受微生物对于产品质量或者患者造成危害。


作者:马英英',王似锦2,马仕洪2,绳金房’(1.西安杨森制药有限公司,西安 710304; 2.中国食品药品检定研究院,北京 100050: 3.陕西省药品技术审评中心,西安 710065 )