抗体药物偶联(Antibody Drug Conjugate, ADC)是一种克服化疗局限性、选择性靶向肿瘤细胞的新兴技术。ADC的有效性取决于几个物理化学因素,如偶联位点、分子量、连接体长度、位阻、半衰期、偶联方式、结合能等。尽管有超过100种ADC处于临床试验阶段,但FDA批准临床使用的ADC只有14种。因此,设计一个理想的ADC仍然具有挑战性。在本文中,我们讨论了影响ADC有效性的关紧因素。此外,我们还介绍了偶联方法的最新进展。此外,我们还重点介绍了ADC的作用模式、最近的挑战以及ADC的未来前景。
前言
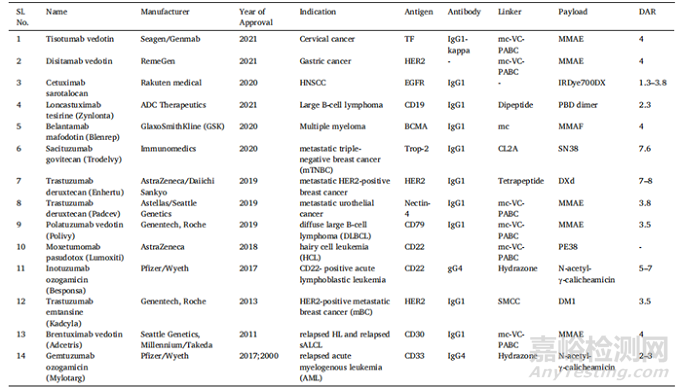
抗体药物偶联物(Antibody Drug Conjugate, ADC)是一类新兴的强效生物药物,它通过合适的连接物(Linker)将强效细胞毒性有效载荷(Payload)与工程化单克隆抗体结合起来,单克隆抗体通过靶向癌细胞表面表达的特定抗原,帮助将结合的有效载荷传递到特定的疾病部位,因此减少旁路效应引起的副作用,提高了治疗效率。尽管有100多种ADC处于临床试验阶段,但FDA批准临床使用的ADC只有14种。14种获批药物中,有7种用于临床治疗血液系统恶性肿瘤,7种用于治疗实体肿瘤(表1)。
一般来说ADC的偶联方式、分子量、连接体长度、位阻、半衰期、异质性以及一些物理化学因素是决定ADC药物有效性的关键,在本文中,我们将重点讨论影响ADC有效性的不同因素。
表1 FDA批准的ADC药物
ADC的组成构建
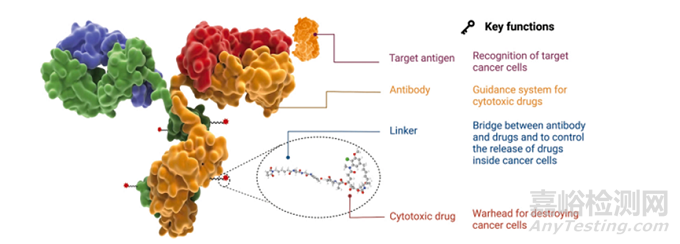
如图1所示,ADC由抗体、连接体和细胞毒性有效载荷组成(图1)。ADC的每一个组成部分都起着至关重要的作用,使ADC稳定和潜在,副作用最小。理想的ADC应能有效地到达靶点而不释放任何脱靶载荷。为了开发一种有效的ADC,必须考虑抗原、抗体、高毒载荷和连接子的选择等因素。
图1 ADC结构示意图
A、抗原(靶点的选择)
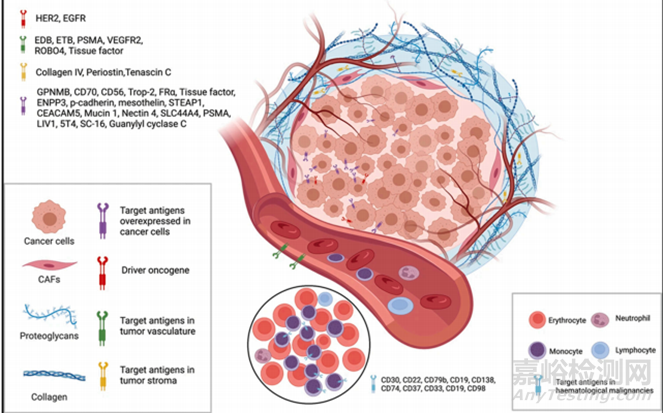
靶抗原有助于区分癌细胞和正常细胞,从而降低脱靶毒性。因此,选择合适的靶抗原是开发理想ADC的第一步。理想的抗原必须具有某些特征,首先与健康细胞相比,它应该在癌细胞表面过度表达。例如,HER2 (三阳性乳腺癌的靶抗原)在癌细胞中的拷贝数是正常细胞的100倍,其次,靶抗原的结合位点应面向癌细胞的外表面,而不是面向癌细胞的内部。使从血管扩散的ADC能够在内吞之前与靶抗原结合,此外,靶抗原不应进入体循环以避免ADC在肿瘤外的不必要结合并且靶抗原应具有内化结合ADC的效力。在已批准和临床期ADC中,最常用的血液学和实体肿瘤靶点分别是CD33、CD30、CD22、BCMA、CD19、CD79B和HER2、Nectin-4、Trop-2、EGFR、TF(图2)。此外,细胞外基质成分、促进血管生成的因子和肿瘤微环境成分已被报道为可能靶点,并在临床前和临床阶段显示出其效力。
B、抗体的选择
纵观ADC药物组成,其中单抗体是与靶抗原特异性结合的重要载体。抗体必须对靶抗原具有高结合力和较低的免疫原性。此外,抗体应具有维持较长的血浆半衰期和快速内吞的能力。此外,在治疗过程中抗体除了可以将有效载荷运送到目标位置外,如图3所示,抗体Fc端还可以引发多种生物学活性,如抗体依赖性细胞介导的细胞毒性(ADCC)、补体依赖性细胞毒性(CDC)和抗体依赖性细胞吞噬(ADP)。在过去的几十年里,在ADC药物发展之初鼠源抗体被用于开发,但鼠源抗体具有高免疫原性使得其应用有一定局限性。经过重组技术的发展,目前较多用于ADC的抗体为人源化抗体甚至全人源抗体,大大降低了抗体的免疫原性。人血清中共存在5种抗体。其中免疫球蛋白G (IgG)类是最丰富的血清抗体,约占总抗体的70-85%,半衰期约为21天。因此IgG是ADC发展中最常用的抗体。此外,IgG类抗体有IgG1、 IgG2、IgG3和IgG4 4类亚类。在这四个亚类中,IgG1对FcYRs具有很高的结合亲和力,因此与其他亚类相比,IgG1诱导ADCC和CDC更有效。IgG2在体内通过非共价结合和高温形成二聚体。此外,由于位阻作用,ADC的效价降低,从而降低ADC的血药浓度。IgG3的半衰期很短,约为7天,因此降低了ADC的治疗效果,并且在半衰期增加的同时不能改善Fc介导的效应物功能。IgG4具有诱导ADCC的能力,但它含有Fab臂交换,导致有效性降低。因此,IgG1是ADC开发过程中最常用的抗体亚型。
图2 肿瘤细胞最常用的靶抗原和肿瘤微环境示意
图3 抗体Fc端生物学活性示意
C、连接子(Linker)
连接子是抗体和有效载荷之间的桥梁,对ADC的稳定性和有效性起着重要作用。此外,有效载荷的释放也主要取决于连接子的类型和性质。较好的连接子应具有高度的水溶性,从从而防止ADC聚集的形成以及有效载荷在体循环中的过早释放。影响连接体稳定性和载荷释放的三个主要因素是共轭位点、位阻和连接子长度。通过选择特定的偶联位点和修饰的连接体,可以得到稳定的ADC。
D、有效载荷(Payload)
有效载荷是ADC的弹头,通常是一种高细胞毒性药物。理想的ADC应具有强效性,对全身循环中多种代谢或分解代谢过程中的任何化学反应都具有稳定性,溶解度高。此外,它还应具有共轭和膜透性的官能团。由于溶酶体屏障和肿瘤微环境的复杂性,很少有细胞毒性药物能到达靶点,因此通过抗体靶向性递送可以有效到达相应靶点。在稳定性方面,有效载荷应该在系统循环和制造过程中对任何化学反应都是稳定的。不稳定的有效载荷可能会在血液循环中转化为活性构型,导致不良副作用。如果有效载荷在溶酶体状态下不稳定,则应在细胞表面或进入细胞之前将有效载荷分离。在溶解度和膜渗透性方面,一般来说,由于抗体的蛋白质性质,偶联过程通常是在水环境中进行的,然而,具有疏水性的有效载荷需要大量的有机溶剂进行共轭。过度使用有机溶剂会使抗体变性。此外,疏水载荷可以改变药代动力学性质并形成聚集。因此,推荐选择水溶性有效载荷来避免上述问题。此外根据目的不同,如果ADC本质上是可切割的,那么它应该是亲水的,以支持ADC获得水溶性。如果为了通过细胞膜进入,所选择的有效载荷本质上应该是亲脂性的,并且可以通过溶酶体膜到达目标。
ADC的偶联方式
工程化半胱氨酸偶联:工程化半胱氨偶联可以使得细胞毒性载荷均匀分布在整个ADC。IgG类抗体含有8个半胱氨酸键,可以通过特异性工程获得DAR值为2-4的ADC类药物。辉瑞等多家公司都使用该技术作为ADC药物偶联方式。与传统ADC相比,这些ADC在临床前阶段显示出巨大的潜力和耐受性。
糖基化位点修饰偶联:一般来说,抗体在Fc区有一个糖基化链。N297残基具有N-糖基化位点,也是进行修饰所关注的位点。化学氧化、化学酶或酶修饰等几种方法已经被用于糖基化位点修饰,从而使得有效载荷高效偶联到抗体上。
酶定向修饰偶联:酶定向修饰,酶分子通过作用到特定氨基酸残疾上,选择性地将有效载荷附加到特定位点。例如Redwood开发了一种SMARTag,利用甲酰基甘氨酸生成酶(formyl glycine- generated enzyme, FGE)将Cys-X-Pro-X-Arg序列插入到抗体中,导致半胱氨酸被甲酰基甘氨酸取代。然后,修饰后的单克隆抗体通过连接特异性结合到含醛的负载物上。
半胱氨酸桥接:半胱氨酸再桥接是一种很有前途的技术,可以在不需要对抗体进行任何特异性工程的情况下开发出均匀稳定的ADC。这些ADC在体外和体内模型中均表现出较高的疗效,具有较高的结合能力和血浆稳定性。
ADC当前所面临的挑战
药物代谢动力学:ADC的药代动力学特征取决于抗体类型、抗体性质(鼠源性、嵌合性和人源性)和结合位点。此外,药代动力学(PK)特性取决于结合能、单克隆抗体和细胞毒载荷,但主要受单克隆抗体的影响。将ADC应用于体循环之前,血清中可能存在完整的ADC、裸抗体、游离形式的细胞毒载荷。影响ADC清除率的两个主要因素是抗体中细胞毒性载荷的解偶联和通过FcRn介导的内吞清除ADC以进行循环过程。此外,由于再循环过程,裸ADC和完整ADC的半衰期都比游离细胞毒性载荷长。因此,制作一个临床使用的药代动力学-药效学模型(PK/PD)模型仍然具有挑战性。
有效载荷的定向释放:实体瘤的治疗ADC也存在十分高的挑战。由于ADC的高分子量,ADC很难渗透到肿瘤部位。并且高效的细胞毒性载荷可引起旁观者效应,并可损害周围的正常细胞。
不良反应:ADC的抗体可能对机体产生免疫原性反应。血小板减少、贫血、中性粒细胞减少、白细胞减少、肝毒性是临床观察中最常见的毒性。此外,对于靶向HER-2特异性ADC的可能存在肺毒性,如间质性肺疾病(ILD)。此外,在含有大量甘露糖的ADC治疗期间,发现了会导致肝毒性。因此,应优先选用低甘露糖的ADC,因此,下一代ADC应仔细优化,以开发出副作用最小的ADC。
总结
ADC是一种新兴的癌症治疗技术,有潜力克服传统治疗的局限性。目前市场上可用的ADC是非常有用的治疗方法。然而,ADC的药理学非常复杂,基于抗体的治疗也可能有新的毒性。因此,设计和合成理想的ADC仍然存在一些挑战。因此,深入了解影响抗体药物偶联物(ADC)有效性的因素可以极大地造福该领域的科学家。这些知识可以指导开发用于医疗的更好和更有效的ADC。通过考虑诸如选择合适的抗体和药物成分、偶联方式、稳定性以及靶表达和疾病环境的影响等因素,科学家可以创建最佳设计的ADC,以获得最大功效,并为患者提供更多的治疗选择。
参考文献
[1]Anupama Samantasinghar, Naina Pullarkat Sunildutt, et al. A comprehensive review of key factors affecting the efficacy of antibody drug conjugate[J] Biomedicine & Pharmacotherapy(2023)
[2]A.Q. Dean, S. Luo, J.D. Twomey, B. Zhang, Targeting cancer with antibody-drug conjugates: promises and challenges, MAbs 13 (1) (2021), https://doi.org/ 10.1080/19420862.2021.1951427.
[3]A. Kopp, G.M. Thurber, Severing ties: quantifying the payload release from antibody drug conjugates, Cell Chem. Biol. 26 (12) (2019) 1631–1633, https:// doi.org/10.1016/j.chembiol.2019.12.001.