人眼的分辨率十分有限,需要通过显微镜对细胞等微观结构观察。但是使用光学显微镜无法对细胞的胞内亚结构进行细致的观察,需要应用电子显微镜等更为昂贵的设备进行观察,这无疑成为了很多经费不足的研究机构的推进研究的阻碍。然而,膨胀显微镜(ExM)技术的发明打破了这一局面。膨胀显微镜技术是一种基于可膨胀的聚电解质水凝胶原位聚合使固定生物标本各向同性扩大的技术。根据该方法和水凝胶化学方法的不同膨胀显微镜可以提供4-20倍的线性放大,从而可以使用传统的共聚焦显微镜对细胞特征进行超分辨率成像。除了细胞成像之外,膨胀显微镜技术还可以清除样本,这有利于更复杂的三维(3D)组织样本的成像。现阶段膨胀显微镜技术已用于组织学切片的病理筛选、单细胞/分子精度观察3D组织样本和亚细胞RNA定位和测定。
迄今为止,膨胀显微镜技术中使用的水凝胶主要是通过使用氧化还原引发剂实现对丙烯酸酯/丙烯酰胺基单体进行链聚合而合成。但是,这种策略往往会导致很长的样品制备时间,并需要一个惰性气氛来缓解氧对引发活性中心的抑制,特别是对于比较薄样品。并且,反应是自发地进行,因此需要通过仔细的实验设计实现对凝胶化时间的控制,以避免在渗透过程中过早的凝胶化。此外,虽然链生长聚合在任何组织细胞中是一样的,但纳米尺度的不均一性会发生,并可能在膨胀时增加荧光团位置的空间误差。与阶梯式生长网络相比,链式聚合水凝胶也具有较差的力学性能,这可能会使膨胀后的样品处理复杂化。因此,需要对膨胀显微镜技术中所采用的凝胶进行改进以克服上述缺陷。
近期,科罗拉多大学博尔德分校的Kristi S. Anseth团队为膨胀显微技术设计了一种专用水凝胶(PhotoExM),以减少处理时间,并实现样品的均匀膨胀。该水凝胶是基于光引发聚合技术,即快速的光引发硫醇/丙烯酸酯混合模式聚合,这种聚合不受氧气的抑制,并单体向生物样品的扩散(即传质)与水凝胶形成的反应动力学解耦,这在膨胀前将细胞嵌入水凝胶中尤其有利。基于该方法,可以实现水凝胶中嵌入的单个细胞的纳米级特征成像,以及实现与细胞外微环境中新生沉积的细胞外基质(ECM)分子的相互作用的观察。该工作以题为“Photo-expansion microscopy enables super-resolution imaging of cells embedded in 3D hydrogels”的文章发表于Nature Materials上。
PhotoExM水凝胶的设计
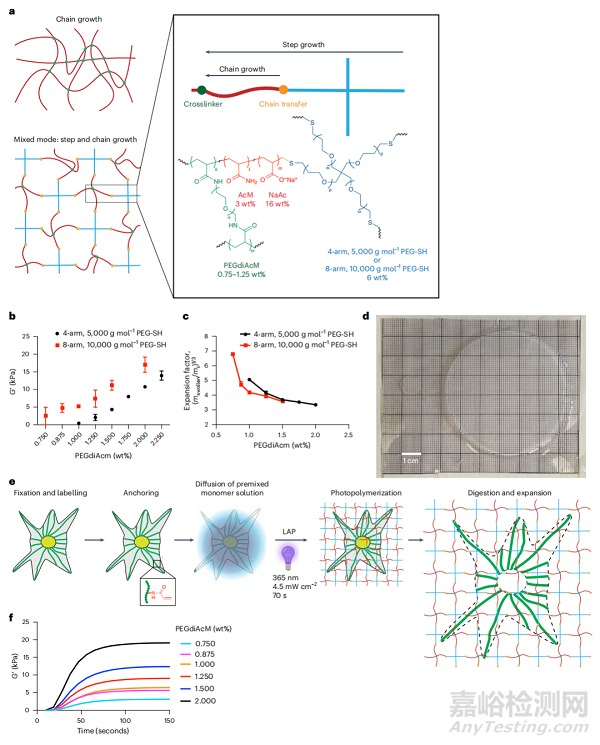
PhotoExM水凝胶是通过光引发的硫醇/丙烯酸酯混合模式聚合制备。该混合模式反应中的网络生长通过丙烯酰胺、丙烯酸钠(16wt%)和聚乙二醇(PEG)-二丙烯酰胺交联剂(PEGdiAcM;Mn = 600 g mol-1)的同时链式生长共聚进行,再加上多臂PEG-SH和传播的链式生长自由基之间的链式传递反应实现阶梯式生长聚合。与纯粹的链式增长网络相比,PhotoExM水凝胶配方的混合模式反应机制使网络交联点的空间位置均匀化,这可以减少扩展后荧光团位置的空间误差。PhotoExM凝胶具有更高的弹性模量,因此与原始的ExM化学相比,在处理过程中具有更大的抗变形能力。更值得注意的是,将8臂PEG-SH加入到网络中所带来的阶梯式增长特性减少了水凝胶形成所需的交联剂(PEGdiAcM)含量,其膨胀率可以通过修改PEGdiAcM的重量百分比轻松调节。
PhotoExM方法的验证和解析
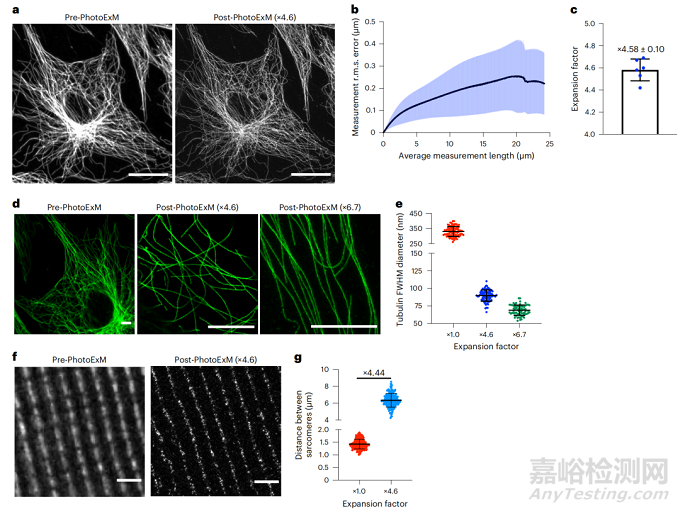
为了量化PhotoExM水凝胶的保真度和均匀性,肌细胞(C2C12细胞)被培养在盖玻片上并固定并免疫标记α-管蛋白作为观察样品。在大约×4.6的样本扩展之后,对相同的区域进行成像。通过计算样品特征的均方根(r.m.s.),将误差作为平均测量长度的函数。在20微米以上,平均r.m.s.误差为2.8%,这与先前的ExM方法相当,但PhotoExM具有更快的聚合动力学(PhotoExM的70秒与ExM的90分钟)。接下来通过量化4.6-6.7倍扩增前后的微管全宽(FWHM)来评估PhotoExM实现的分辨率提升。扩增前测量的微管直径为331±32纳米,4.6倍扩增后下降到90±8纳米,6.7倍扩增后为69±7纳米。后者与用一抗和二抗免疫标记的微管的测量直径(d)相当(d≈60-65纳米),证明了PhotoExM的超分辨率成像能力。接下来,用PhotoExM来观察肌肉组织切片。从6个月大的雄性小鼠身上分离出粗大的胫骨前肌纵向切片,固定后用α-肌动蛋白免疫标记,以观察肌纤维中的肉眼可见度。在不同的肌肉切片中,在×4.6扩展之前和之后对肌节进行成像,可以对组织样本内的扩展各向同性进行量化。在×4.6扩增前后,肉眼可观察到的平均距离分别为1.43±0.19和6.35±0.81μm(非标单位)。平均肌节长度之间的比率为4.44,对应的误差为3.0%,这在PhotoExM过程的3.5%误差范围内(×4.6扩展)。此外,PhotoExM还可以被用来揭示分离的肌纤维上的肌肉干细胞(Pax7)和肌纤维-ECM界面(dystrophin)的亚细胞结构,以及肌肉干细胞周围的ECM(层粘连蛋白)。
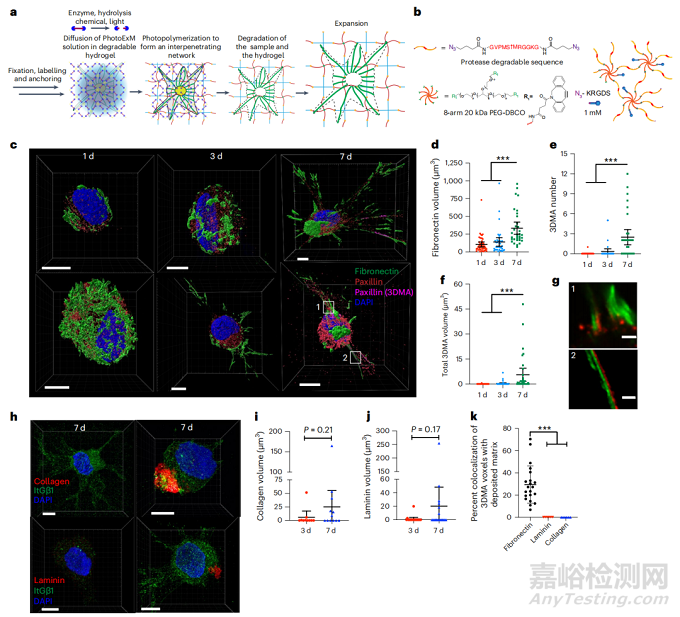
合成水凝胶可以被广泛地用作体内输送系统,以促进组织再生,并作为三维模型在体外研究疾病和发展。虽然三维微环境可以更好地再现细胞在体内的生态位,但对细胞进行高分辨率的分析和成像却更具挑战性。这些问题的出现不仅是因为超分辨率显微镜的穿透深度有限,而且还因为充满细胞的基质的光吸收和散射。为了解决其中的一些挑战,通过 PhotoExM技术中的消化步骤,使生物样本与略微不透明的细胞水凝胶基质平行降解,形成光学上透明的凝胶,随后在成像前进行扩展(GtG策略)。该策略依赖于将PhotoExM成分扩散到三维水凝胶中的能力与凝胶的按需光聚合解耦,从而暂时产生一个相互渗透的网络。使用这种基于PhotoExM的GtG方法,首次可视化了人类间充质干细胞(hMSCs)及其与新生沉积的ECM分子的相互作用。
小结:该文提供了一种用于膨胀显微镜技术的光聚合凝胶策略(PhotoExM),这种新型PhotoExM提供了一种简单而强大的补充方法,可以解决单体扩散、氧抑制和水凝胶膨胀后的脆弱性的问题,并能实现配方的预混合,有利于样品的制备。PhotoExM提供了一种精确监测三维微环境中核形状和染色质结构的方法,克服了迄今为止的研究受到分辨率的限制。更值得注意的是,由于ExM与RNA成像兼容,PhotoExM在未来有潜力实现准确描述三维微环境中转录状态的亚细胞和细胞异质性,推动该领域的发展。