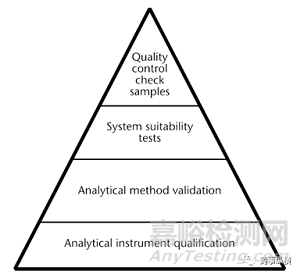
对于分析数据质量(可靠性、一致性)而言,分析方法验证是其最基本的组成要素。在USP 1058 Analytical Instrument Qualification分析数据质量因素质量三角形中分析方法验证是在分析仪器确认之上的第二层(图1),在分析方法验证之上的是系统适用性和质量控制样品的使用,分析方法验证的质量直接决定了分析数据的质量[1]。
图1 分析数据质量的组成要素
1、分析方法验证参数选择的一般原则
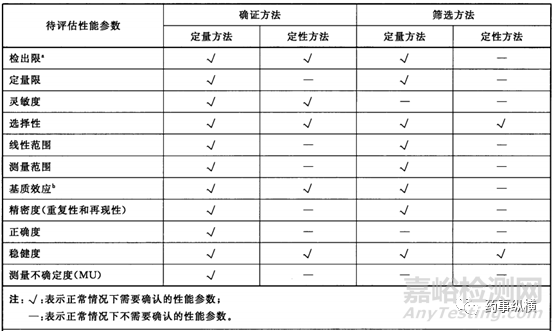
对于分析方法验证所需要进行的检测项目和验证指标,在ICH、FDA、NMPA的多种分析方法验证指南中均有明确的规定,如中国药典2020年版通则9101分析方法验证指导原则(第二次征求意见稿)中规定根据检验项目的不同,视具体情况拟订验证的指标,如专属性、准确度、精密度(包括重复性、中间精密度和重现性)、检测限、定量限、线性、范围和耐用性[2]。又如GBT27417-2017合格评定化学分析方法确认和验证指南规定的典型方法确认参数的选择如图2[3]。
图2 典型方法确认参数的选择
对于常规的分析方法验证来说,按照各项指南的规定直接进行各项指标即可。可以参照以下一般原则进行验证指标选择:
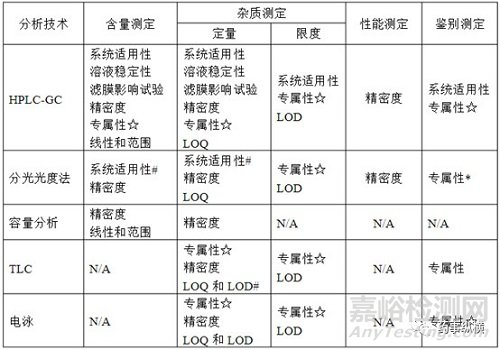
(1)对于药典方法或其他法定方法,通常只需要对系统适用性进行确认,并根据方法的复杂性选择对其核心指标进行确认。分析方法确认参考验证参数如图3。
图3 法定方法确认参数选择
注:
N/A表示不适用;
#根据实际需要选择;
☆专属性做选择性即可;
*若存在辅料的干扰选择。
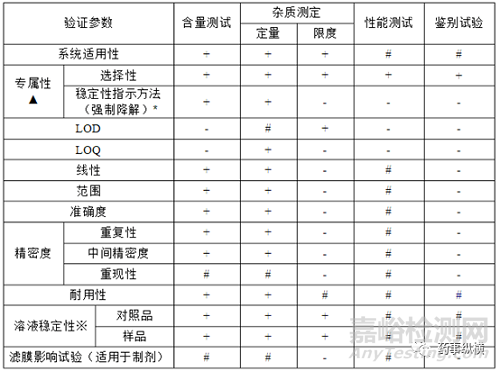
(2)对于首次进行的方法验证及确认,依据以法律法规的要求,需对各检测项目的核心参数进行确认,并对需变更检验方法进行适用性验证。分析方法验证参考验证参数如图4。
图4 法定方法确认参数选择
注:
-表示不适用;
+表示需体现在方法验证方案中;
#根据实际需要选择;
※溶液稳定性应至少包括在实际检测下的稳定性;
▲不能完全代表物质专属性的分析方法,应有其它分析方法补充;
*当分析方法用于稳定性样品检测时,专属性必须做稳定性指示特性;
仅有当方法转移到不同地点的其它实验室或收录在药典中时才需要进行重现性,若有重现性实验则可不做中间精密度。
滤膜影响试验:根据实际需求而定,对于定量分析中使用到的滤膜一般要求做。
2、分析方法验证的风险评估
自2005年由ICH提出以来,风险评估已经成为药品质量管理体系中的最基本原则之一[4]。对于分析方法和分析方法验证来说,风险评估一样是可以是适用的工具。在方法验证中利用有效的质量风险管理办法主动确定并控制潜在的验证质量风险,消除或者不断降低分析方法对于药品质量的影响。基于风险评估的分析方法验证验证指标选择和方案制定,将在规范性、合规性上具有明显优越性。
分析方法风险评估:对分析方法开展风险评估首先基于分析规程在使用周期中可能的变异,然后运用风险评估根据如FMEA工具进行风险评估。分析方法风险评估对于确定SOP的关键影响参数和其操作空间,豁免某些变更下的方法再验证具有重要的指导意义,并进一步为分析方法验证风险评估提供基础。
分析方法验证风险评估:对于分析方法验证的风险评估的价值主要还是在于取得“实验室符合性验证负担”和“法规合规性”之间的平衡,从而怎样使验证/确认的工作最小化。分析方法验证的风险评估大体可以分成以下步骤:
(1)成立分析方法验证风险评估小组;
(2)根据产品质量概况列出方法清单;
(3)判断方法在GMP系统中的重要性;
(4)基于经验、产品特性和分析方法的复杂程度进行风险评估;
(5)基于风险评估确定验证指标;
(6)分析方法验证的风险再评估[5,6]。
3、分析方法验证风险评估策略探讨
分析方法验证风险评估策略应基于分析的总体考虑。分析方法验证开展的前提必须是在对分析过程中可能的风险因素受到控制的前提下,确认方法验证方案的先决条件均已满足。包括检查方法验证/确认方案是否批准,检查验证活动参与人员培训结果,检查验证活动标准操作规程是否处于受控状态,检查验证活动相关仪器是否处于受控状态,检查验证活动样品试剂是否有效。方法验证及确认方案的先决条件均符合验证要求的前提下方可开展验证活动。大致来说,分析方法验证风险评估策略应基于以下风险因素:
(1)分析方法验证风险源:风险源包括首次生产、场地发生变更、生产工艺发生变更,或者分析方法虽为法定方法,但质控实验室初次使用,有可能对分析方法结果构成影响。
(2)人员经验和知识:在类似方法方面,检验人员是否有丰富的经验和良好的技术水平。若经验不足,则需要进行全面深入的验证;若经验丰富,则进行部分验证。
(3)产品和规格标准:在类似产品和类似产品规格标准上,《中华人民共和国药典》等法规是否收载有质量标准。若类似产品规格标准未被收载,则需要进行全面深入的验证,若类似产品规格标准已被收载,则进行部分验证。
(4)分析方法的复杂程度:分析方法是一个新的方法还是相对成熟的方法。若为新的方法,则需要进行全面深入的验证;若为成熟的方法,则进行部分验证。但对于复杂系统的分析方法(如高效液相色谱方法)仍需要尽可能进行全面的方法验证[7]。
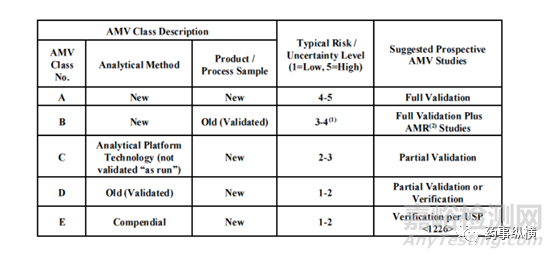
在分析方法验证风险评估策略中,一样可以通过风险评估分值来评价验证进行的程度。在图5中,对于分析方法验证(AMV)基于风险评估的验证考虑做了参考。一般而言,新的方法、新的产品通常采用完全验证,而平台方法、成熟方法通常只需要部分验证,法定方法则只需要进行方法确认。
图5 分析方法验证(AMV)基于风险评估的验证考虑参考
4、小结
分析方法验证是保证分析数据质量的基础条件,根据法规的规定可以得到分析方法验证参数选择的一般原则。分析方法验证风险评估能在验证/确认的工作最小化的基础上满足分析方法验证的合规性,可以考虑基于分析方法验证风险源识别、人员经验和知识、产品和规格标准、分析方法的复杂程度等评估策略基础上进行分析方法验证风险评估。
参考文献
1、USP 1058 Analytical Instrument Qualification
2、中国药典2020年版通则9101分析方法验证指导原则(第二次征求意见稿)
3、GBT 27417-2017合格评定化学分析方法确认和验证指南
4、ICH Q9 Quality Risk Management
5、方建茹, 基于风险评估的方法学验证2014.7.24.
6、方建茹, 基于生命周期的分析方法风险评估.
7、GBT16631-2008高效液相色谱法通则.2019.06.18