摘要
仿制药的上市许可基于“平均”生物等效性(ABE)的证明,暴露量(全血、血清或血浆药物浓度)几何平均值的比率(仿制药VS参比),90%置信区间(CI)的接受限度为0.8-1.25。然而,当在特定患者的治疗中考虑到仿制药和参比的互换性时,这种方法不能保证没有治疗影响,特别是对于治疗指数较窄的药物。本篇描述了ABE方法的基础和局限性,以及监管机构提出的调整。对于高度可变的药物,鉴于其较大的治疗范围,监管机构甚至允许扩大生物等效性的接受限度。对于治疗指数较窄的药物,监管机构对平均生物等效性方法进行了不同的修订。欧洲药品管理局只要求将ABE接受限值缩小至0.9-1.10范围。美国食品药品监督管理局(FDA)建议根据参比受试者内变异性缩小ABE的接受限值。FDA要求进行一项完全重复的交叉研究(四个周期),以便比较仿制药和参比之间的受试者内变异性,并检测受试者与制剂之间的相互作用。事实上,任何受试者内变异性的差异或受试者与制剂的相互作用,都是个体层面互换性的障碍。这些针对ABE的修正并没有从根本上改变这样一个事实,即个体暴露比率(仿制药/参比)的变化比平均值的比率更大。由于实际原因和统计问题,无法进行真正的个体生物等效性研究,可以这样建议,除了通常的平均生物等效性标准外,单个仿制药/参比制剂暴露比率的95%置信区间限制也可以用于治疗期间的互换性(至少对于治疗指数较窄的药物)。互换性接受的CI限值应按参比药物的治疗范围进行缩放。监管机构可以根据生物等效性研究的真实数据集进行计算,以确定这些标准是否可以接受允许互换性。
1、引言
“平均生物等效性”(ABE)方法已用于仿制药的上市许可多年。ABE是基于仿制药和相应参比之间的暴露量几何平均值(全血、血清或血浆药物浓度)比率的置信区间(CI)确定。然而,监管机构并没有在仿制药的不同上市许可文件中指出,在对某一特定患者的治疗过程中,用仿制药替代(互换或转换)与任何缺乏治疗效果有关。
本文回顾了平均生物等效性方法的基础和局限性,以及不同监管机构对受试者体内变异性大的药物和治疗指数窄的药物所采取的调整措施。我们建议,为了允许在个体水平上的互换性,可以研究一个额外的标准,特别是对于治疗指数较窄的药物。除了平均值比率的CI以外,还可以考虑个体暴露比率(仿制药/参比)的平均值CI。
关键点:
仿制药的上市许可需要基于平均生物等效性方法(ABE)的生物等效性证明。
这并不能保证在给定患者的治疗过程中,当参比药物转换为相应的仿制药时,不会产生治疗影响。
监管机构已建议对ABE进行调整,以适用于有较大受试者体内变异性的药物和治疗指数窄的药物。
对于这种治疗指数窄的药物,建议在仿制药与参比的个体暴露比的95%置信区间基础上,提出一个允许互换性的额外标准。
2、平均生物等效性方法
2.1、“平均生物等效性”方法原理
用于仿制药上市许可的生物等效性研究是基于一种多年来被不同监管机构接受的方法。它基于仿制药活性物质与相应参比药物活性物质的暴露方式(全血、血清或血浆药物浓度)的比较。我们将简化并考虑两种产品最常见的情况,即口服给药途径和使用血浆药物浓度暴露。研究的两个暴露参数是血浆浓度-时间曲线下的面积(AUC)和峰值血浆浓度(Cmax)。生物等效性确认的一般原则是,如果仿制药释放的活性物质的平均暴露量与参比药物的平均暴露量相差不超过20%,则认同为生物等效。使用这20%的标准是基于美国FDA的医学专家的决定,他们发现,对于大多数药物来说,血液中活性成分浓度的20%差异不会有临床意义。
这意味着可以假设平均20%的差异在个体水平上不影响治疗效果,或者活性物质在个体水平的效益/风险平衡。这一假设的药理学基础是,药理作用(和治疗效果)与任意活性物质的血液暴露动力学密切相关。事实上,药物的效果取决于药物作用部位的适当浓度,这个浓度是血液暴露量的函数,而血液暴露本身是物质吸收、分布、代谢、排泄的程度和速度的结果。
在ABE方法中,可以毫不费力的接受,在对某一特定病人开始新的治疗时,提议用相应的仿制药替代参比药物。一般来说,这种替代会从治疗的开始推断到治疗期间。然而,治疗期间的互换性(或转换),即在个体层面上没有任何治疗影响,不能由基于平均数的生物等效性证明来保证。
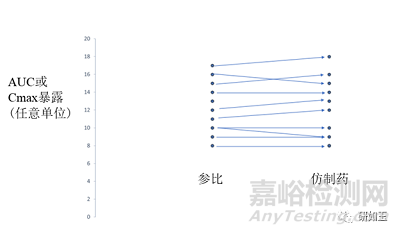
生物等效性研究通常在健康受试者身上进行,采用交叉设计,跨越两个连续的时期,一个是仿制药给药,一个是参比给药(图1),有两个给药序列。如果活性物质的清除半衰期持续数天或数周,则可以采用平行组设计进行生物等效性研究。根据美国FDA或欧洲药监局(EMA)的建议,通常是单剂量研究,根据药代动力学的线性或非线性特征,选择适当剂量。这种情况被认为是检测不同制剂之间差异的最敏感情况。仿制药的生物等效性研究只需要证明药代动力学参数的生物等效性,而不用像生物仿制药那样需要证明额外的药效学参数。
图1 生物等效性研究:在10名健康受试者中,参比药物和相应仿制药中活性物质的血浆暴露比较。研究设计通常是交叉进行,有两个暴露期(和两个序列)。仿制药和参比药物之间的平均差异必须在参比药物暴露量的±20%以内(见第2.1节)。连接仿制药和参比之间暴露值的线的斜率在受试者之间没有差异(没有受试者与制剂之间的相互作用,仿制药和参比的暴露在受试者内变异性也没有差异)。AUC血浆浓度-时间曲线下的面积,Cmax峰值血浆浓度。
如果仿制药和参比之间的暴露差异(AUC和Cmax)在-0.2×参比暴露量和+0.2×参比暴露量之间,则生物等效性成立,这也意味着仿制药/参比暴露量的比率必须在0.8和1.20之间(表1,图1)。
因此,必须对以下假设进行等效性检验:0.8<AUC仿制药/AUC参比和0.8<AUC参比/AUC仿制药;同样的检验可用于Cmax。当同时考虑这两个假设时,就会得出0.8<AUC仿制药/AUC参比<1.25(因为如果0.8<AUC参比/AUC仿制药,那么在数学上,AUC仿制药/AUC参比<1/0.8=1.25;这就解释了上限的1.25(而不是1.20),因为0.8是1.25的倒数。这就是Schuerman最早提出的用于证明生物等效性的所谓双单侧检验法。
根据监管机构所述的数学和统计学原因,仿制药和参比之间暴露平均值的比较以及置信区间的计算是基于对数转换后的暴露数据的方差分析(线性混合模型)。事实上,方差分析假设了一个加法模型,比较组之间的方差相等,以及正态分布的数据。数据的对数转换符合这些要求。在这种条件下,初始非对数转换数据的±20%区间(以0为中心)也可以变成以0为中心,因为0.8的对数值是-0.22,1.25的对数值等于+0.22。在对数尺度上,生物等效性的接受度遵循公式1:
ln(0.80)=-0.22<ln(仿制药AUC)的平均值- ln(参比AUC)的平均值<ln 1.25=0.22 (1)
根据FDA的要求,生物等效性必须使用暴露数据的几何平均值比率来证明。几何平均值比率的90%置信区间(CI)必须落在0.8~1.25范围内,总体α风险为5%(表1)。在对数尺度上的平均值与几何平均值的比率(在线性非对数尺度上)之间的差异确实存在数学上的联系:系列Xi对数值的算数平均值等于Xi几何平均值的对数值。
表1 平均生物等效性的接受区间,基于两种茶碱制剂在线性和对数尺度上数据平均值的差异和比率(改编自Rasheed和Siddiqui)
|
尺度
|
平均值的差异
|
平均值比率
|
|
线性
|
-0.20mr<(mg-mr)<0.20mp
|
0.80<(mg/mr)<1.20
|
|
对数尺度
|
-0.22314<(μg-μr)<0.22314
|
0.80<(μgeom g-μgeom r)<1.25
|
mr 参比药物(线性尺度)的算数平均值(AUC或Cmax),mg 仿制药(线性尺度)的算数平均值(AUC或Cmax);μr 参比药物(对数尺度)的算数平均值(AUC或Cmax),μg 仿制药(对数尺度)的算数平均值(AUC或Cmax);μgeom g 仿制药的几何平均值;μgeom r 为参比药物的几何平均值;AUC为血浆浓度-时间曲线下的面积;Cmax为药物峰浓度。
log 0.8=-0.223124,log 1.25=+0.22314。log 0.8和log 1.25之间的区间在0附近是对称的,而在1附近是不对称区间0.8-1.25。
几何平均值的比值是由对数值的算术平均值报告。事实上,系列Xi对数值的算数平均值等于Xi几何平均值的对数值。
因此,生物等效性的评估是基于所考虑参数的总体几何平均数(试验/参比)比率的90%置信区间。该方法相当于在5%显著水平下进行生物等效性零假设的两次单侧检验。
在双期双序列交叉设计的特殊情况下,当每个序列的个体数相同时(N/2),几何平均数比率的对数的90%置信区间的界限计算如下(公式2):
XT-XR±t1-α×SE 标准误差SE=S2 res(2/N)1/2 ………… (2)
S2 res是方查分析(以对数尺度进行分析)的残余方差,N是交叉设计种纳入的受试者数量,XT和XR分别是研究中观测到的试验药物和参比药物的几何平均数的对数。
然后,在ABE中,根据公式2和3,几何平均数比率(仿制药/参比)的90%置信区间限度与血浆暴露的残余方查(即受试者内变异性)的平方根成正比,与受试者人数的平方根成反比。
FDA公布了对1996年至2007年提交给监管机构的2070项ABE研究的统计分析:仿制药与参比之间的暴露量平均差异为Cmax4.3%,AUC3.5%。在这些研究中,98%的仿制药AUC与参比的差异平均不到10%。
2.2 平均生物等效性方法的局限性
2.2.1 受试者与制剂之间的相互作用以及仿制药与参比之间的受试者内变异性差异
在交叉设计的生物等效性研究中,每个受试者有两个暴露期(仿制药/参比),方差统计分析假设仿制药和参比之间的受试者内变异性方差相等,并且不考察受试者与制剂之间的任何相互作用。事实上,变异性的两个来源,即仿制药和参比之间的受试者内变异性方差以及受试者与制剂相互作用,都包含在交叉研究的方差分析的残余方差中。当设计中只包含两个暴露期,一个是仿制药,另一个是参照物质时,它们无法被区分或单独分析。
只有当交叉重复至少四个暴露期(至少两个仿制药和两个参比),才能单独分析仿制药与参比之间的受试者内变异性差异以及受试者与制剂相互作用。
受试者与制剂相互作用(图2)反映了一个结果,即在仿制药和参比之间,不同受试者的暴露量可能有所不同。它可能会增加或减少。这可能是某些受试者亚组临床特征的结果,这些临床特征对仿制药和参比之间活性物质的生物利用度有不同的影响。这在健康受试者中是相当理论化的,但在患者中是很有可能的。在这种情况下,如果仿制药和参比之间的受试者内变异性差异保持不变,那么在这种相互作用产生了治疗影响的情况下,必要时可以通过对受试者进行剂量适应性调整来解决这个问题。事实上,在重复给药期间,这种受试者与制剂相互作用应保持相同的幅度。
图2 生物等效性研究:受试者与制剂相互作用与六名受试者不同行为有关的图示(仿制药与参比之间的受试者内变异性没有差异)。十个暴露期的假设结果。,每个个体在前五个时期接受参比药物治疗,后五个时期接受仿制药治疗。为了演示的目的,参比药物和仿制药的受试者内变异性很小(即,给定受试者的暴露量不会因为参比或仿制药而发生重大变化)。受试者和制剂之间存在相互作用:当制剂发生变化时,受试者的暴露量会发生变化,而这些变化的幅度并不是所有患者都相同。AUC24h,从0到24小时的血浆浓度-时间曲线下的面积。
相反,仿制药和参比之间受试者内变异性的差异(图3)可能是仿制药和参比之间不同崩解和溶解过程的结果,这可能影响活性物质的生物利用度。事实上,这是产品的质量问题,取决于其辅料,而仿制药和参比之间辅料可能有所不同。这个问题导致了不同摄入量(在每日一次摄入量的情况下的日变异性)的活性物质利用率的受试者内变异性(仿制药和参比之间),例如哌甲酯。在对同一受试者的治疗过程中,这种现象会导致活性物质的生物利用度的升高或降低,如果变化幅度在特别敏感的患者中很重要,则可能对一些患者产生治疗影响。重要的是,这种现象的随机性使其无法通过剂量适应性进行任何的修正。
图3生物等效性研究:仿制药和参比之间受试者内变异性的图示。假设6个人在前五个时期接受参比药物治疗,在后五个时期接受仿制药治疗。为了演示的目的,参比制剂的受试者内变异性较小。相比之下,仿制药的受试者内变异性较高(即受试者的暴露量随仿制药制剂随机变化)。受试者与制剂之间没有相互作用,即对于每个受试者,两种制剂的平均暴露量(在一段时间内)保持相同。在经典的两期交叉试验中(第5期和第6期),图2和图3中的情况下暴露量相同。因此,这种两个周期的交叉试验不能通过制剂相互作用将受试者内变异性的差异区分开来。它们都包含在方差分析(ANOVA)的残差方差中。为了评估这种差异,至少需要在四个周期内重复交叉试验(两周期的参比和两周期的试验药物)。AUC24h,从0到24小时的血浆浓度-时间曲线下的面积。
一般来说,交叉重复的生物等效性研究表明,仿制药和参比之间的受试者内变异差异不大,与参比的受试者内变异相比,受试者与制剂之间的相互作用可以忽略不计。Concordet等人提出了受试者-制剂相互作用和受试者内变异性的差异,以此来解释用新的Levothyrox®制剂替代旧制剂后观察到的不良反应。
因此,假设受试者内变异性相同(仿制药和参比之间),又缺乏对常见的两期交叉设计的受试者与制剂相互作用的调查,使得ABE方法在开始治疗时的替代是可以接受的,但它代表了反对在个体水平上的治疗期间互换性保证的第一组论点,特别是当存在受试者内变异性的差异时,因为剂量适应性调整不能纠正这种差异,就像受试者与制剂相互作用一样。
2.2.2 与仿制药和参比之间血浆暴露量平均值附近的受试者之间分布有关的ABE的界限
ABE是基于仿制药和参比暴露量的几何平均值比率的90%CI区间。如第2.1段所述,CI值的宽度与纳入受试者人数的平方根成反比。因此,纳入受试者人数的增加会减少CI值的宽度。相反,仿制药/参比单个暴露量比率的分布要大于其平均值比率计算的CI。这符合样本分布和此类样本平均值标准误差之间的一般关系。
如图4所示,这是辅料对活性物质的生物利用度的影响在受试者之间产生生物学差异的结果。
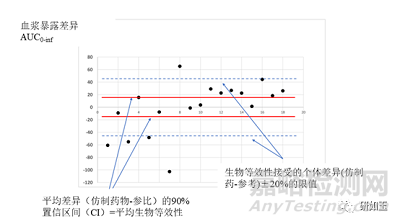
图4两种不同茶碱制剂之间暴露量(AUC)的个体差异(根据Rasheed和Siddiqui[10]报告的18名受试者的个体数据绘制)。平均生物等效性的界限是参比暴露量的±20%,此处为参比暴露量绝对值的±46.6(水平虚线)。18名受试者中有5名(28%)在该区间之外,尽管平均差异(试验药物-参比)的90%置信区间(CI)从-16.7至+15.6(水平连续线)证明了平均生物等效性;18名受试者中有12名(66%)在平均差异的90%置信区间(CI)之外。几何平均值比率的90%CI=0.925-1.085(在0.8-1.25范围内),点估计值=0.998。AUC0-inf,从0时到无限时间inf的血浆浓度-时间曲线下的面积。
因此,即使生物等效性可以用平均值的比率来证明,包括假设受试者内变异性没有差异,也没有任何受试者和制剂间相互作用,但在纳入的样本中受试者间的波动显示,对一些患者来说,仿制药和参比之间的暴露量差异会大于±20%,如图4所示。个体数据来自Rasheed和Siddiqui发表的关于两种茶碱制剂生物等效性研究的文献。证明ABE的均值比90%CI范围是0.92-1.8。然而,在纳入的18名受试者中,有5人(27%)的个人仿制药/参比暴露量的比率超出了这个范围。
这意味着ABE方法不能保证个体水平的互换性,因为仿制药和参比之间的暴露量差异可能大于可接受的±20%范围,与此同时,平均值的差异确实在这个区间内。
这种情况下,治疗效果取决于参比制剂的治疗范围。如果参比的治疗范围很大,并且远大于20%的差异,那么在治疗期间将仿制药与参比制剂交换,不会产生任何治疗影响。相反,如果治疗范围很窄,接近20%的接受范围极限,个体波动可能导致疗效和效益/风险平衡的治疗变化。
为了解决ABE的这些不同的局限,监管机构和科学家们探索了其他生物等效性方法和针对ABE的调整,我们将在下一段进行介绍。
3、监管机构讨论的解决ABE局限的方法
3.1个体生物等效性
在过去的20年里,统计学家和监管机构一直在争论是否可以为生物等效性制定一个除ABE以外的方法,以便在个人层面上实现仿制药和参比药物之间的互换。“个体”生物等效性方法的想法已经出现,但结果相当混乱。事实上,为了在个体水平上建立生物等效性,理论上应在同一受试者身上多次重复给予仿制药和参比药物。这样可以确定每个受试者的仿制药和参比的暴露量平均值以及仿制药和参比的受试者内变异性。我们可以直观地理解,如果在重复给药过程中观察到仿制药与参比暴露量之间的差异与不同参比给药之间(以及不同批次参比之间)的暴露量相同(甚至更低),则可以认为个体生物等效性。换句话说,正如Chen等人[13]所述,这种个体生物等效性方法的目的是比较每个个体的仿制药和参比的生物利用度差异(T-R)与参比制剂自身的生物利用度差异(R-R)。
这种在同一受试者身上重复给予仿制药和参比药物的个体生物等效性方法在实际中几乎不可能执行。他们还假设受试者的临床状态随着时间的推移完全保持稳定。这种个体生物等效性方法可能对患者更有价值,但在这种情况下,临床状态的稳定甚至比健康受试者更难获得。
对于此类个体生物等效性研究,也提出了统计学问题,涉及周期数、接受限度、检测能力等。
由于这两个原因,这类个体生物等效性研究尚未纳入常规实践。
3.2 监管机构对受试者内变异性较大的药物和治疗指数较窄的药物调整ABE的建议
3.2.1 受试者内变异性大的药物
有些药物所含的活性物质,在对某一患者重复给药(相同剂量)期间,其生物利用度(和血液暴露量)存在较大的受试者内变异性。一般来说,这类物质表现为水溶解度低,亲脂性低,生物利用度低,及肝脏首过效应。这些物质中的大多数属于国际BCS分类(生物药剂学分类)的第4类,低溶解性和低渗透性。
对于含有这种物质的药物,鉴于受试者体内变异性较大,很难证明其生物等效性,与仿制药的比较则更加困难。在这种情况下,生物等效性研究中所包含的受试者数量必须大大增加。
为解决受试者体内变异性大的药物的这一问题,减少纳入生物等效性研究的受试者数量,监管机构(如FDA和EMA)决定扩大生物等效性的接受限度,根据受试者内变异性进行调整。受试者内变异性是通过受试者内方差来衡量的,即交叉方差分析的残差方差。变异系数(CV)来自残差方差,其值接近于残差方差的平方根。EMA对CV>30%,FDA对CV>20%提出了调整BE限度的建议。这种方法被称为参比制剂校正平均生物等效性(RSABE)或扩展限度的平均生物等效性(ABEL)。FDA随后建议扩大CV>25%的药物的生物等效性接受限度,并将其应用于Cmax和AUC。EMA建议扩大CV>30%的药物的限度,但仅用于Cmax。实际上,Cmax被认为比AUC更容易受到变异性的影响。此外,EMA建议对CV>50%的药物,不再进一步扩大这些限度。
然而,这类受试者内变异性大的药物通常有很大的治疗范围,否则它们就无法使用或者不能获得上市许可。实际上,尽管血浆暴露量存在很大的波动(相同剂量连续两次给药之间超过20%),但其治疗效果仍保持在同一水平。由于这个原因,仿制药与参比制剂之间的互换性(已证明其平均生物等效性)并不令人担忧,因为在较大的活性物质血液暴露量范围内,疗效和效益/风险比保持不变(图5)。因为这些原因,扩展ABE的限值以允许互换性是可以接受的。
图5 同一受试者服用治疗范围比较大的参比制剂(实线)和仿制药(虚线)后,受试者内血浆暴露量的每日波动。即使仿制药和参比之间存在一些受试者内变异性,活性物质的暴露量仍在治疗范围内。在这种情况下,互换不会产生任何治疗影响。AUC24h,从0到24小时的血浆浓度-时间曲线下的面积。
3.2.2 治疗指数窄的药物
一些药物及相应的活性物质具有狭窄的治疗指数。然而,目前还没有国际公认的此类物质的清单或定义的共同标准。对于这类药物,不良反应可能发生在接近或略高于治疗剂量时,具有突然的剂量-效应关系,通常需要进行治疗药物监测,即确定每个患者的血浆药物浓度以进行剂量调整。这些药物包括某些抗癫痫药物、免疫抑制剂(他克莫司、环孢菌素、霉酚酸酯)、锂制剂、地高辛、维生素K拮抗剂抗凝血剂和左旋甲状腺素。
一般来说,治疗指数较窄的药物受试者内变异性较低(CV<30%)。如果不是这样的话就不能使用。事实上,如果在同一患者中,治疗指数窄的药物从一次给药到另一次给药的暴露量变化很大,那么诱发药物不良反应的概率或治疗失败的风险就很重要。
在大多数情况下,治疗指数窄的药物被用作慢性治疗,在此期间,一种参比药物可能被一种相应的仿制药所取代,对这些药物,提出了互换性的治疗影响问题(图6)。事实上,正是在这类药物中,已经报道了疗效的改变或效益/风险比的变化。抗癫痫药物和甲状腺素的情况尤其如此,其血浆暴露量±20%范围内的平均生物等效性的常规接受标准受到了挑战。
为了解决这个困难,监管机构提出了不同的策略来调整治疗指数窄的药物的平均生物等效性标准。EMA建议保持常见的两期交叉设计,并将几何平均值的仿制药/参比的90%CI的接受限度定为0.9-1.11,而不是通常的0.80-1.25。
图6 与图5中的情况相同,但活性物质的治疗指数较窄。同一受试者在试验药物和参比药物之间的平均暴露量非常相似。然而,仿制药(虚线)的受试者内变异性大于参比(实线),因此,在某些时候,仿制药的暴露量可能超出治疗范围。在这种情况下,试验药物/参比药物的互换性可能会对治疗产生影响。AUC24h,从0到24小时的血浆浓度-时间曲线下的面积。
FDA建议将平均生物等效性的接受限度降低到活性物质的受试者内变异性区间(RSABE),最大限度降低到0.9-1.1。此外,FDA要求通过完成完全复制的交叉设计(每个受试者四个周期,两个周期参比制剂,两个周期仿制药)来比较(F检验)仿制药和参比之间的受试者内变异性。FDA接受仿制药的受试者内变异性与参比之间没有显著性差异。该方法已针对华法林和左旋甲状腺素进行了详细介绍。复制交叉设计也可以检测受试者与制剂的相互作用(参见第2.2.1段)。然而,正如第2.2.1段所述,受试者与制剂的相互作用可以通过仿制药/参比转换后的个体剂量调整来解决。相比之下,如果仿制药的受试者内变异性高于参比,剂量调整将无法解决问题。这证明了FDA的立场,即要求对受试者内变异性进行比较,并拒绝受试者内变异性高于参比的仿制药。
3.2.3 治疗指数窄的药物互换性对治疗的影响
调整平均生物等效性的接受标准并不能解决个体水平上的互换性问题。事实上,正如前面在引言中提到的,监管机构并没有声称平均生物等效性允许互换性;他们只是回避了这个问题。
Van Lancker等人对加巴喷丁的研究很好地说明了这个问题。对于这种抗癫痫药物,在参比药物和相应仿制药之间切换后,已有关于治疗影响和不良反应的报告。然后,他们进行了一项符合FDA要求的生物等效性研究,采用完全重复的交叉设计,将参比药物与一种仿制药(Sandoz仿制药)进行比较。证实了平均生物等效性(几何平均值的比率包含在0.8-1.25区间内),更有趣的是,他们还证明了受试者内变异性(仿制药和参比之间)没有差异,也没有任何受试者-制剂相互作用。这项研究表明,即使在没有受试者内变异性差异或受试者与制剂之间的相互作用的情况下,更换制剂时,也可能会产生治疗影响(出现报告的不良反应)。
部分原因是个体暴露比率(仿制药/参比)的一个样本值的分布(95%置信区间)大于平均值比率的90%置信区间。如图4所示。在Van Lancker发表的图3中也说明了这一点,图中显示大多数的个体暴露比率(AUC)都在0.8-1.25的范围之外。在Concordet等人[12]的研究中,比较了左旋甲状腺素(l-甲状腺素)的新旧制剂,他们还发现(通过计算),对于50%以上的患者,甲状腺素(T4)暴露率的个体比值在缩小的0.9-1.11范围之外,说明平均生物等效性并不能保证个体水平的生物等效。两种左旋甲状腺素制剂之间如此大的个体暴露比率范围足以解释在两种制剂之间切换后报告的高不良反应率。
两种左甲状腺制剂之间的转换是在非常大规模(超过200万患者)和相当短的时间内(大约3-4个月)进行的,这解释了可以检测到这种药物警戒信号。这种仿制药/参比切换从未在如此大的规模和如此短的时间内执行。然后,在新旧制剂切换后,甲状腺状态出现治疗失衡的患者比例非常小,这代表了相当重要的绝对病例数,可以被药物警戒组织检测到。事实上,在超过200万名患者中,只有1.43%的患者报告了左旋甲状腺激素转换后的不良反应。
因此,有几个假设可以解释从一种参比药物转换为仿制药后出现的治疗影响和不良反应:两种制剂之间暴露比率的个体分布大于平均值比率,仿制药和参比之间所有受试者内变异性的差异,最后受试者与制剂的相互作用。就左旋甲状腺素的具体情况而言,由于使用新制剂后不良反应逐渐消失,因此受试者内变异性有差异的假设不太可能。然而,在左旋甲状腺素的生物等效性研究的两期交叉试验中,报告的CV值相对较大(23.7%),高于通常报告的左旋甲状腺素的CV值,与新制剂的CV值较大是一致的,接近受试者内变异性高的药物的30%界限。如前所述,这种情况不适合左旋甲状腺素等治疗指数窄的药物。Concordet等人假设的受试者与制剂间的相互作用仍然是一种可能的解释,但我们可以通过基于模拟的计算表明,在没有这种相互作用的情况下,也可以获得类似的生物等效性结果。左旋甲状腺素案例中的另一个重要因素是,最初批准的旧制剂的片剂甲状腺素含量较高(补偿由于氧化降解而导致的甲状腺素含量的逐渐下降),这在新制剂中不再允许。这种差异可能导致了血浆暴露量的差异,这些差异可能足以在非常敏感的患者中引起一些治疗影响,尽管事实上已经证明了平均生物等效性。在左旋甲状腺素这种情况下,防止这种治疗影响的最佳方案是告知患者可能发生这种情况,并可能通过剂量调整来解决。
在治疗指数窄的药物的仿制药/参比药物转换后报告出现治疗不平衡的情况下,考虑到平均生物等效性方法在互换性应用方面的局限,一些监管机构建议不要转换用这些治疗指数较低的药物治疗的患者。一些监管机构建议不要给使用这些治疗指数较窄的药物治疗的病人换药。一些 "不转换 "的药物清单已经制定出来,特别是包括一些抗癫痫药、一些免疫抑制剂和左旋甲状腺素。在用这些药物替代的情况下,如果治疗影响是受试者-制剂相互作用的结果,可以根据治疗反应进行适应性调整。如前所述,如果疗效不平衡是由受试者内变异性造成的,那么任何剂量调整都不能解决这个问题(参见第2.2.2段)。然而,监管机构建议对治疗指数较窄的药物“不转换”的立场,可能会使制药公司不愿意用仿制药的新配方来提高这种上市药物的质量。
4. 除ABE标准之外的互换性补充标准的建议
为了解决仿制药和参比制剂在个体水平上互换的可能性,我们建议监管机构在治疗指数较窄的药物的标准平均生物等效性接受标准中增加一些补充标准。此类标准应探讨仿制药和参比制剂之间暴露比率的个体值的分布。然后,除了平均值比率的CI外,还应考虑个体暴露比率(仿制药/参比)的平均值的CI。可以建议,AUC和Cmax的单个暴露比值的95%置信区间应在先验限值内,该先验限值可以根据参比的治疗范围设置和缩放。例如,根据生物等效性的一般药理学基础,95%CI的限值可以是±20%,而对于治疗指数较窄的药物,平均生物等效性所要求的90%CI是±10%。我们建议,监管机构应根据生物等效性研究的真实数据集(他们拥有或可能要求制药公司提供)进行计算和模拟,以检测此类建议的可行性。
5.结论
在接受基于常规的平均生物等效性方法(ABE)的仿制药上市授权后,当治疗范围远大于平均生物等效性的一般接受限度时,仿制药和参比制剂在治疗期间的个体水平的互换性不会影响疗效或效益/风险平衡。然而,对于治疗指数较窄的药物,当在个体层面上考虑仿制药/参比互换性时,ABE方法不能保证不产生治疗影响。由于这些原因,许多监管机构不建议对治疗指数较窄的药物进行仿制药/参比转换,除非可以根据治疗反应进行剂量调整。除了常规的ABE标准外,监管机构可以对治疗指数较窄的药物进行补充标准检测,以便在治疗期间实现仿制药/参比的互换。这种标准应基于仿制药和参比制剂之间的单个暴露比的95%CI限值,并按参比制剂的治疗范围进行缩放。