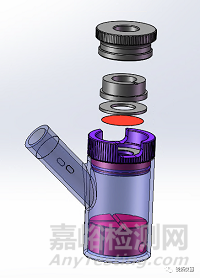
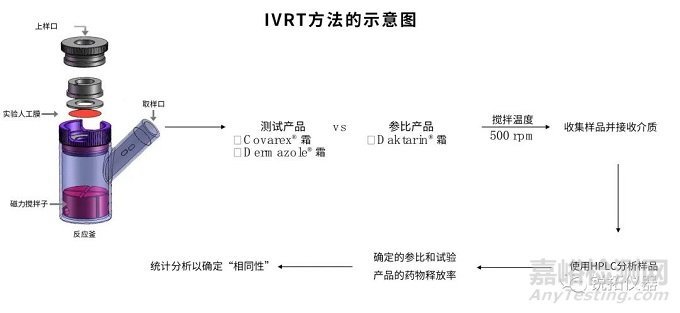
为了增进对该法规指南的直观操作体验,本文参考Potiwa Purazi等的《Assessment of “Sameness” and/or Differences between Marketed Creams Containing Miconazole Nitrate Using a Discriminatory in vitro Release Testing (IVRT) Method》的数据,并按照FDA的SUPAC-SS指南中的“相同性”验收标准对两种已上市的非专利产品进行了测试和评估,以此展示IVRT工具如何用于半固体制剂体外释放研究及其后续的处方筛选工作,提供一个模拟真实运用场景的操作实例给广大研究同仁参考。
1、研究中使用的物料与方法
1.1.物料
1.1.1.化学试剂与参考标准品
氢化可的松(HC)标准品
硝酸咪康唑(MCZ)标准品
硝酸益康唑(ECZ)标准品:内标物
已上市的氢化可的松霜Emo-Cort 1%:GlaxoSmithKline Inc,用于性能验证测试(PVT)。
参比制剂Daktarin®霜(2%):Janssen Pharmaceutica,用作参考产品,以开发和验证IVRT方法。三种含有1%、2%和4%MCZ的特制霜配方也用于确认IVRT方法的灵敏性、特异性和选择性。
经批准且已上市的仿制配方Dermazole®霜剂(2%):Sandoz公司,与参比制剂进行比较,以证明该方法用于评估“相同性”和/或检测差异。
经批准且已上市的仿制配方Covarex®霜剂:与参比制剂进行比较,以证明该方法用于评估“相同性”和/或检测差异。
1.1.2.HPLC 色谱法
使用液相色谱法进行测试样品的含量检测,用于分析PVT和IVRT样品的HPLC系统配备了Waters Alliance 2695型分离模块,该模块包括在线脱气模块、自动取样器和光电二极管阵列(PDA)检测器
Waters®Empower 3软件用于数据采集和处理。使用METTLER®AE 163型分析天平对参考标准品和霜进行称重。P100和P1000微量移液管用于转移和稀释标准溶液和样品溶液,液相色谱测试条件见下表:
表1 液相色谱测试条件
|
API名称
|
氢化可的松(HC)
|
硝酸咪康唑(MCZ)
|
|
色谱柱
|
Phenomenex Luna C18(2)5µm(150×4.6 mm)
|
Phenomenex Luna C18 5µm(150×4.6 mm)
|
|
流动相
|
水:乙腈(70:30 v/v)
|
乙酸铵缓冲液(0.005 m):乙腈(用0.1%磷酸调节)(25/75 v/v)
|
|
流速
|
1 mL/min
|
1 mL/min
|
|
检测波长
|
254 nm
|
226nm
|
|
内标液
|
N/A
|
ECZ
|
1.1.3.IVRT 测试系统
使用基于Franz扩散池原理的透皮系统进行方法开发,膜暴露表面积为1.767 cm²,供体室和受体室由选定的合成膜隔开。
1.2.方法
1.2.1.HPLC 方法验证
根据国际协调委员会(ICH)关于线性和范围、精密度、重复性、准确度、特异性以及确定的定量限(LOQ)和检测限(LOD)的指南,验证IVRT样品定量的HPLC方法。
1.2.2.测试设备的机械验证
作为机械验证的一部分,评估了VDC的容量和直径、接受介质的温度、搅拌速度、上样的样品体积以及VDC系统所处的环境条件。根据USP<1724>要求对VDC进行机械参数确认。
验证中需要计算单位面积采样时间释放量所需的每个VDC的孔的直径和容量分别通过测量长度和重量确定。使用重量法评估每个VDC的容量。用游标卡尺测量孔的直径确定膜暴露面积。
温度保持在32±1°C,以模拟皮肤温度并避免扩散系数的变化。在用纯化水填充VDC并平衡30分钟后,用经过校准的数字温度计测量六个VDC中的接收介质温度,确认温度达到预设要求。
使用激光转速表在500rpm下评估六个VDC之间的搅拌速度准确性与均匀性
所有物理参数测量3次。根据预定义的验收标准,计算平均值(x)和变异范围(V),以确定六个VDC的准确性和测试池之间变异性。机械验证的验收标准根据USP通用<1724>。
1.1.3.性能测试 (PVT)
使用1%氢化可的松(HC)进行PVT测试,测试条件如下:
表2 PVT测试条件
|
药物名
|
1%氢化可的松(HC)Emo-Cort®
|
|
上样量
|
300mg霜,伪无限剂量
|
|
接收液
|
乙醇:水(30/70 v/v)
|
|
膜预处理
|
将膜放在接收液中孵育30min
|
|
搅拌速度
|
500 rpm
|
|
温度
|
32±0.5°C
|
|
是否封闭上样
|
Yes
|
|
取样点
|
0.5、1、2、3、4和6小时
|
|
取样量
|
200 µL
|
|
取样方法
|
部分取样
|
1.2.4.硝酸咪康唑(MCZ)接收液研究
评估MCZ在pH 4.5接收液(50/50 v/v)(乙醇:0.05 M磷酸盐缓冲液)中的溶解度,一式三份。称量药物并放入空VDC中,加入接收液以获得饱和浓度。将MCZ溶液在32±0.5℃下搅拌6小时。然后停止搅拌,样品静置过夜。提取上清液的等分试样,过滤、稀释并分析,以确定溶解的MCZ的浓度。理想情况下,在整个IVRT过程中,药物在接受液中的溶解度应大于药物最大预期浓度的10倍。
1.2.5.膜筛选实验
使用各种合成膜进行膜筛选,例如Magna Nylon、Tuffryn,乙酸纤维素,纤维素酯和Strat-M。通过在32±1°C下,将每个单独的膜浸入含有250µg/mL MCZ的10mL测试溶液中,在pH 4.5接受液(50/50 v/v)(乙醇:0.05M磷酸盐缓冲液中,以一式两份的方式研究MCZ在各种膜上的结合。平行评估了一组无膜对照MCZ溶液。可能存在因为药物与膜的结合和/或其在接收液中的稳定性,为了确定MCZ含量的任何变化,使用上述HPLC方法测定所有测试溶液的浓度。此外,进行了IVRT试验,以比较两种膜(尼龙膜和Tuffryn膜)的释放情况。
1.2.6.硝酸咪康唑(MCZ)IVRT 方法设计
硝酸咪康唑(MCZ)设计的测试条件见表3:
表3 硝酸咪康唑(MCZ)IVRT方法设定
|
药物名
|
硝酸咪康唑(MCZ)
|
|
上样量
|
~300mg霜,伪无限剂量
|
|
接收液
|
磷酸盐缓冲液:乙醇(50:50 v/v),脱气后使用
|
|
膜预处理
|
将膜放在接受液中孵育30min
|
|
搅拌速度
|
500 rpm
|
|
温度
|
32±0.5°C
|
|
是否封闭上样
|
Yes
|
|
取样点
|
0.5、1、2、3、4、5和6小时
|
|
取样量
|
200 µL
|
|
取样方法
|
部分取样
|
智能真空脱气仪
1.2.7.释放速率计算
使用Higuchi模型,假设存在完美漏槽条件且在伪无限剂量下,使用方程(1)确定释放率。考虑到由于替换取样量而导致的接收液稀释,并使用方程(1)计算不同取样时间下接收液中MCZ的浓度(Cn)。
式子中,
Qn : 单位面积在时间(n)释放的量,单位为µg/cm²
Cn :不同取样时间下接收液中的药物浓度(n),单位:µg/cm3
Vs :样品体积(cm³)
Vc : 扩散池体积(cm²)
Ac :膜暴露面积(cm²)
释放速率则为Qn与时间平方根曲线的回归线斜率,参见USP< 1724>
1.2.8.IVRT方法验证
线性、精密度和重现性
使用参考产品Daktarin®霜(2%)进行了三次IVRT试验,在不同天测试(n=6),以确定线性、精密度和重现性。为了符合Higuchi模型的假设,单位面积的释放量应与时间的平方根呈线性关系。
通过使用方程(2),从获得的18个释放率中估算实验内和实验间的变异性来确定精密度和重现性
式子中, µ = 估计平均释放速率
σ1 : 实验间标准偏差
σ2 :实验中标准偏差
灵敏度、特异性和选择性
IVRT方法的灵敏度、特异性和选择性,在VDC(n=6)的三次IVRT试验中进行了评估,每个VDC使用含有1%、2%和4%MCZ的霜,这些霜是特别配制和临时制备的。通过测定释放速率随MCZ浓度的变化,验证IVRT方法的灵敏度,并通过评估释放速率与测试产品中MCZ浓度的比例来表征特异性。以释放速率为因变量,以MCZ浓度为预测变量的线性回归模型用于估计确定相关系数(R²)。
为了测试IVRT方法是否有选择性,以准确辨别产品性能差异,使用USP< 1724>章节中描述的统计方法,将含有2%MCZ的霜与具有较高和较低MCZ浓度的测试产品进行比较。此外,IVRT方法准确证明“相同性”的能力,通过Daktarin®霜(2%)与自身的两两比较进行测试。
耐用性
分别在30°C和34°C下评估了该方法在标称温度(即32°C)下对微小波动(±2°C)的耐用性。
剂量消耗
为了确保IVRT实验期间没有过量的剂量消耗,能够使用线性、精密度和重现性测试的结果,应计算产品的剂量消耗,确保为伪无限剂量,伪无限剂量以回收率Recovery表示,使用方程(3)计算回收率。
回收率Recovery=最后一个时间点接受液中MCZ的累积量/产品强度×施加剂量 (3)
1.2.9.评估含有2%MCZ的霜之间的“相似性”/差异
比较IVRT研究按照FDA的SUPAC-SS指南进行。测试产品,即两种经批准和上市的仿制配方,Dermazole®霜(2%)和Covarex®霜(2%),与参考产品Daktarin®霜(2%)进行了比较。根据SUPAC-SS指南,将VDC随机分配给测试(T)和参考(R)产品。将从R和T释放的药物的单个累积量与时间的平方根作图。使用非参数统计方法Mann-Whitney U检验来计算R和T之间斜率比率的90%置信区间(CI)。由于IVRT实验期间预计会出现一些异常值(例如,由于气泡形成),因此使用了能消除该影响的Mann-Whitney U检验。
1.2.10.IVRT方法应用
使用两种不同浓度(0.5%和1%)的MCZ霜,通过用含水霜稀释Daktarin®霜(2%)来研究IVRT方法检测制剂差异的能力。将这些稀释产品与市售Daktarin®霜(2%)产品进行比较。
2、实验结果
2.1.HPLC 方法验证
HPLC方法的验证参数符合ICH指南规定的预定义验收标准,HPLC方法验证的结果见表4:
表4 HPLC方法验证结果
|
项目
|
结果
|
|
测试浓度范围
|
5、10、20、40、60、80和100µg/mL
|
|
线性
|
R2 ≥0.999
|
|
准确度
|
CV<5%@20、100和180µg/mL
|
|
重复性(n=3)
|
CV<5%@30、50、70µg/mL
|
|
重现性
|
实验间和实验内精密度-CV<5%
|
|
LOQ and LOD
|
1和0.33µg/mL
|
|
样品稳定性
|
台面(24±1°C) ,HPLC样品托盘(21°C)和冰箱(4±1°C) 为期9天
|
|
特异性
|
< 5%.特异性-安慰剂提取物没有显示任何干扰峰
|
机械性能验证
VDC的机械性能符合USP 1724中对于机械性能的要求。
2.2.性能确认测试 (PVT)
PVT实验符合预定义的验收标准,结果如表5所示。所得数据证实了IVRT系统的适用性和重现性。
表5 PVT数据
|
参数
|
验收标准
|
结果
|
|
实验内可变性
|
首次实验的CV(n=6 VDC)<15%
|
3.01%
|
|
第二次实验的CV(n=6 VDC)<15%
|
11.90%
|
|
实验间可变性
|
两次实验的CV(n=12 VDC)<15%
|
8.87%
|
|
产品相同性判断
|
90%置信区间必须在75–133.33%的范围内
|
下限:88.41%
上限:113.37%
|
2.3.硝酸咪康唑(MCZ)接收液研究
在对缓冲液的不同pH和摩尔浓度进行初步实验后,选择了50%乙醇和50%0.05M磷酸盐缓冲液(pH 4.5)作为IVRT的接收液,因为MCZ在该组合物中高度可溶。MCZ在接受液中的溶解度为3671 µg/mL(±60.24),比方法验证实验期间获得的样品中的最高测量浓度(150µg/mL)高10倍以上,确保满足漏槽条件。
2.4.滤膜筛选实验
尼龙、醋酸纤维素和Tuffryn膜的平均回收率分别为98.40%、95.10%和98.45%,表明其与MCZ结合可忽略不计。因此,膜不太可能作为MCZ的限速屏障。相反,Strat- M和纤维素酯膜显示出低的MCZ回收率,不符合±10%的可接受范围。
实验6小时后,使用尼龙和Tuffryn膜对Daktarin霜(2%)中MCZ的体外释放进行比较,结果显示释放率分别为86.64 µg/cm²/min½和76.68µg/cm²/min½。综合考虑释放率、可用性和经济性,选择了成本较低的尼龙膜作为滤膜。
2.5.IVRT方法验证
线性、精密度和重现性
当R2>0.9时,确认线性。根据SUPAC-SS指南,使用线性回归计算3次试验(n=6)的18个释放率。所有释放速率均显示单位面积释放到接收液中的药物量(µg/cm2)与时间平方根之间的线性关系(R2>0.99)。
变异性参数等于σ1=36.14,σ2=27.56,µ=57.86µg/cm²/min½,导致实验间变异性的变异系数为10.39%,实验内变异系数为9.07%。CV<15%证实了可接受的精密度和重现性。
灵敏度
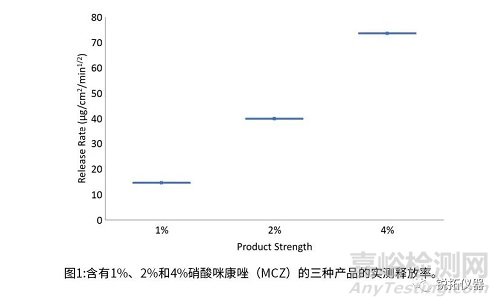
平均释放率随MCZ浓度的增加而增加:对于含有1%、2%和4%MCZ的霜,平均释放率分别为14.56µg/cm²/min½(±4.84)、39.92µg/cm²/min½(±6.00)和73.55µg/cm2/min ½(±3.78)。则认为该方法是灵敏的,因为含有1%MCZ的霜产生的平均释放率显著低于含有2%MCZ的霜,而含有4%MCZ的霜产生的平均释药率最高。
特异性
观察到MCZ浓度与释放速率之间的线性关系(R2=0.9935)(图1)。因为测试产品的平均释放率与MCZ浓度成比例增加,证实了IVRT方法的特异性。
选择性
2%MCZ霜与1%和4%MCZ霜的配对比较,表明改方法能够准确识别“不同”的产品,而参考产品与自身的比较则证实了“相同性”的确定(表6)。(下表改为表7)
表6 MCZ乳膏的配对比较
|
配对比较
|
90%置信限-下限
|
90%置信限-上限
|
结论
|
|
MCZ乳膏1%vs MCZ乳膏2%
|
25.25
|
51.65
|
不同
|
|
MCZ乳膏4%vs MCZ乳膏2%
|
165.43
|
210.76
|
不同
|
|
Daktarin®乳膏(2%)(试验1)vs Daktarin®乳膏(2%)(试验2)
|
83.39
|
104.20
|
相同
|
|
Daktarin®乳膏(2%)(试验1)vs Daktarin®乳膏(2%)(试验3)
|
88.88
|
112.88
|
相同
|
|
Daktarin®乳膏(2%)(试验2)vs Daktarin®乳膏(2%)(试验3)
|
93.29
|
122.03
|
相同
|
耐用性
使用不同温度(即30°C和34°C)进行IVRT试验的平均释放率分别为55.14µg/cm²/min½(±8.15)和72.53µg/cm²/min½(±9.00)。平均释放率与在标称温度(32°C)下进行的IVRT试验(即59.30µg/cm²/min½(±7.27))得出的平均释放率之间的偏差没有超过15%,因此,证实了开发的IVRT方法对实验过程中温度微小波动的耐用性。
剂量消耗
为测试线性度、精密度和重现性而进行的IVRT试验中观察到的回收率分别为<30%,即27.11%(±2.00)、28.20%(±2.41)和29.75%(±3.26),这表明在既定的实验条件下不可能出现任何剂量耗尽,满足伪无限剂量要求。
2.6.评估含有2%MCZ的霜之间的“相似性”/差异
图2和表7分别显示了参考产品Daktarin霜(2%)与两种经批准和上市的仿制制剂Dermazole®霜(2%)和Covarex®霜的释放曲线和成对比较。
表7 参考产品与仿制制剂的配对比较
|
配对比较
|
90%置信限-下限
|
90%置信限-上限
|
结论
|
|
Daktarin® 乳膏 (2%) vs Dermazole® 乳膏 (2%)
|
93.93
|
103.74
|
相同
|
|
Daktarin® 乳膏 (2%) vs Covarex ® 乳膏 (2%)
|
61.93
|
72.98
|
不同
|
|
Dermazole® 乳膏 (2%) vs Covarex® 乳膏(2%)
|
68.26
|
74.50
|
不同
|
|
Daktarin® 乳膏 (2%) vs Daktarin® 乳膏 (2%)
|
97.10
|
113.39
|
相同
|
与参考产品Daktarin霜(2%)相比,Dermazole®霜的90%置信限(2%)落在SUPAC-SS验收标准(75–133.33%)的范围内,确认了两种霜之间的“相同性”,而与参考产品Daktarin软膏(2%)以及Dermazole®霜相比,Covarex®霜完全超出了可接受范围,表明这些霜不具有药物等效性。
局部剂型性能标准的差异,可以通过考虑Q1、Q2和Q3来解释,Q1、Q2和Q3分别指定性和定量数值以及剂型微观结构。使用Covarex®霜观察到的药物释放曲线的差异可能是由于赋形剂的差异(Q1/Q2)。Covarex®霜含有咪唑烷基脲(0.2%)、尼泊金甲酯(0.15%)和尼泊金丙酯钠(0.15%),而Daktarin®和Dermazole®霜含有苯甲酸(0.2%)。辅料的这些差异可能会改变药物制剂的物理化学性质、皮肤渗透性、溶解度和热力学活性以及制剂的Q3属性。
由于制备方法的不同,检测配方差异的研究结果如图3所示
Daktarin®霜中MCZ的释放率(2%)明显高于1%和0.5%MCZ霜(图3)。这可能是由于Q3的差异,即与物质的微观结构和排列的差异,以及Q1/Q2的差异有关,图3所示的释放曲线表明,IVRT系统可以区分使用不同规格,不同制剂工艺的制剂。
3、结论
根据美国食品和药物管理局阿昔洛韦软膏和霜指南草案、SUPAC -SS非无菌半固体剂型指南和USP通用章节的建议,对已批准和上市的外用MCZ霜进行体外评价。一种仿制霜Dermazole®霜(2%)与参考产品Daktarin®霜(2%)表现出“相同”,而另一种仿制软膏Covarex®霜(%),其MCZ释放率不在75–133.33%的接受标准范围内,则认为不具有体外等效性。两种仿制霜之间的比较,表明它们在体外并不等同。
总之,开发良好的IVRT方法,能够准确区分不同规格产品的体外释放率,这可以反映产品性能的相似性和/或差异。此外,结果表明,IVRT方法还具有检测配方变化的能力,这可能是由于Q1/Q2/Q3不同所造成的。经验证的IVRT系统提供了证据,方法能够准确评估仿制的配方外用霜产品中MCZ的释放。结果证实了IVRT方法适用于以可靠和可重复的方式,测量局部皮肤霜中MCZ的释放率,并为将来使用此类产品获得生物豁免,提供了令人信服的数据。
参考原文:《Assessment of “Sameness” and/or Differences between Marketed Creams Containing Miconazole Nitrate Using a Discriminatory in vitro Release Testing (IVRT) Method》