近期,华南理工大学董华教授团队在科爱的期刊Bioactive Materials上发表研究论文:一种新型的载胰岛细胞的抗粘附核壳微凝胶和体内预血管化水凝胶支架组成的生物人工胰腺。该研究构建的生物人工胰腺结合了胰岛微封装和宏封装策略,维持了皮下移植后胰岛的长期活性和胰岛素分泌功能,实现了糖尿病小鼠长达90天的血糖调控。
研究内容简介
1型糖尿病(T1DM)是一种因天然胰腺中产生胰岛素的β细胞被破坏而引起的自身免疫性疾病。除了持续高血糖和内分泌系统紊乱外,1型糖尿病患者还经常伴有心肌梗死、视网膜病变、肾病、神经病变等多种并发症。虽然外源性胰岛素注射可以在一定程度上缓解这些症状,但仍然无法阻止终末期器官并发症的进一步恶化,致使许多患者在中青年时期就有很高的并发症发病率和死亡率。此外,1型糖尿病患者还存在所谓的“脆性T1DM”,即在短时间内具有不可预测的血糖振荡,如突发的高血糖,随后又严重低血糖。如治疗不当或不及时,随时都可能演变成惊厥、昏迷甚至死亡。
胰岛移植通过植入供者的胰岛细胞、多能干细胞分化的胰岛细胞或基因编辑的动物胰岛细胞来替代患者体内功能受损的胰岛,继而重建内源性胰岛素分泌,实现外源胰岛素独立,有望发展成为一种理想的1型糖尿病治疗方案。然而,严重的宿主免疫排斥反应以及缺乏血管网络而造成的氧气和营养物质供应不足往往会导致移植失败,限制了胰岛移植在临床上的广泛应用。
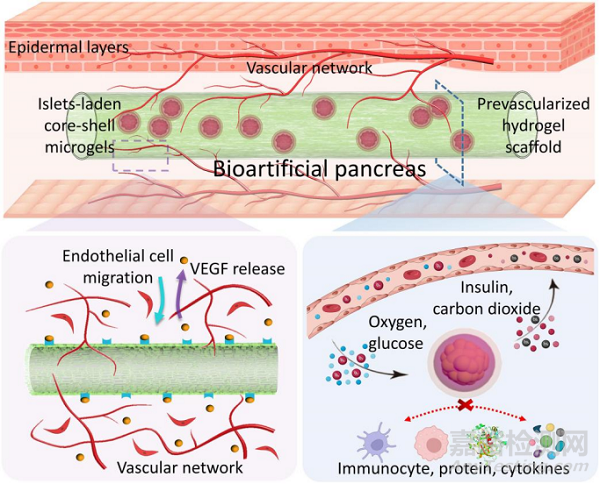
图1:皮下移植生物人工胰腺用于治疗1型糖尿病
本工作结合胰岛微封装和宏封装策略制备了一种新型的生物人工胰腺用于胰岛移植。其中,抗粘附的核壳微凝胶为胰岛细胞提供了类细胞外基质的微环境和免疫保护,而体内预血管化支架诱导的血管网络为胰岛提供氧气和营养供应。将预血管化的水凝胶支架和载胰岛的核壳微凝胶结合形成生物人工胰腺,移植到糖尿病小鼠皮下用于血糖调节(图1)。
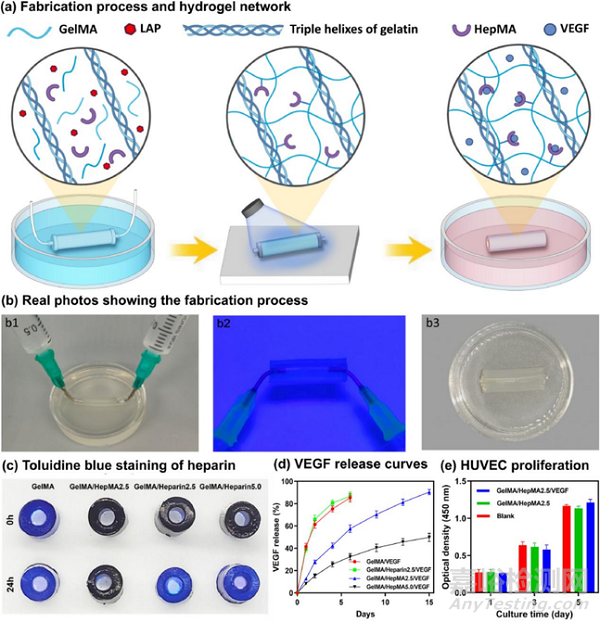
图2:GelMA/HepMA/VEGF水凝胶支架的制备和表征:(a)GelMA/HepMA/VEGF水凝胶支架的制备流程及水凝胶网络结构示意图;(b)制造过程中的实物照片;(c)水凝胶支架中肝素的甲苯胺蓝染色;(d)水凝胶支架中的VEGF释放行为;(e)内皮细胞在水凝胶表面的增殖。
皮下胰岛移植具有便于植入、监测和回收,移植位点多,手术风险低等优势,在临床上非常具有吸引力。然而,皮下血管密度低,氧气和营养物质供应不足,是皮下胰岛移植面临的最大难题。为解决这一难题,研究者们首先设计了一种水凝胶支架用于诱导皮下血管化(图2)。利用甲基丙烯酸酯化明胶(GelMA)的冷凝及与甲基丙烯酸酯化肝素(HepMA)的共价交联在生物医用硅胶管表面形成水凝胶涂层,而后利用HepMA与血管内皮生长因子(VEGF)的相互作用得到一种GelMA/HepMA/VEGF水凝胶支架。通过对水凝胶支架中的肝素进行甲苯胺蓝染色表明,与GelMA的共价偶联实现了HepMA在水凝胶网络中的固定。同时HepMA能与VEGF特异性结合,实现了VEGF从水凝胶支架中的缓释。将人脐静脉内皮细胞(HUVECs)接种到水凝胶表面培养发现,GelMA/HepMA/VEGF水凝胶支持HUVECs的粘附和增殖。
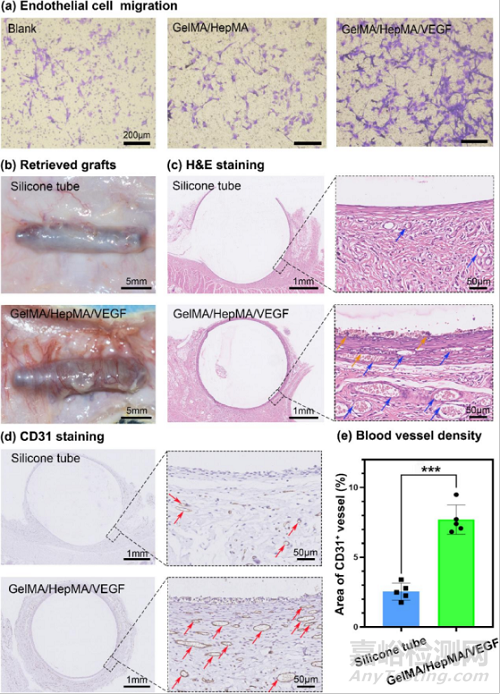
图3:GelMA/HepMA/VEGF水凝胶支架的体外和体内血管生成:(a)通过体外transwell迁移试验评估水凝胶支架对内皮细胞的募集能力;(b)皮下植入15天后的硅胶管和水凝胶支架的照片;(c)回收的硅胶管和水凝胶支架的H&E染色;(d)回收的硅胶管和水凝胶支架的CD31免疫组织化染色;(e)硅胶管和水凝胶支架皮下植入15天后诱导的血管密度。
采用transwell迁移试验评估了水凝胶支架对内皮细胞的募集能力,发现GelMA/HepMA/VEGF组的细胞迁移数量明显大于对照组,说明负载VEGF的水凝胶支架能显著促进HUVECs的迁移。将水凝胶支架移植到皮下15天后发现,支架仍然保持着良好的形状,在支架周围观察到了大量的新生血管。H&E和CD31染色结果进一步展示了GelMA/HepMA/VEGF水凝胶支架周围高密度的血管,说明水凝胶支架中缓释的VEGF可以招募内皮细胞形成血管网络,从而为后期移植的胰岛提供氧气和营养供应(图3)。
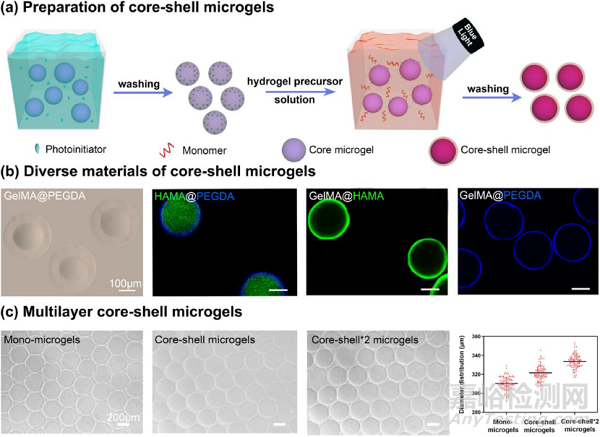
图4:核壳微凝胶的制备和表征:(a)利用单核微凝胶制备核壳微凝胶的示意图;(b)不同核壳材料制备的核壳微凝胶的明场和荧光图像;(c)多层核壳微凝胶图像及其粒径统计(从左至右:单核微凝胶、核壳微凝胶、双壳层微凝胶)。
接着,利用微流控技术制备了单核的微凝胶,并通过浸泡法负载光引发剂。而后将微凝胶转移到含有双键的水凝胶前体溶液中,引发剂从单核微凝胶向外扩散,光引发使水凝胶前体溶液在微凝胶表面聚合,实现功能性壳层的构建,最终得到了核壳结构的微凝胶(图4)。通过更换不同的核壳材料,以及构建不同壳层数量的核壳微凝胶,验证了该方法用于制备核壳微凝胶的可行性和普适性。
图5:核壳微凝胶的抗蛋白和细胞粘附性能:(a)荧光蛋白在不同块状水凝胶表面的吸附;(b)不同块状水凝胶的溶胀性能;(c)不同块状水凝胶的孔隙率;(d)荧光蛋白在微凝胶表面的粘附;(e)巨噬细胞在微凝胶表面的粘附。
移植物表面的非特异性蛋白和细胞吸附被认为是触发免疫排斥和异物反应的关键步骤,因此构建抗粘附的胰岛封装材料十分重要。通过构建抗粘附的微凝胶外壳,可以降低胰岛移植引起的免疫排斥反应,在无需抗免疫排斥药物的情况下实现免疫调节,从而延长胰岛在体内的存活和功能。在这里,我们制备了一种PEGDA/CBMA(缩写为P/C)两性离子水凝胶,发现两性离子能够降低水凝胶表面的蛋白吸附,且在CBMA含量为10 wt%时达到了最好的抗粘附效果(图5)。同时,对核壳微凝胶表面的蛋白和细胞粘附测试发现,蛋白和细胞在HAMA@P/C(10)微凝胶表面同样吸附很少,说明两性离子的水凝胶外壳赋予了微凝胶优异的抗吸附性能。
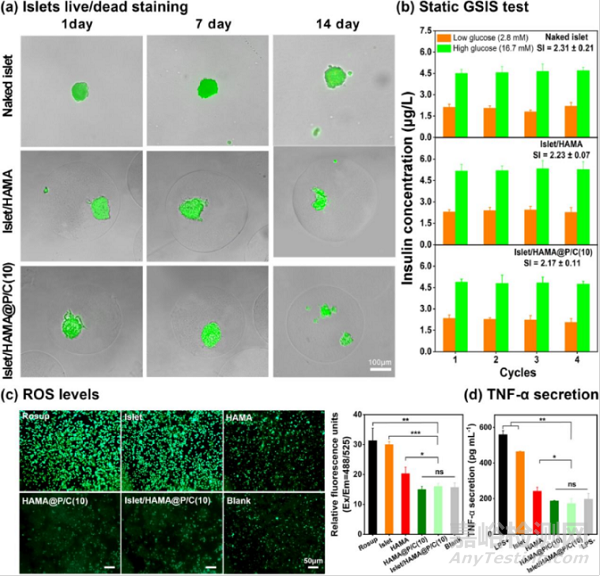
图6:负载胰岛细胞的HAMA@P/C(10)核壳微凝胶的体外生物学表征:(a)通过活/死染色测试胰岛细胞活性;(b)葡萄糖刺激的胰岛素分泌试验;(c,d)巨噬细胞与负载胰岛的HAMA@P/C(10)微凝胶共培养后产生的(c)ROS水平和(d)TNF-α水平。
通过活/死染色和葡萄糖的刺激胰岛素分泌(GSIS)试验评估了裸胰岛和微凝胶封装胰岛的体外活性和胰岛素分泌功能(图6)。活/死染色结果显示裸胰岛、单核微凝胶封装胰岛和核壳微凝胶封装胰岛的活性相当,均没有出现明显的细胞凋亡,表明微凝胶封装过程,包括微流控封装和表面壳层构建,对胰岛活性基本没有影响。另外,GSIS试验结果显示,裸胰岛和封装的胰岛都能对葡萄糖浓度的改变产生响应(胰岛素分泌量的改变),各组之间的刺激指数没有显著差异,表明胰岛素分泌功能同样不受封装过程的影响。将负载胰岛的HAMA@P/C(10)核壳微凝胶与巨噬细胞培养后,测试巨噬细胞表达的ROS水平及分泌的TNF-α含量,发现核壳微凝胶能显著降低胰岛细胞引起的炎症反应。因此,核壳微凝胶既能为胰岛提供类细胞外基质的微环境及免疫隔离,同时又降低了外源胰岛细胞引起的免疫排斥反应。
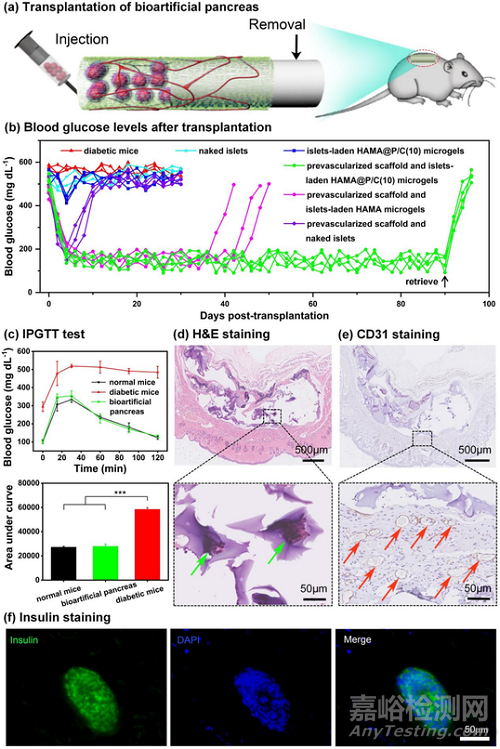
图7:将生物人工胰腺移植到STZ诱导的糖尿病小鼠皮下动物实验:(a)胰岛移植过程示意图;(b)移植后的小鼠血糖水平;(c)腹腔葡萄糖耐量试验(IPGTT);(d)移植90天后取回的生物人工胰腺的H&E染色,(e)CD31免疫组织化学染色和(f)胰岛素免疫荧光染色。
最后,通过腹腔注射链脲佐菌素(STZ)构建了1型糖尿病小鼠模型,同时将预血管化支架移植到小鼠皮下(图7)。15天后,取出硅胶管并将负载胰岛的HAMA@P/C(10)核壳微凝胶注射到支架的空腔中,构成生物人工胰腺用于糖尿病治疗。胰岛移植后,糖尿病小鼠的血糖水平快速降低,且维持正常血糖水平(<200 mg dL−1)长达90天。相反,直接皮下注射负载胰岛的HAMA@P/C(10)微凝胶只能引起血糖水平的小幅下跌,而后迅速反弹回原来的高血糖水平,说明了预血管化支架诱导的血管网络对维持胰岛活性和功能的重要作用。与生物人工胰腺组相比,将裸胰岛移植到预血管支架中可以实现短暂的血糖正常(1-3天),然后又恢复到高血糖状态,说明免疫系统的攻击导致了胰岛凋亡。为了证明这一假设,将载有胰岛的HAMA微凝胶也移植到预血管化支架中,可以发现更长时间的正常血糖水平(约36–42天)。显然,抗粘附核壳微凝胶可以实现最佳的免疫保护。而将裸胰岛直接移植到皮下后,由于同时缺乏血管网络和微凝胶的免疫保护,呈现出最差的糖尿病治疗效果。
对移植达到90天的生物人工胰腺进行回收,发现小鼠血糖迅速升高,进一步验证了生物人工胰腺在小鼠体内的长期血糖调节能力。同时,H&E和CD31染色结果再次表明,预血管化支架能在皮下诱导形成丰富的血管网络,且新生血管紧靠在移植物周围,从而高效地为移植的胰岛提供氧气和营养供应。更重要的是,微凝胶表面在90天后仍然保持清洁,没有明显的巨噬细胞沉积和纤维囊形成,说明核壳微凝胶体内优异的抗异物反应能力。此外,在胰岛素免疫荧光染色结果中观察到胰岛素阳性,表明生物人工胰腺中的胰岛在移植90天后仍保持正常的胰岛素分泌功能。
综上所述,我们开发了一种结合胰岛宏封装和微封装策略的生物人工胰腺用于胰岛移植。其中,预血管化支架能有效地促进血管生成,改善皮下血管缺乏的问题,为胰岛提供充足的氧气和营养供应。同时,类细胞外基质的微凝胶为胰岛提供了适宜的微环境,且两性离子的外壳赋予了微凝胶优异的抗粘附性,能明显降低外源性胰岛细胞引起的免疫炎症反应,为胰岛提供免疫保护。两者的结合增强了移植后胰岛的存活和功能,在1型糖尿病小鼠模型中实现了长达90天的血糖调节。我们相信这种生物人工胰腺为1型糖尿病的治疗提供了一种新的解决方案,相关制备策略也能应用于其他细胞疗法。
原文信息
Haofei Li, Yulian Shang, Qi Feng, Yang Liu, Junlin Chen, Hua Dong*.
A novel bioartificial pancreas fabricated via islets microencapsulation in anti-adhesive core-shell microgels and macroencapsulation in a hydrogel scaffold prevascularized in vivo.
Bioactive Materials, 27 (2023) 362-376.