一、定义与分类
手性是指具有三维结构的物体与其镜像平面一致,但无法完全重叠的性质,具有手性的化合物称为手性化合物,具有手性的药物称为手性药物。形成手性的原因最常见的是具有手性中心,此外也有手性轴、平面和螺旋等。本文所指的手性药物主要是指含有手性中心的药物。按照手性中心四个取代基团顺时针或逆时针,可以分为R或S构型。
二、手性化合物的药理活性
手性药物的立体构型与生物学活性息息相关,2个对映异构体可能具有相同的生物学活性;可能具有不同的生物活性,但有利于合并用药;可能一个具有活性,一个完全没有活性;可能一个具有活性,另一个只具有微弱活性;可能一个具有活性,另一个具有拮抗作用;还有可能一个具有活性,另一个具有明显毒副作用,20世纪著名的 “反应停”事件,就是由异构体毒性引起的,从这个事件开始,异构体的控制引起研发者的关注,逐渐成为手性药物杂质控制的关键点之一。1992年美国FDA发布关于开发立体异构体新药的政策,要求对手性药物进行毒理研究时,应分别对单一构型的异构体进行比较,以支持开发策略的制定。2006年我国发布了《手性药物质量控制研究技术指导原则》,为手性药物药学研究提供了一般性指导。
三、手性杂质研究一般思路
手性杂质是有关物质的一种,因此首先应遵守各项杂质研究指导原则,然后再针对手性药物的特点进行研究。本文探讨的内容主要包括手性杂质溯源——控制策略制定——分析方法选择。
在手性杂质研究过程中首先要对杂质进行溯源,根据工艺特点、样品批检验结果、稳定性研究结果进行综合判断,分析终产品何种可能存在哪些异构体杂质,产生的方式和原因是什么?产生的概率(风险)如何,科学合理的制定控制策略,既不要不加区分的全部同等控制,也不要控制的过于粗犷,给终产品安全性评价带来风险,这一工作需要多学科共同探讨完成。
3.1原料药制造过程
原料药中手性杂质产生的原因包括起始原料引入、不对称合成引入的手性中心、手性拆分剂以及在存储运输和使用过程中因接触光照、高温及不同pH溶液等环境发生手性翻转。对于不同原因所产生的手性杂质,应在药物合成的不同阶段进行控制,分为起始物料控制、过程控制和终产品控制。
3.1.1起始物料引入
起始物料引入手性中心时,终产品的光学纯度取决于两点:
(1)起始物料的光学纯度
相应的策略是采用立体专属性、灵敏度高的分析方法,严格控制起始物料的异构体含量。此外要对供应商进行严格筛选和约束,要对供应商进行详细和全面的质量审计,并要求其在工艺、路线发生并更时及时通知。
(2)后续反应及是否对手性中心有影响
如果没有影响,则在制备工艺中根据工艺优化和验证的结果严格控制工艺参数即可;如果有影响,但结果可控,除制备工艺中严格控制工艺参数,还要对产生构型变化步骤的中间体的立体异构体杂质进行严格控制;如果产生的影响不可控,那么可以考虑对工艺路线进行优化。
3.1.2过程引入
(1)不对称合成
不对称合成是引入手性中心的常用手段,终产品的光学纯度取决于反应的立体选择性和后续反应对手性中心的影响,采取的策略包括:充分了解不对称合成的反应机理、反应条件和立体选择性,尽量选择立体选择性高的反应;此外,对工艺条件进行优化筛选,并严格检测产物光学纯度。后续反应对手性中的影响可参考起始物料控制策略。
(2)消旋体拆分
消旋体拆分有两种方式,一是采用手性拆分剂与消旋混合物反应,生成非对应异构体,再去掉手性拆分剂,得到所需构型的手性化合物。此工艺中影响终产品光学纯度的因素包括手性拆分剂的光学纯度,非对映异构体的分离纯化效果、拆分和后续反应对构型的影响。采取的应对措施是选择高纯度手性拆分剂和尽可能充分纯化非对映异构体。另一种消旋体拆分是直接采用制备手性色谱柱分离对映异构体,制备目标化合物。
3.2制剂处方与工艺开发
制剂处方与工艺研究的重点是确保制剂过程中构型不发生改变,因此应重点考察会造成构型转换的因素,例如可以考察在不同物态的稳定性范围、不同pH的稳定性、以及对光照、高温、空气的稳定性情况
制剂研究的对象包括辅料和工艺。对于辅料应考察不同辅料对手性构型的影响(如不同pH对手性中心的影响);对于工艺应考察工艺条件对手性中心的影响如研磨、灭菌等。
在处方和工艺基本确定后可以开展适当稳定性研究,再次确认处方和工艺选择的正确性,同时也为控制策略制定提供依据。
四、分析方法选择
手性药物质量控制中反应立体特征的项目包括性状(比旋度)、鉴别、检查(异构体杂质)和含量测定,控制项目的取舍可统筹考虑。
通常比旋度可参照中国药典2020年版四部通则的要求进行研究,需对溶解溶剂、测定浓度、光源类型、检测波长等参数进行选择,使旋光度测定值处于适宜的水平,确保测定的准确性。通常比旋度控制光学纯度是不严谨的,还需配合其他立体专属性、灵敏度更强的方法(如高效液相色谱法、毛细管电泳法)共同控制终产品光学纯度。
手性杂质的检测一般多采用色谱方法,有直接法和间接法两类。直接法无需衍生化直接分离对映异构体,有手性色谱柱和手性流动相两种模式,其中手性流动相操作通常重现性差,使用较少,多数是采用手性色谱柱,现在手性色谱柱技术越来越成熟,市售手性柱有多种填料类型和规格,色谱柱性能和重现性都很好,可满足不同种类化合物的分离。间接分析法类似于消旋体的拆分,采用手性衍生化试剂与对映异构体反应生成非对映异构体,然后采用非手性柱分离,此方法操作繁琐,反应速率和反应回收率都对分析结果准确性和可重现性造成影响,推荐当其他方法无法达到分析目的时再采用。
五、案例
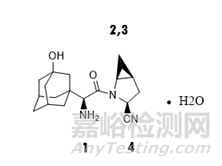
沙格列汀是一种选择性DPP-4抑制剂,用以治疗高血糖,是我国首个批准的具有单药和联合用药治疗2型糖尿病双适应症的DPP-4抑制剂。近年来有研究表明沙格列汀在改善血糖的同时可增强心功能,因此也可以用于冠心病合并糖尿病患者的治疗。沙格列汀降糖疗效明显,且不增加肥胖和低血糖风险,也不易诱发心血管并发症,毒副作用小,临床应用前景广阔。沙格列汀结构式见下图1。
图1 沙格列汀结构式
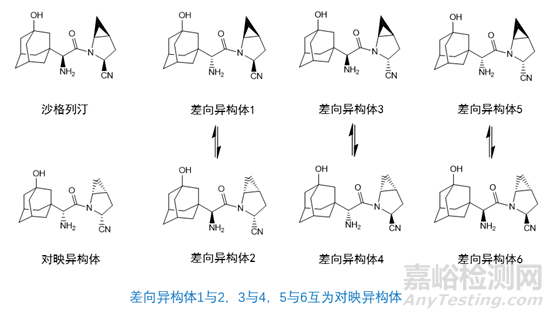
从结构式可知沙格列汀结构中含有4个手型中心,理论上可产生16个异构体,由于环丙基上的两个手性中心只能产生2种构象,因此实际上包括沙格列汀在内总共有8个异构体,见图2。
图 2 沙格列汀及其异构体
5.1杂质溯源与风险分析
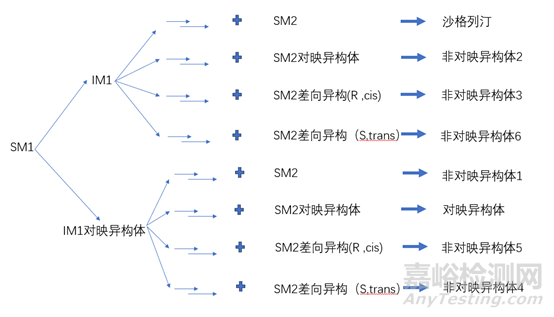
文献报道的沙格列汀合成路线有很多,本文参考原研公司发表的经改进的工艺路线对沙格列汀中异构体杂质的控制进行探讨,合成路线如下图3所示。从反应式可以看出,沙格列汀中一个手性中心来自于反应过程构建,三个手性中心由起始物料SM2引入,因此对于沙格列汀应采取起始物料控制、过程控制和终产品控制相结合的模式。
图3 沙格列汀合成路线
依据反应路线,终产品中异构体产生的途径见下图。
在所产生的异构体中,对映异构体的产生需要4个手性中心同时发生构型变化,产生的可能性较小;而不对称合成过程中容易产生对映异构体,对映异构体参与后续反应会生成相应的异构体杂质,也就是差向异构体1。
5.2 控制策略
5.2.1原料药控制策略
(1)起始物料的控制
基于起始物料SM2引入异构体杂质的风险分析,起始物料中异构体含量直接影响终产品中相应的异构体的含量,因此需对起始物料中异构体含量进行严格控制,并根据该杂质在后续反应中的清除因子和多批检测结果,拟定合理的限度。此外,应对供应商进行严格筛选和监督,确保批间差异的可控性。同时要考察后续反应对手性中心的影响,依据考察结果确定相应的控制策略。
(2)过程控制
由于手性中心1在不对称合成中容易产生对映异构体,因此要在中间体1中控制对映异构体的含量,并根据该杂质在后续反应中的清除因子和多批检测结果,拟定合理的限度,此外要对不对称合成工艺进行优化,对反应条件进行严格控制,同时还要考察后续反应对耐受性中心的影响,根据结果制定相应的控制策略。
(3)终产品异构体控制
终产品中可能存在的异构体有7个(1个对映异构体,6个差向异构体),在终产品中控制全部异构体对分析方法来说是个巨大的挑战,应根据杂质产生的环节分阶段控制。如果通过起始物料和过程控制,终产品中异构体杂质超标的风险已大大降低,那么对于产生概率低或实际样品不存在的异构体,在经过充分论证后可以在终产品中不再控制。如果在起始物料或过程控制中对异构体控制难度大,或者后续反应对手性中心有影响,那么考虑在终产品中对所有异构体杂质进行控制。
5.2.2制剂杂质控制策略
制剂处方和工艺对手性中心的影响已在前期有所研究,通常对手性中心不产生影响。制剂中异构体的控制应在原料药研究的基础上,依据制剂稳定性考察结果酌情制定。
5.3分析方法选择
在确定需要控制的异构体后,选择合适的方法进行检测,方法应重点关注专属性和灵敏度。
沙格列汀的异构体杂质主要采用高效液相色谱法控制,可采用手性色谱柱与普通反相高效液相相结合的方式分别控制对映异构体和差向异构体。由于沙格列汀的结构中缺乏共轭结构,因此检测波长设置应尽量低,可采用210 nm。
六、结束语
杂质控制策略的制定是对工艺特征和风险评估的综合判断,同时结合时间及经济成本考虑,因此不同研发机构制定的杂质控制策略会有不同之处,但不论怎样制定策略只要能讲清依据,说服审评老师都是可行的,以上只是我的个人的理解,不代表沙格列汀实际的杂质控制策略。
参考文献:
[1]手性药物指令控制研究技术指导原则
[2]黄晓龙美国FDA关于开发立体异构体新药的政策简介中国新药杂志,200,9(9)650-652
[3]黄晓龙浅谈再立体异构体新药的研究中需要注意的问题中国新药杂质,2001,10(1):65-67
[4] David J. Augeri, Discovery and Preclinical Profile of Saxagliptin (BMS-477118): A Highly Potent, Long-Acting, Orally Active Dipeptidyl Peptidase IV Inhibitor for the Treatment of Type 2 Diabete, J. Med. Chem. 2005, 48, 5025-5037.
[5] Jizhe Dong Synthesis and biological evaluation of all eight stereoisomers of DPP-IV inhibitor saxagliptin, Bioorganic & Medicinal Chemistry 22 (2014) 1383–1393.
[6] 董兴华,高效液相色谱法测定沙格列汀原料药中 3 种差向异构体的含量, 药物分析杂志, Anal 2021,41(6)