近日,国家药监局批准了《化妆品中他克莫司和吡美莫司的测定》化妆品补充检验方法,内容如下:
化妆品中他克莫司和吡美莫司的测定
(BJH 202301)
1、 范围
本方法规定了化妆品中他克莫司和吡美莫司的测定方法。
本方法适用于膏霜乳类、液体(水、油)类化妆品中他克莫司和吡美莫司的定性和定量测定。
2 方法提要
样品经甲醇超声提取后,采用高效液相色谱仪分离,质谱检测器检测。根据保留时间和特征离子对丰度比定性,待测组分相对应离子峰面积定量,以标准曲线法计算含量。
3、 试剂与材料
除另有规定外,本方法中所用试剂均为分析纯及以上规格,水为符合GB/T 6682规定的一级水。
3.1 甲醇,色谱纯。
3.2 乙酸铵,色谱纯。
3.3 乙酸,色谱纯。
3.4 含0.1%乙酸-5mmol/L乙酸铵的水溶液:准确称取0.3854g乙酸铵(3.2),加入1.0mL乙酸(3.3),用水溶解并稀释至1000mL,混匀。
3.5 含0.1%乙酸-5mmol/L乙酸铵的甲醇溶液:准确称取0.3854g乙酸铵(3.2),加入1.0mL乙酸(3.3),用甲醇(3.1)溶解并稀释至1000mL,混匀。
3.6 标准品:他克莫司、吡美莫司的标准品纯度均≥95.0%,标准品的中文名称、英文名称、CAS号、分子式、相对分子质量、结构式见附录A中的表A.1。
3.7 标准储备溶液:称取他克莫司、吡美莫司标准品各10mg(精确到0.00001g),分别置于10mL棕色容量瓶中,用甲醇(3.1)溶解并定容至刻度,混匀。制成标准储备溶液的质量浓度均为1000mg/L。置于-18℃冰箱中保存。
3.8 混合标准储备溶液:准确移取他克莫司、吡美莫司标准储备溶液(3.7)0.1mL置于10mL容量瓶中,用甲醇(3.1)稀释至刻度,摇匀。制成浓度为10mg/L的混合标准储备溶液。置于-18℃冰箱中保存。
4、 仪器与设备
4.1 高效液相色谱-三重四极杆质谱联用仪。
4.2 分析天平:感量0.0001g和0.00001g。
4.3 超声波清洗器。
4.4 涡旋混合仪。
4.5 高速离心机。
5、 试样制备与保存
样品应按照标签标示的贮存条件进行保存。取样前,应检查封口的完整性,观察样品的性状和特征,并使样品混匀。打开包装后,应尽可能快地取出所要测定部分进行分析,取样后,应将样品进行密封保存。
6、 分析步骤
6.1 筛查用混合标准溶液
取混合标准储备溶液(3.8)适量,用甲醇(3.1)进行稀释,配制成他克莫司、吡美莫司浓度为1.0μg/L的筛查用混合标准溶液。
6.2 空白基质提取液
称取空白试样0.2g(精确到0.0001g),置于10mL具塞比色管中,自“加入8mL甲醇”起与样品同法处理(6.5),作为空白基质提取液。
6.3 基质混合标准中间溶液
准确量取混合标准储备溶液(3.8)0.1mL置于10mL容量瓶中,用空白基质提取液(6.2)稀释至刻度,摇匀,制成他克莫司、吡美莫司浓度为100μg/L的基质混合标准中间溶液。
6.4 基质混合标准系列溶液
分别精密量取基质混合标准中间溶液(6.3)适量,用空白基质提取液(6.2)配制浓度为0.5、1.0、2.0、5.0、20、50μg/L的基质混合标准系列溶液。基质混合标准系列溶液应现用现配。
6.5 样品处理
称取混合均匀的试样约0.2g(精确至0.0001g)于10mL具塞比色管中,加入8mL甲醇(3.1),于涡旋混合仪上振荡30s至试样与提取溶剂混合均匀。超声提取15min,静置至室温,然后用甲醇(3.1)定容至刻度,摇匀,以4000 r/min离心5min,上清液经0.22 μm滤膜滤过,滤液作为供试品溶液备用(供试品溶液可根据实际浓度进行适当稀释)。
6.6 仪器参考条件
6.6.1 色谱条件
色谱柱:C18柱(2.1mm×100mm,1.7μm),或等效色谱柱;
流动相:A为含0.1%乙酸-5mmol/L乙酸铵的水溶液,B为含0.1%乙酸-5mmol/L乙酸铵的甲醇溶液。梯度洗脱程序见表1。
流速:0.3mL/min;
柱温:45℃;
进样量:2μL。
表1 梯度洗脱程序
|
时间(min) |
流动相A (%) |
流动相B (%) |
|
0 |
70 |
30 |
|
0.5 |
70 |
30 |
|
3 |
30 |
70 |
|
8 |
2 |
98 |
|
11 |
2 |
98 |
|
11.3 |
70 |
30 |
|
15 |
70 |
30 |
6.6.2 质谱条件
离子源:电喷雾离子源(ESI源);
监测模式:正离子多反应监测模式(MRM),监测离子对及相关参数设定见表2。
表2 他克莫司、吡美莫司监测离子对及相关参数设定
|
组分名称 |
母离子(m/z) |
子离子(m/z) |
CE(eV) |
|
他克莫司 |
821.6 |
768.6* |
20 |
|
576.4 |
27 |
|
吡美莫司 |
827.6 |
774.6* |
23 |
|
564.4 |
27 |
“*”为推荐的定量离子。
注:当采用不同质谱仪器时,仪器参数可能存在差异,测定前应将质谱参数优化到最佳。
6.7 定性判定
取供试品溶液(6.5)与筛查用混合标准溶液(6.1)在相同分析条件下测定,样品中如呈现定量离子对和定性离子对的色谱峰,被测成分的特征离子峰保留时间与筛查用混合标准溶液(6.1)对应的保留时间一致,且选择的监测离子对的相对丰度比与相当浓度的筛查用混合标准溶液(6.1)的监测离子对的相对丰度比的最大偏差不超过表 3 的规定,则可以判定样品中存在对应的组分。
表3 定性确证时相对离子丰度比的最大允许偏差
|
相对离子丰度(k) |
k>50% |
50%≥k>20% |
20%≥k>10% |
k≤10% |
|
允许最大偏差 |
±20% |
±25% |
±30% |
±50% |
6.8 定量测定
取基质混合标准系列溶液(6.4)依次测定,以待测组分的系列浓度为横坐标,待测组分的峰面积为纵坐标,进行线性回归,绘制基质标准曲线,其线性相关系数应大于0.99。
取供试品溶液(6.5)测定,将对应的定量离子对色谱峰面积代入基质标准曲线。按“7”项下公式,计算样品中待测组分的含量。
6.9 平行试验
按以上步骤,对同一样品进行平行实验测定。
6.10 空白试验
除不加试样外,均按上述测定条件和步骤进行。
7 结果计算
结果按式(1)计算:
式中:
ω―样品中他克莫司、吡美莫司的质量分数,mg/kg;
ρ―供试品溶液中他克莫司、吡美莫司的质量浓度,μg/L;
V―样品定容体积,mL;
m―样品取样量,g;
D―稀释倍数(如未稀释则为1)。
在相同条件下获得的两次独立测试结果的绝对差值不得超过算术平均值的10%。
8 精密度与准确度
多家实验室验证回收率为80%~120%,相对标准偏差小于10%(n=6)。
9 检出限和定量限
本方法中他克莫司、吡美莫司的检出限、定量下限及取样量为0.2g时的检出浓度、最低定量浓度见表4。
表4 他克莫司、吡美莫司的检出限、定量下限、检出浓度和最低定量浓度
|
组分名称 |
检出限 |
定量下限 |
检出浓度 |
最低定量浓度(mg/kg) |
|
(ng) |
(ng) |
(mg/kg) |
|
他克莫司 |
0.0004 |
0.001 |
0.01 |
0.025 |
|
吡美莫司 |
0.0004 |
0.001 |
0.01 |
0.025 |
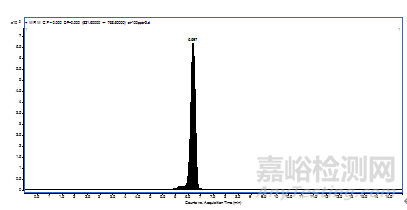
10、 图谱
图1 他克莫司标准溶液的多反应监测色谱图
图2 吡美莫司标准溶液的多反应监测色谱图
附录A
他克莫司、吡美莫司的相关信息
表A.1 他克莫司、吡美莫司的中文名称、英文名称、CAS号、分子式、
相对分子质量及结构式
|
中文名称 |
英文名称 |
CAS号 |
分子式 |
相对分子质量 |
结构式 |
|
他克莫司 |
Tacrolimus |
104987-11-3 |
C44H69NO12 |
804.02 |
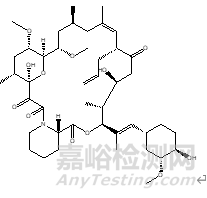 |
|
吡美莫司 |
Pimecrolimus |
137071-32-0 |
C43H68NO11Cl |
810.45 |
 |
起草单位:山东省食品药品检验研究院
主要起草人:李启艳、王维剑、牛水蛟、于海英
验证单位:中国食品药品检定研究院、上海市食品药品检验研究院、深圳市药品检验研究院