前 言
常常有药厂的制剂研发人员和我说:“我们希望自己在工作中,能够基于QbD理念进行冻干工艺开发。用科学的方法进行冻干工艺开发”
每次我听见大家这样说,都很开心,这和我的理念、目标一致;
但和所有其他学科一样,完成这样的大目标,具体的我们需要怎么做呢;
有哪些基础内容需要掌握,哪些实验数据需要补充;
就好比你去参加高考,那小学、初中、高中的课本知识是需要熟练掌握的;
冻干没有高考那么难,但完成这样的目标,也有一些必备的基本知识需要先行掌握;
有了这些基本知识,你可以做冻干,但不一定能够完成完整的“QbD理念冻干工艺开发”;
没有这些基础知识,你是无论如何也无法进行“QbD理念冻干工艺开发”;
知识空间要广泛且深入,在非常全面的知识空间下画出设计空间,在设计空间之内,设备精准的执行控制空间数据;
基 础 和 系 统 知 识
目标:干燥产品提供安全、稳定、有效的药物;
冻干过程需要确保最终产品满足关键质量指标:低含水量、较短的重建时间、效价的保持、无菌性等;
因为冻干是一个能耗大、耗时长的过程,从实践操作的角度来讲,我们需要有工艺优化的步骤,使得最终的工艺:时间短、重现性好、稳健;
开发目标是:获得一个在现有工业冻干机的控制精度条件下,在各参数边界内预留一定余量、可稳定重复且高效(短时)的冻干工艺;
过程:
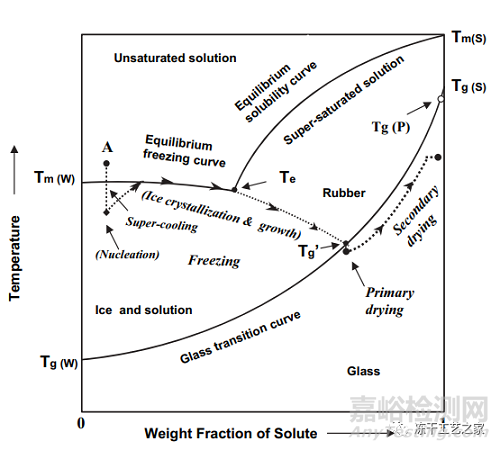
冻干工艺分由三个阶段组成:
溶液预冻:从流动态到不可流动态;
一次干燥:完成冰的升华;
二次干燥:去除未冻结水;
预冻步骤非常重要,他有可能对最终产品的稳定性、外观产生影响;
*预冻过程中部分成分结晶、低温浓缩、溶质迁移、冰界面效应、相分离、冷变性等问题。
同时,预冻步骤又影响后续一次干燥、二次干燥的效率和效果;
预冻降温过程中,溶液有过冷和相变热性能转变,如:共晶或浓缩溶液的玻璃态转变;
共晶转变(Teu)通常为浓缩溶液中晶体溶质的表现;
玻璃态转变温度Tg’、塌陷温度Tc通常为无定形溶质的表现;
部分干燥的样品(一次干燥阶段),对应塌陷温度Tc;
Tc为一次干燥过程中允许的最高产品温度(升华界面温度);
Tc温度以上,已干燥相拥有足够流动性(失去刚性结构)导致部分或完全塌陷;
通常情况,产品温度低于最大允许温度(Tc)2-3℃;
完全干燥后的样品,对应玻璃化转变温度Tg;
Tg和产品水分有关,产品水分越高,Tg越低;
存储过程中如果存储温度高于产品Tg,则产品出现塌陷,胶塞水分迁移常常导致这个现象;
二次干燥过程中,产品温度应在Tg以下;
预冻阶段的工艺参数必须准确设计(降温斜率和保持时间)以获得一致的冷冻矩阵结构;
实际工作中研发阶段和生产阶段的降温斜率不一致是导致产品温度变化的重要原因之一;
预冻阶段的成核温度影响冰晶尺寸大小;
低过冷温度(高过冷程度)会形成小冰晶,较大的比表面积、较高的阻力,从而一次干燥阶段阻力大时间长、同样二次干燥条件得到的产品水分更低;
预冻阶段加入退火步骤,可以减少冰晶的异质性,从而得到更短的一次干燥时间;
退火也可以使得结晶辅料(如:甘露醇、甘氨酸)更加彻底的结晶;
冻干的第二阶段是一次干燥或者说冰的升华阶段。
此步骤在一定的真空条件下(如:0.1-0.4mbar)和较低的板层温度(如:低于0℃)进行;
从冷冻基质中升华的水汽的路径:粉饼的升华界面---已干燥相---西林瓶顶空---冻干胶塞开口---冻干机腔体---中隔阀通道---在冷阱凝结为冰;
冷冻的冰从产品中升华出来,到达冷阱再次被冷凝;
冰的升华是一个需要大量能量的相变过程;
这个能量通过冻干机和环境提供:传导、对流、辐射;
冻干是一个传热和传质组合的过程,在这个过程中,两种传递必须小心平衡以使得传质(升华干燥速度)处于上风,从而避免因为热量积累过多导致样品塌陷或融化;
影响传热、传质的因素,见此系列后面的文章,会有专题进行讨论;
冻干的最后一个阶段是二次干燥;
二次干燥在产品稳定性能耐受的最高温度下进行(如20-45℃),腔体压力进一步降低;
此步骤通过解吸干燥的方式,去除未冻结的水分;
典型的冻干过程步骤:
将溶液用除菌过滤器进行过滤;
灌装溶液到西林瓶并半加塞;
将西林瓶用抽底托盘放入冻干机板层;
冷却板层,完成溶液预冻;
抽真空、加热板层进入一次干燥让冰升华;
进一步加热板层去除未冻结水;
干燥结束反填无菌空气或氮气;
压塞;
冻干机破真空;
下料;
用铝盖完成轧盖;
最后的话:
知识空间是需要广泛而深入的;
知识空间---设计空间---验证空间---控制空间;
以上内容的知识点非常浓缩;
基本上每句话,对应着一篇文献;
每个知识点如想深入研究,可检索文末相关文献;
本篇文章所有内容都是冻干中最最基础的内容,如果你想执行最终的QbD理念,每句话都务必彻底弄清楚,弄明白---知其然知其所以然。
参考文献:
[1] Al-Hussein A, Gieseler H (2012) The effect of mannitol crystallization in mannitol-sucrose systems on LDH stability during freeze-drying. J Pharm Sci 101:2534–2544
[2] Bhatnagar BS, Bogner RH, Pikal MJ (2007) Protein stability during freezing: separation of stresses and mechanisms of protein stabilization. Pharm Dev Technol 12:505–523
[3] Bhatnagar BS, Pikal MJ, Bogner RH (2008) Study of the individual contributions of ice formation and freeze-concentration on isothermal stability of lactate dehydrogenase during freezing. J Pharm Sci 97:798–814
[4] Cao W, Xie Y, Krishnan S, Lin H, Ricci M (2013) Influence of process conditions on the crystallization and transition of metastable mannitol forms in protein formulations during lyophilization. Pharm Res 30:131–139
[5] Chongprasert S, Knopp SA, Nail SL (2001) Characterization of frozen solutions of glycine. J Pharm Sci 90:1720–1728
[6] Gomez G, Pikal MJ, Rodriguez-Hornedo N (2001) Effect of initial buffer composition on pH changes during far-from-equilibrium freezing of sodium phosphate buffer solutions. Pharm Res 18:90–97
[7]Izutsu K, Aoyagi N, Kojima S (2005) Effect of polymer size and cosolutes on phase separation of poly(vinylpyrrolidone) (PVP) and dextran in frozen solutions. J Pharm Sci 94:709–717
[8]Li X, Nail SL (2005) Kinetics of glycine crystallization during freezing of sucrose/glycine excipient systems. J Pharm Sci 94:625–631
[9]Lu X, Pikal MJ (2004) Freeze-drying of mannitol-trehalose-sodium chloride-based formulations: the impact of annealing on dry layer resistance to mass transfer and cake structure. Pharm Dev Technol 9:85–95
[10]Padilla AM, Pikal MJ (2010) The study of phase separation in amorphous freeze-dried systems, part 2: Investigation of raman mapping as a tool for studying amorphous phase separation in freeze-dried protein formulations. J Pharm Sci 100:1467–1474
[11]Patel SM, Bhugra C, Pikal MJ (2009) Reduced pressure ice fog technique for controlled ice nucleation during freeze-drying. AAPS Pharm Sci Technol 10:1406–1411