一、引言
人用基因治疗制品通常由含有工程化基因构建体的载体或递送系统组成,其活性成分可为核酸(DNA和RNA)、基因改造的病毒、细菌或细胞,通过将外源基因(或基因编辑工具)导入靶细胞或组织,替代、补偿、沉默、修正、增加或敲除特定基因,以达到治疗疾病的目的。
自20世纪90年代以来,基因治疗领域的相关研究呈现持续上升的趋势,多款细胞治疗和基因治疗制品获批上市。以重组腺相关病毒(recombinantAdeno-Associated Virus,rAAV)载体的基因治疗制品为例,全球已有6款rAAV制品获批上市,包括Glybera(EMA,2012)、Luxtura(FDA,2017)、Zolgensma(FDA,2019)、Upstaza(EMA,2022)、Roctavian(EMA,2022)和Hemgenix(FDA,2022)。目前,国内也有多达22款rAAV制品获得临床许可,涉及治疗眼科疾病、血液系统疾病、神经系统疾病及感染性疾病等适应证。
基因治疗制品中使用的载体通常为重组改构载体,主要目的是降低临床安全风险,提升制品疗效。基因治疗制品有许多不同类型,大体分为3类:① 病毒载体类,如腺病毒、腺相关病毒、慢病毒、单纯疱疹病毒、逆转录病毒、痘病毒和仙台病毒等;② 核酸载体类,如质粒载体或基于染色体的载体( 如iBAC、S/MAR和转座子载体)及RNA等;③ 细菌载体类,如改良的乳球菌属、减毒李斯特氏菌属和链球菌属。总设计思路为降低毒性、增强安全性和提升治疗效果,具体包括:删减与毒力、致病性或复制能力相关的基因、靶向特定组织或细胞、插入细胞因子基因等增强治疗性效果的基因等。
另外,溶瘤病毒(Oncolytic Virus,OV)逐渐成为重要发展方向之一,2015年,FDA批准了1款溶瘤病毒制品(Imlygic)上市。作为一类经过基因改造的病毒制品(也可以是野生型),在技术监管层面与病毒载体类基因治疗制品相似,故合并讨论。
二、概况
基因治疗制品种类的多样性、特性复杂性和制造工艺复杂性都对生产和质量控制提出非常高的要求。基因治疗制品研发品种和开展临床试验品种逐年增加。
1、目的与适用范围
基因治疗制品因起始原材料差异大、制备工艺不成熟、生物学活性以及安全性等质量控制难点问题,限制了其自身的快速发展。因此,如何提高基因治疗制品的安全性、有效性、质量可控性是基因治疗制品研发单位面临的问题。
本概述目的是为基因治疗制品从业者科学、合理、合规地开展工艺开发,规范、有序地生产和严谨地质量控制提供指导性建议,主要针对产品申报上市阶段,为未来规模化和产业化打下基础。产品临床阶段可根据各阶段的研发特点和研究目的,参考本概述开展与阶段相适应的研究。同时,以易懂的方式为从业者提供必要的质量控制基本原则。
本概述适用范围主要为基因治疗制品,活性成分包括质粒载体、病毒载体和细菌载体等,其中以病毒载体为重点,如腺相关病毒载体、腺病毒载体、单纯疱疹病毒载体等,也可用于其他适用的病毒类生物制品。
2、撰写依据
本概述针对国内基因治疗制品行业的发展现状和技术水平,以尊重基因治疗制品特性为前提,结合2020年版《中华人民共和国药典》(以下简称《中国药典》)三部颁布的《人用基因治疗制品总论》《体内基因治疗产品药学研究与评价技术指导原则(试行)》和《溶瘤病毒产品药学研究与评价技术指导原则(试行)》等一系列基因治疗制品技术指导原则和法规要求,拟对基因治疗制品的质量控制提出建设性意见。参考的其他规范还包括《药品生产质量管理规范》(GMP)、《生物制品的生产和检定用动物细胞基质制备及质量控制》《药用辅料生产质量管理规范》《中国药典》通则,以及FDA、EMA和ICH有关章节等。
鉴于基因治疗制品的复杂多样性和相关质量控制研究的不断深入,本概述广泛地邀请了国内外相关行业专家补充完善相关内容,希望今后能不断更新和改版,从而形成更为科学合理的基因治疗制品的质量控制策略,完善药学评价的科学共识和质量控制的规范。
3、主要内容
基因治疗制品的生产和质量控制应基于质量源于设计(QbD)的科学理念,运用风险评估、全过程控制和全生命周期管理等手段,以保障基因治疗制品安全、有效的质量要求为目的,并通过对个生产环节的质量控制实现制品生产的稳定性和质量的一致性。
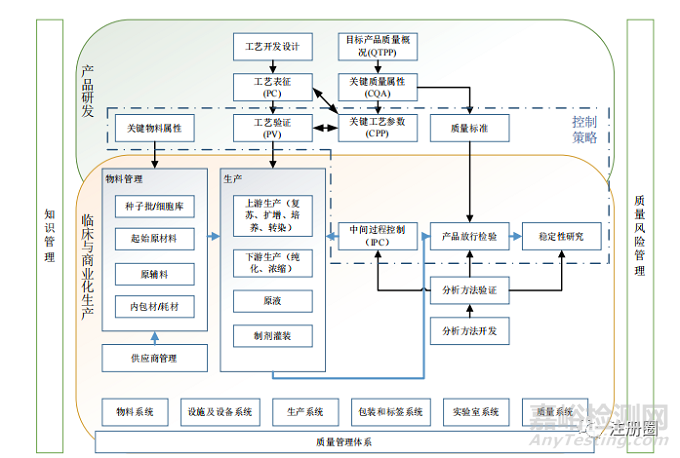
本概述按照基因治疗制品的生产工艺顺序,提出生产和质量研究需要注意的质量控制关键点和风险控制检查点,并提出制品质量评价研究需要开展的内容及所用方法,主要包括:①原辅料选择、质量控制和管理;②载体种子批制备、质量控制和管理;③生产用细胞基质制备、质量控制和管理;④生产条件保障、工艺过程控制和工艺验证中的质量研究;⑤制品放行检验项目质量控制研究;⑥制品稳定性的质量控制等。详见图1。
▲ 图1-基因治疗制品质量控制关键点和风险控制检查点
4、撰写原则
基因治疗制品质量控制需要遵循质量源于设计(QbD)的理念,运用风险评估的手段,结合实验设计(DoE)的工具,明确质量控制中关键质量属性(CQA),建立有效的质量控制体系,确保基因治疗制品的安全性和有效性,保证基因治疗制品的生产稳定性和质量一致性,尽最大可能降低制品的可变性,提高基因治疗制品质量的全生命周期管理水平。
三、基因治疗制品原辅料及质量控制
基因治疗制品的生产用物料是指生产过程中所使用的所有生物材料和化学材料。按功能分类,主要包括起始原材料、生产过程中使用或添加的原材料、辅料、包装材料和生产用耗材。起始原材料,一般是指生产中所涉及的生物原材料,常见的包括质粒DNA、细菌种子批、病毒种子批、产毒细胞株/库等,所有相关起始原材料均应进行充分的鉴定并建立明确的质量控制要求;生产过程中使用或添加的原材料,是指生产中所使用但不作为最终产品成分的物料,主要包括培养基及其添加成分、工具酶、缓冲液等;辅料,是指生物制品配方中所使用的辅助材料,如佐剂、稳定剂、赋形剂等;包装材料,是指药品包装所用的材料,包括与药品直接接触的包装材料和容器、印刷包装材料;生产用耗材,是指生物制品生产按批次使用的消耗品,常见的耗材如生物反应袋、储液袋、滤器、膜包等,也包括层析柱、灌装组件等。
基因治疗制品的生产用物料与基因治疗制品的质量、安全性和有效性密切相关,应选择符合其预期用途及可稳定供应的物料。应规范建立生产用物料的质量管理体系,基于风险进行质量控制,降低质量风险,保障产品质量。企业可参考《中国药典》的通则“生物制品生产用原材料及辅料质量控制”中的要求来制定物料的管理规则。
1、原材料、辅料、内包材和生产用耗材的质量控制
基因治疗制品的生产用物料作为制品工艺与质量实现的关键要素之一,其管理与质量控制应遵循相关法规的要求,相关行业指南也为此提供了指导意见。2010版GMP第六章“物料与产品”和第十章第七节“供应商的评估和批准”对物料以及物料供应商的管理提出基本要求。2020年版《中国药典》三部“生物制品生产用原材料及辅料质量控制”通则中对生产过程中使用的原材料和辅料质量控制提出了通用性要求。
生产用物料的质量控制活动主要在以下环节展开:基于产品关键质量属性以及工艺评估确定物料关键属性,筛选确定物料供应商,建立物料与供应商的分级分阶段管理策略,建立物料的企业内控质量标准与入厂控制策略,实施入厂后的验收、检验、放行、贮存、发放与使用、退库与销毁、物料变更等管理。
生产过程中使用或添加的原材料,其质量应符合其预期用途。原材料的选用应经过充分的工艺开发,其来源、组成、用途、用量和质量等情况应明确并合理,不必要的使用有可能增加残留的安全性风险和引入外源因子的风险。关键性原材料优先选用药品监管机构批准的产品或药用级别的原材料。应充分考虑来源于动物(或人)的原材料可能带来的外源因子污染的安全性风险,如有可能,应避免选用血清、猪胰蛋白酶等动物或人来源的原材料。应避免使用毒性较大的化学原材料。应对选用的原材料的生产地址、生产工艺、质量标准、货号等建立适当的管控要求,应评估审核其可传播性海绵体脑炎(TransmissibleSpongiform Encephalopathies and Bovine Spongiform Encephalopathy,TSE/BSE)风险、批次出厂检验报告等。应基于风险,对物料进行等级评估,评估的因素通常会考虑物料在产品原液、中间产品/半成品和最终制剂等生产制备过程中发挥的作用,物料在产品生产过程中的使用或加入步骤,该物料使用或加入后对原液、制剂或最终产品的影响,以及物料本身的稳定性等性质。对于积累了一定物料供应历史情况的企业,还应考虑物料供应商的上市许可、生产、质量控制与供应历史等因素,综合评估物料的风险等级。并以此为基础,结合产品研发或生产所处的不同阶段,制定恰当的质量控制策略,建立合理的企业内控质量标准与入厂控制策略,如处于产品临床前研究阶段和非关键临床阶段所使用的原材料和关键临床阶段及商业化生产阶段所使用的物料,可考虑采用不同的入厂检验控制策略。内控质量标准可参考相关药典标准,并兼顾物料的预期用途、对产品质量的影响、物料本身的质量风险等进行评估制订。
辅料的选择、用量和质量标准应基于制剂的处方开发研究确定,证明其使用的必要性、安全性和合理性。辅料质量应满足其预期功能。应优先选用药品监管机构批准的产品或经过注册备案的、符合药用标准的辅料。应对选用的辅料的注册或备案证明、生产地址、生产工艺、质量标准、货号等建立适当的管控要求,应评估审核其TSE/BSE风险、批次出厂检验报告等。由于辅料使用于制剂的生产中,通常被视为关键物料,其内控标准通常参照药典标准,对于早期临床试验用药品所用辅料可依据供应商的检验报告放行,但至少应当通过鉴别或对等方式,确保其正确无误。基因治疗药物一般为无菌制剂,其辅料的内控标准需要考虑微生物负载或无菌检查、内毒素等安全性。
内包材的质量应满足其预期功能。优先选用药品监管机构批准的产品或经过注册备案的、符合药用标准的内包材。应对选用的内包材的注册或备案证明、生产地址、生产工艺、质量标准、货号、批次出厂检验报告等建立适当的管控要求。由于内包材直接与产品接触,通常被视为关键物料。应基于风险,制定恰当的质量控制策略,如处于产品临床前研究阶段和非关键临床阶段所使用的关键包材,可依据供应商的检验报告放行,但至少应当通过鉴别或核对等方式,确保其正确无误。若采用无菌包装,还需目测检查外包装的完整性以及灭菌标识的符合性;进入关键临床阶段后,对可能引入污染的项目(如可见异物、微粒、微生物、细菌内毒素等)进行检查或控制,还应增加一些关键项目的检验。关键项目可基于物料的预期用途、对产品质量的影响、物料本的质量风险进行评估制订,具体可参照药包材国家标准或参考供应商提供的标准。
生产用耗材的使用,应考虑以下几方面的因素:一是耗材材质与工艺的匹配性控制,如温度、耐灭菌性等;二是耗材的动物源性风险,评估审核其TSE/BSE风险;三是耗材与产品接触面(直接接触的溶液、生产中间产物等)之间的相互作用,如化学相容性、生物相容性、吸附、浸出物、可提取物、对产品质量/稳定性的影响;四是耗材的功能/性能与工艺的匹配性控制,如滤器膜包的过滤效果、使用条件、一次性系统的组件与功能配置等。生产用耗材应满足其预期功能。应对选用的生产用耗材的生产地址、生产工艺、质量标准、货号等建立适当的管控要求,应评估审核其TSE/BSE风险、批次出厂检验或符合性报告等。应基于风险,对耗材进行等级评估,评估的因素通常会考虑耗材在产品原液、中间产品/半成品和最终制剂等生产制备过程中发挥的作用,在产品生产过程中的使用步骤,以及该耗材使用后对原液、制剂或最终产品的影响。同样,对于积累了一定物料供应数据的企业,还应考虑供应商的上市许可、生产、质量控制与供应历史等因素,综合评估耗材的风险等级。并以此为基础,结合产品所处的不同阶段,制定恰当的质量控制策略,建立合理的企业内控质量标准与入厂控制策略。
在早期的基础研究时,研究者对原材料及辅料的关注可能不足,但由于原材料和辅料对制品的质量及安全性均有重要影响,因此,一旦准备进入制品开发阶段,建议研发人员尽早开展原材料及辅料的评估及筛选并制定相应的内控质量标准,除了考虑原材料及辅料对工艺的适用性,还应考虑供应链的风险,而且在临床过程中要进一步开展相关的研究,在临床前应完成充分的质量评估工作,建立相对稳定的供给和保障体系。
辅助病毒或质粒是生产制备一些非复制型病毒载体的关键材料,其质量及属性直接影响制品的质量和属性,应根据应用作为起始原材料或者关键原材料来管理,进行更加充分的质量研究和质量控制。
辅助病毒的质量控制要求可参照2020年版《中国药典》三部“生物制品生产检定用菌毒种管理及质量控制”通则中病毒种子批的相关要求。对用于瞬时共转染生产过程的质粒载体,需对其来源、特性、分离纯化方法以及核酸序列等进行描述,对质粒载体的复制起始点、启动子以及编码选择性标记的基因等组成元件的来源和功能进行说明。质粒的生产应基于细菌种子批系统,并符合相关要求。应使用适宜的方法纯化质粒,并基于风险分析和制品特性建立质粒载体的质量标准,通常检测项目包括:鉴别(如限制性酶切图谱和Sanger测序等)、质粒含量、质粒纯度、宿主细胞DNA残留量、质粒超螺旋比例或其他可映转染效率的检测项目、细菌内毒素检查和无菌检查或微生物限度检查(若有必要,可增加宿主细胞RNA残留量、宿主细胞蛋白质残留量)等,检测结果符合要求后才能用于载体的生产。
质粒载体(或质粒DNA)是重要的起始原材料或者关键原材料,建议纳入质量管理体系进行管理,如建立相应的主种子批和工作种子批,按照GMP相关要求生产,建立质量标准并检验,质粒的保存和稳定性研究可参照生物制品的有关规定和指导原则开展。
3、原材料及辅料的选择和风险控制
原材料及辅料的选择应基于风险评估的原则,通过风险评估从而建立与之相应的风险控制策略,优先选择安全级别高的原辅料:药用级优先于非药用级、优先选择非动物源性物料,至少需要无TSE/BSE风险申明材料等。通常会有以下几种考虑:优先选择已获得上市许可的生物制品或药品无菌制剂;其次,可以选择已有国家药品标准、取得国家药品批准文号并按照中国现行GMP生产的化学原料药和药用级非动物来源的蛋白水解酶等;再次,可以选择按照国家备案管理的非动物源性药用辅料等。
若采用自行研制的原材料,例如某种特殊要求的重组蛋白,不仅需要建立质量标准,还需要有制备工艺及其工艺验证等数据支持,有的高风险原材料甚至可能还会需要开展动物体内的安全性评估。此外,这类原材料的检测要求需要根据其使用方式、下游工艺的清除验证数据以及潜在风险来确定。对于研究级别的生物源性的原材料,不仅要设置它们的安全性质控项目,如无菌、内毒素、支原体、分枝杆菌(如适用)及外源病毒污染检查等,还要考虑它们的纯度、效价或对细胞活化、增殖的生物学效力的质控项目。动物源性材料的质量控制,如牛血清,应结合物料使用需求及风险评估,参考《中国药典》新生牛血清通则或其他已有的国家标准进行原材料质量控制及放行。
根据对每一种原材料风险评估的结果建立相应的质量检测项目、检测方法及放行标准,并在制品研发过程中不断分析关键原材料质量对制品质量的影响,并不断改进关键原材料的质量要求。
4、AAV载体制备中的关键原材料和辅料
AAV载体制备中的关键原材料及辅料包括培养基、培养基添加物、血清、生长因子、细胞因子、蛋白酶、转染试剂、核酸酶、亲和纯化用配基、密度梯度介质和去垢剂等,特别强调质粒、病毒种子批和细胞基质也应归属于关键原材料。而生物材料的批间差异显著且难以标准化增加了引入外源性因子的风险,进而影响生产工艺的重现性或最终产品的质量,因此,建议尽可能地使用非动物来源材料,如无血清培养基和重组酶等。
鉴于物料对AAV病毒载体生产的重要性,生产企业须提供生产过程中使用的所有物料清单以及相应物料的质量或等级描述,包括物料以及试剂的供应商、来源、质量及各物料在工艺中的使用阶段(发酵和纯化)等基本信息。与产品接触的关键耗材和设备如发酵罐、培养袋、培养瓶、色谱基质和一次性管道等资料也需要提交。同时,生产企业应建立确认计划,并提供文件证明用于生产的材料符合其预期用途的标准(包括物料评估报告、检验报告书等)。
5、基因治疗制品中原材料残留的质量控制
对于风险级别较低的原材料,可评估制备工艺对其去除的能力。对于风险高的原材料除了评估去除能力外,若需要,可在最适工艺阶段或终产品中进行残留量检测的控制并建立控制标准,作为工艺相关杂质的一部分进行控制,如细胞因子、生长因子、蛋白酶(如重组胰蛋白酶)、核酸酶、转染试剂(如PEI)、血清及相关溶剂等。
6、制剂配方中辅料的质量控制
制剂配方中辅料是成品中除主药外的其他添加物。在基因治疗制品中,辅料一般为人血清白蛋白、甘露醇、蔗糖、Tween-20、泊洛沙姆等。根据ICH相关规定,制剂配方中辅料若机理明确,作用清楚,不与主药发生配伍反应及其他副作用风险,可不予检验;若使用的制剂配方中辅料成分针对该临床应用途径尚未有明确安全性使用评估结论或存在其他毒性作用的风险,则要将其列入质量标准,规定其标准范围,加以控制。
7、病毒载体制备过程中牛血清风险的控制
目前,病毒载体制备中仍多采用含血清工艺,应降低牛血清的风险。一方面,在使用前参照《中国药典》新生牛血清通则的质量要求进行牛血清的检测,在病毒载体的质量控制中进行牛血清白蛋白残留量的检测,在最适工艺阶段(如未处理收获液)增加外源病毒因子和特定牛源病毒因子的检测控制;另一方面,鼓励开展病毒载体的低血清以及无血清生产工艺的研究,如在病毒包装阶段采用低血清培养或无动物源性培养液替代牛血清的工艺研究,也鼓励基于化学合成的培养基生产工艺开发研究。此外,在供应商审计方面,应建立长效机制,监控牛血清产区的疫情等。
四、病毒载体及质粒载体的制备及质量控制
载体是基因治疗制品的重要组成部分,是其所携带的基因能否发挥生物学效应的重要依托。病毒载体结构比较复杂,至少包括核酸和衣壳蛋白,有些还包括囊膜等。如何实现低风险的稳定生产,是每一个从业者关心的问题。以病毒为载体的基因治疗制品的生产工艺种类较多,并且涉及内容复杂,病毒种子批管理是在基因治疗制品起始原材料管理中的重要质控点,是进行低风险、稳定生产的关键措施之一。对于质粒载体应考虑抗生素抗性基因可能给病人带来的风险和危害,且不得使用氨苄西林抗性基因。
1、基因治疗制品常用的病毒载体
对于以基因修正为主要目的的病毒载体主要是腺相关病毒(AAV)和慢病毒(LV)。野生型AAV具有免疫原性弱、几乎无致病性、感染范围广、基因组小、物理性质稳定等多种特性,是作为基因治疗的理想载体;慢病毒具有免疫原性低,包装容量大、表达稳定等特点。
对于以杀伤肿瘤为目的的可复制性病毒载体,目前在临床研究中已经采用的病毒载体类型主要有单纯疱疹病毒(HSV)、腺病毒(AdV)、痘苗病毒(VV)、麻疹病毒(MV)、呼肠孤病毒(RV)、水泡性口炎病毒(VSV)以及新城疫病毒(NDV)等。
2、病毒载体在设计与构建时的考量
总体而言,病毒载体在设计时应基于制品的预期临床效果和安全性进行考量。有效性考量应基于制品的作用机制,如目的基因的表达,或通过RNA干扰等方式诱导的基因沉默;安全性考量方面,应重点关注所使用载体的靶向性、毒力、免疫原性,以确保其安全性。
3、病毒种子批建立的必要性
对于复制型/复制缺陷型病毒载体,为了保证产品生命周期内可以持续生产,提升产品的稳定性和一致性,需要建立均一性良好且通过充分表征鉴定的病毒种子批系统,并且应该采用二级或三级种子批系统(原始种子批、主种子批和工作种子批),使每一支冻存样品均具有群体代表性和良好的均一性,而且需要进行充分的质量检定,从而最大程度地控制污染风险。因此,建立种子批系统是病毒载体质量一致性的重要保证之一,推荐建立病毒种子批系统。
4、病毒种子批系统的建立方
病毒种子批系统包括原始毒种种子、主种子批以及工作种子批。原始种子相关信息应包括但不限于:毒种详细历史资料、分离制备过程、中间体及最终毒种的基因图谱和注释。若毒种构建过程中使用过动物原材料应保存详细清单;若毒种经过噬斑法或有限稀释法纯化,或来源于DNA或RNA克隆中的恢复拯救,均应详细记录。对于建种子批的毒种,应详细记录制备、储存、维护以及检定的相关信息,主种子批和工作种子批应建立稳定的制备工艺并进行相应检定。
5、种子批的质量控制要求
种子批的总体质量控制要求为表征与预期或设计一致,应具有相应功能、无外源性/内源性污染、在一定代次内稳定存在等。同时,考虑到不同级别种子批设立的目的不同,为了优化实验资源,使质量控制工作更加合理,建议不同级别种子批进行不同项目的检验。
无论是病毒载体还是辅助病毒,病毒主种子批(MVB)的质量控制应包括但不限于:鉴别(基因扩增、特异性序列测定和免疫血清学检测等)、滴度(感染滴度、转导滴度等)、活性(治疗序列的转录/表达量、治疗序列的生物活性)、无菌检查(细菌和真菌)、支原体检查、外源病毒因子、伴生型病毒或复制型病毒检查等。其中的病毒外源因子检查,除采用传统药典方法外,还应对原材料、细胞基质可能引入或高风险的种属特异性外源病毒因子进行筛查。若制品为溶瘤病毒,还应选择适当的方法对病毒的目的基因进行序列确证,对杀伤活性以及选择性增殖活性进行测定。此外,还应证明生产用毒种的遗传稳定性、目的基因表达稳定性和生产稳定性。
由于工作种子批(WVB)是由MVB经细胞基质扩增而来,在保证细胞基质质量可控、制备工艺稳定的前提下,若MVB 进行了全面检定,WVB 可侧重检测从 MVB 到 WVB 传代过程中可能引入的外源因子等;但有特殊需求除外,如因主种子批数量不足无法完成外源因子全面检查时,应对工作种子进行全面检定。
6、生产用种子批的管理
2020年版《中国药典》三部明确规定了病毒种子批和细胞库管理要求,包括病毒种子或细胞一旦从库中移出不得再回冻至库内;研究用种子和细胞与生产用的种子和细胞要严格分开存放;需建立台账、冻存容器的监测及维护等。
7、病毒种子批的稳定性研究
病毒种子的稳定性研究数据是设置其保存条件及期间核查周期的重要依据,因病毒的生产成本较高,在研究早期可重点开展保存温度及不同状态的稳定性研究。稳定性研究主要考查病毒对保存条件敏感的质量参数,如可见异物、感染滴度等;若对病毒种子进行冻干保存,还需进行水分的检测。
种子批的遗传稳定性评价应依据种子批代次进行,因此从主种子开始应规定明确的代次。当种子批的用途不同时,进行稳定性评估所需要到达的代次也不同,只用于生产的种子批,应在生产结束时,仍能保持遗传稳定;而形成制品用于患者的种子批,应考虑在患者体内的极限高代次仍应具有遗传稳定性。
种子批的遗传稳定性评价,应以遗传变异的可接受程度为参考依据,建立针对多个高变异检查点的检测方法,并且需要建立变异后的可接受标准等。
8、病毒种子批的外源因子污染检测
外源因子污染是影响基因治疗制品安全性的一个重要风险因素,其检测项目主要包括细菌、真菌、支原体及外源病毒因子污染,一般要求不得检出外源因子污染。
外源因子污染的检查方法可参见2020年版《中国药典》三部通则中无菌检查法、支原体检查法及外源病毒因子污染检查法。
在进行无菌检查时,除需进行常规的无菌检查试验外,对于培养时间较长的结核分杆菌,需更换专用培养基并延长培养时间进行结核分枝杆菌的独立检查。对于支原体检查,药典要求同时进行培养法和DNA染色法检查,在药典方法检测受限时也可考虑采用特异的荧光定量PCR等替代方法。在进行病毒类外源因子检查时,由于制品本身为病毒(尤其是溶瘤病毒制品),为了尽量减少病毒载体自身对试验的干扰,在开展外源病毒因子检查(动物试验法或指示细胞培养法)前,应制备合适的中和抗体或抗血清对制品病毒进行中和。若无法制备合适滴度的中和抗体,需要在病毒种子生产时,设置生产用对照细胞并进行外源因子检测。对于不易培养或风险性较高的外源病毒,如高风险人源病毒、猪源、猴源、鼠源病毒等,应开发特异性检测方法,如PCR等分子检测技术。对于逆转录病毒检查,一般采用逆转录酶活性检查法检测逆转录酶活性,若逆转录酶阳性,还应结合电镜以及感染性试验结果来进一步判断是否存在逆转录病毒。
除以上方法外,鼓励研究者开发灵敏度更高、简便快捷的外源因子检测方法,如高通量测序(NGS)法、激光力细胞学(LFC)法等,经验证后,可考虑作为目前外源病毒因子污染检查的补充方法,但此类方法通常检测的是特定的病毒组分(如核酸序列),可能造成假阳性结果,应以病毒种子批中是否具有可复制的外源因子为最终判定依据。若在测序结果中测得外源病毒序列,还需要进行PCR验证,若PCR结果为阳性,最终仍需要进行感染性试验以确证制品中是否存在感染性/可复制性病毒颗粒。
9、无中和抗体时毒种的外源因子检测
对于杆状病毒生产系统,在毒种库阶段进行广谱病毒外源因子、牛源病毒以及支原体(指示细胞法)等项目检查时,需要预先采用中和抗体对病毒种子批样品中的主病毒进行中和。当中和抗体不能有效中和主病毒时,需要进行预稀释。为了避免潜在的外源因子因过度稀释造成的检验结果假阴性,预稀释倍数建议不得超过生产接种时该工艺操作单元毒种的最大放大倍数。基于此种情况,一般需要在病毒种子批检定之前制备高滴度的中和抗体。
对于无法制备足量高滴度中和抗体的情况,一方面,可以在毒种制备过程中设置对照细胞,即对照细胞和毒种培养物同步处理,但不感染病毒,最终对对照细胞进行外源因子检测;另一方面,可以考虑采用经过验证的替代方法,如广谱外源病毒因子检查可以采用NGS法,以补充或替代体外细胞培养以及动物试验用于检测已知、未知或非预期的病毒种类。
10、质粒菌种子批的制备要求和质控项目
质粒是病毒载体生产的起始原材料,而细菌是质粒的宿主,为了保证质粒的稳定性和一致性,应建立质粒菌种子批。
建立质粒菌种子批时应确保菌种子批的历史和来源清晰,应建立至少两级种子批系统,应确保不存在其他细菌、真菌和噬菌体的污染,以及在限定代次内具有遗传稳定性。
菌种子批的检定通常应包括菌落形态、染色镜检、生化特性、抗生素抗性检查、电镜检查、质粒限制性酶切图谱分析等。应选择合适的方法证明不存在其他细菌、真菌和噬菌体的污染,证明细菌种子批多批次传代后基因型和表型的稳定性。对于基因组重要区域(如人为改造区域及其侧翼序列)应进行该区域的序列测定,对于经基因改造后不大于50 kb的质粒,应进行质粒全序列测定。对于转导质粒的细菌种子批,应检测质粒拷贝数和有/无质粒细菌的比例。对于生产质粒用途的细菌种子批,应检查质粒产率。对于引入的治疗基因,应检测其表达和功能活性。对于减毒细菌载体,应鉴定其减毒的特性和稳定性,并检测其对抗生素的敏感性。
11、生产用质粒载体的质量控制项目
根据2020年版《中国药典》三部“人用基因治疗制品总论”中的相关要求,生产用质粒DNA载体应考虑抗生素抗性基因的风险,且不得使用氨苄西林抗性基因。对生产用质粒载体的质量控制项目,主要包括鉴别,即对质粒改造部位的PCR检测或对质粒特定限制性酶切图谱的检测、对全质粒的Sanger测序,随着测序技术的发展,建议质粒全长测序;纯度,通常采用 A260/A280;含量,即质粒的浓度(A260);质粒形态,即超螺旋比例(如琼脂糖凝胶电泳,毛细管凝胶电泳或AEX-HPLC等);建议对质粒进行微生物限度检查或无菌检查,有条件的推荐无菌检查,以保证生产过程较低的微生物负荷或达到无菌要求,若有必要可增加杂质检测项目,如宿主细胞DNA、RNA以及蛋白质残留量。
以重组AAV病毒三质粒生产系统为例,用于生产的3个质粒分别为载体质粒(AAV-GOI,插入目的基因,包装进入重组AAV病毒),包装质粒(AAV-RC,含有AAV复制相关的rep基因和衣壳cap基因)和辅助质粒(pHelper,包含腺病毒的E2A、E4和VARNA基因,与293细胞中的E1a和E1b基因共同替代5型腺病毒的作用,辅助重组AAV病毒的包装)。对3种质粒的质量控制项目应包括鉴别、纯度、含量和质粒形态。对于鉴别,因为3种质粒所携带基因不同,采用PCR进行鉴别时,目的片段种类及大小应各异,限制性酶切图谱鉴别中所用的限制性内切酶和酶切图谱也应分别考虑,测序鉴别的结果应符合各质粒的预期序列。值得注意的是,载体质粒中ITR区容易丢失,这会严重影响重组AAV的包装效率,由于ITR区是反向互补序列,存在高级结构,PCR不易扩增,可采用SmaI限制性酶切后,以电泳的方式检测ITR区的丢失情况。另外,超螺旋结构的质粒形态具有最好的包装效率,3种质粒均应保证较高的超螺旋占比,具体可采用琼脂糖凝胶电泳、毛细管凝胶电泳或高效液相色谱(HPLC)进行控制。
五、细胞基质的制备及质量控制
细胞基质是病毒类基因治疗制品生产的重要起始原材料之一,是核酸复制、衣壳蛋白表达、病毒颗粒组装的重要场所。为了保证目标制品质量的一致性和稳定性,在满足建库需求的情况下,生产/包装用细胞基质均应建库管理。细胞库无污染、可稳定生产,是保障终制品质量的基本前提。在生物污染方面,首先要从源头上控制细胞种属来源的外源因子,其次要保障细胞库制备过程中不受外源因子污染。在稳定性考察方面,要重点关注生产产品的一致性和贮存在规定条件下的细胞能否维持其生产能力。
1、病毒类基因治疗产品的生产用细胞基质
细胞基质是生产病毒类基因治疗产品必不可少的起始原材料,一般包括病毒种子批构建时使用的细胞基质和生产病毒过程中使用的细胞基质,2种细胞基质可能相同也可能不同。以昆虫细胞-杆状病毒系统生产rAAV为例,包括制备杆状病毒种子批的细胞基质和生产rAAV的细胞基质。
2、生产用细胞基质的选择
细胞基质的选择和使用应具有一定的依据并符合相应的生产要求,任何细胞基质均应满足来源清晰、历史培养过程清楚、风险可控及经过全面检定的要求,以确保其适用性和安全性。在选择细胞基质前应进行研究和评估,一般包括细胞的种属及组织来源、细胞对病毒的敏感性及稳定生产病毒的能力、细胞的特性及全面检定的可行性、细胞对制品的安全性、生产工艺的便利性和可行性以及下游纯化工艺能够去除风险因素的可能性等。除考虑细胞生物属性(如生长特性、包装效率等)对病毒产量的影响外,应全面评估细胞对最终制品质量和安全性的潜在影响,如细胞是否含有致癌基因、细胞成瘤性和致瘤性、内源性病毒的污染,以及病毒载体在细胞内的重组风险等。
3、细胞库的建立和管理
为了保证目标制品质量的一致性和稳定性,在满足建库需求的情况下,生产/包装用细胞基质均应建库管理。通常细胞库包括主细胞库和工作细胞库,参照2020年版《中国药典》三部“生物制品生产检定用动物细胞基质制备及质量控制”和 ICHQ5D的相关要求进行建库、保存和管理。
4、细胞培养过程中的注意事项
细胞取材、建库及制备全过程应具有可溯源性及操作的一致性,并对各个环节的风险进行充分的评估。所有类型细胞的供体应无传染性疾病或未知病原体的疾病。与细胞培养相关的所有材料,特别是人源或动物源性材料,均应按照药典相关要求进行风险评估,选择与生产相适应的原材料,必要时进行检测。所有生物源性材料均应无细菌、真菌、分枝杆菌、支原体及病毒等外源因子污染。细胞培养过程中所用的牛血清及胰酶应符合药典相关要求。细胞培养液中不得含有人血清。若使用人血白蛋白,应获得国家药品监督管理部门批准。细胞制备过程中不得使用青霉素或β-内酰胺类抗生素。配制各种溶液的化学药品应符合《中国药典》或其他相关国家标准的要求。
生产过程中,从冻存的 WCB 中取出1支或多支混合后培养,传至一定代次后供生产用,其代次不得超过该细胞用于生产的最高限定代次。生产用细胞的最高限定代次应根据研究结果确定,但不得超过国际认可的最高限定代次。从WCB取出的细胞经增殖后获得的细胞不得再回冻保存用于生产。
病毒生产过程中应重点关注外源因子的污染和交叉污染、生产人员的健康和安全防护、生产环境的生物等级和安全隔离,以及生产产物或废弃对环境的生物安全性影响。
5、生产用细胞基质的检验依据及内容
生产用细胞基质的检定应符合2020年版《中国药典》三部“人用基因治疗制品总论”、通则“生物制品生产检定用动物细胞基质制备及质量控制”、ICH Q5D的相关要求,以及国家药品监督管理局药品审评中心(Center for Drug Evaluation,CDE)发布的相关指导原则。检定项目包括:鉴别、微生物安全、内外源病毒因子检测、成瘤性/致瘤性、插入序列的鉴别和完整性确认(如适用)等,需关注细胞种属相关病毒和培养过程可能引入的潜在外源因子的污染风险。必要时还须进行细胞生长特性、细胞染色体检查,细胞均一性及稳定性检查。一般根据细胞类型、制品的性质以及生产工艺,决定是否有必要进行染色体检查和成瘤性和/或致瘤性试验。经基因修饰建立的稳定传代细胞系,还应对基因修饰的结果,如基因序列、修饰位点、拷贝数、表达水平等进行研究确认。
6、MCB、WCB、EOPC、对照细胞的检验
细胞库建立后应至少对 MCB 细胞及生产终末细胞 (EOPC) 进行一次全面检定,对于生产终末细胞不易取到的情况,可采用未加工细胞收获液结合限定代次细胞的做法进行全面检定。当生产工艺发生改变时,应重新对 EOPC 进行检测。每次从MCB建立一个新的WCB, 均应按规定项目进行检定。当MCB进行全面检定时,WCB需检测的外源病毒种类可主要考虑从MCB到WCB传代过程中可能引入的外源因子,而仅存在于MCB建库前的外源因子可不再重复检测。若在MCB或WCB中未检测到种属特异性病毒,后续过程中可不再进行重复检测。
对照细胞一般是在病毒种子或制品的外源病毒因子检查受限的情况下设置的。对照细胞培养物应与生产培养物同时处理,但不感染病毒。对照细胞培养物需要在生产条件下再培养14天以上;培养期间可以换液,以检测潜伏感染的、内源的或复制能力差的潜在病毒因子。在不同生产阶段,检测对照细胞的外源病毒因子。一般在生产末期,取不接种病毒的对照细胞,按药典相关规定进行细胞鉴别试验,细菌、真菌无菌检查,支原体检查,以及病毒外源因子检查。
7、细胞基质内外源因子检测的项目和方法
外源因子(Adventitious Agents)指生产中偶然引入的微生物,一般包括细菌、真菌、支原体/螺原体、分枝杆菌、立克次体、病毒、原生动物、寄生虫、传染性海绵状脑病相关因子等。根据污染途径分为源头污染(细胞种子来源,如种属相关、供体相关)和过程污染(培养过程引入,如污染的培养试剂、耗材、容器、环境或不当操作)。对于细胞种属来源相关的外源因子,如人源的HEK293细胞需要检测人源病毒因子、猴源的Vero细胞需要检测猴源的病毒因子、昆虫细胞系需要考虑昆虫来源的病毒因子、含有内源性病毒的细胞需进行相应的控制;对于某些含有内源性逆转录酶或逆转录病毒序列的细胞,需要采用感染性试验判断是否有感染性病毒颗粒存在。对于生产过程中可能引入的外源因子,如采用了动物源性原材料牛血清、猪胰蛋白酶等,则需要检测相对应的动物源性病毒因子。
检测方法可分为体内法和体外法。采用体内法时,应考虑不同的试验动物对外源因子敏感性的不同,如成年小鼠对淋巴细胞性脉络丛脑膜炎病毒(LCMV)、柯萨奇病毒、虫媒病毒、狂犬病毒敏感;乳鼠对多种人源病毒敏感,如柯萨奇病毒A/B和其他小RNA病毒、甲病毒属、布尼亚病毒、沙粒病毒、黄病毒属、狂犬病毒和疱疹病毒;豚鼠对结核杆菌和包括副粘病毒属、呼肠孤病毒和丝状病毒属在内的外源病毒因子敏感;家兔对乙型疱疹病毒敏感;鸡胚尿囊液对正粘病毒、副粘病毒、甲病毒属、水疱病毒属敏感,鸡胚卵黄囊对疱疹病毒、痘病毒、弹状病毒、立克次体、支原体和细菌敏感。若存在可能暴露于某一种属病毒的风险时,应根据种属来源选用合适的模型进行抗体生产试验。
体外法包括非特异性和特异性的检测方法。非特异性方法包括细胞培养法、扫描电镜法,以及逆转录病毒的非特异检测方法。细胞培养法可以检测多种非特异性病毒因子,包括致细胞病变病毒、血吸附病毒和血凝病毒。指示细胞的选择可参考药典相关规定,一般包括与生产细胞同种属同组织来源的细胞、人二倍体细胞和猴源细胞,对于生产用昆虫细胞,还应包括对虫媒病毒普遍易感的细胞(如BHK21)。扫描电镜法可以直接观察病毒颗粒,尽管灵敏度不高,但是可以检测多种类型外源因子。对于逆转录病毒的非特异性检测方法可参考药典相关规定。特异性检测方法主要是基于高灵敏度的方法(如PCR),对非特异性检测方法不易检出、高风险的病毒采用特异性检测方法,可提高检测灵敏度,最大程度地降低生物安全风险。应根据细胞种属来源、组织来源及供体健康状况等确定检测病毒的种类。如人源的细胞应考虑检测如人EB病毒、人巨细胞病毒(HCMV)、人逆转录病毒(HIV-1/2、HTLV-1/2)、人肝炎病毒(HAV、HBV、HCV)、人细小病毒B19、人乳头瘤病毒、人多瘤病毒,以及难培养的人腺病毒和人疱疹病毒-6/7/8 等。也可采用非特异性和特异性方法相结合的方式,如采用细胞培养结合荧光抗体染色法检测非特异性和特异性牛源病毒。
NGS技术已被证明有能力进行广谱的外源病毒检测,可用于检测存在于细胞DNA中的病毒序列或在细胞中以RNA表达的病毒序列,但应进行充分的方法学验证,包括使用合适的标准品或参照品进行分析鉴定和验证,以评估方法性能,并证明病毒检测的灵敏度、特异性和广度。对NGS获得的阳性结果应进一步确定是否与感染性病毒相关。
8、细胞基质的成瘤性和致瘤性评价
成瘤性是指待检细胞接种动物后,在动物体内形成(肿)瘤的特性。成瘤性检查的目的是评估待检细胞在受试人体内形成肿瘤的风险。新建细胞系/株及新型细胞基质应进行成瘤性检查。某些传代细胞系已证明在一定代次内不具有成瘤性,而超过一定代次则具有成瘤性,如 Vero 细胞,因此,必须进行成瘤性检查。已证明具有成瘤性的传代细胞,如BHK21、CHO、HEK293等用于生产治疗性制品时,可不再做成瘤性检查。
致瘤性是指将待检细胞的细胞成分接种动物后,诱导动物本身细胞形成肿瘤的特性。致瘤性检查的目的是评估待检细胞DNA和碎片诱导受试人细胞形成原发肿瘤的风险。已建株的二倍体细胞,如MRC-5、2BS、KMB17、WI-38及FRhL-2新建主细胞库不要求进行致瘤性检查。已建株的或有充分应用经验的连续传代细胞,如CHO、NSO、Sp2/0、低代次的Vero细胞不要求进行致瘤性检查。缺少充分应用经验的细胞基质需进行致瘤性检查。若使用具有成瘤性的细胞,需结合临床风险获益、给药途径和生产工艺的杂质去除性能(如活细胞残留、致瘤基因片段的残留等)等评估其使用的必要性、合理性和安全性,分析细胞中是否携带具有致瘤风险的基因或其他因子,必要时,应对其残留水平和基因片段大小进行控制。一般不建议使用具有致瘤性的细胞。另外,需通过生产过程控制和/或产品放行对完整细胞,尤其是成瘤性细胞的残留水平进行控制。
9、基因修饰细胞基质的特殊要求
对于经基因修饰(如组成性表达病毒包装蛋白或复制辅助因子)的生产用细胞,需开展基因修饰的相关研究,包括基因修饰时所采用质粒、病毒、基因元件的质量控制研究资料。细胞库的表征研究中还应对基因修饰的结果,如基因序列、修饰位点、拷贝数、表达水平等进行确认,以确保制品的安全性和有效性。同时,还要评价细胞在限定代次内的遗传稳定性和功能稳定性,如修饰序列的拷贝数、表达产物量、包装病毒的产量及质量等。应考虑基因修饰的必要性和修饰方法的适用性,修饰过程不应增加外源因子引入的风险,修饰基因的选择应尽量避免或降低病毒包装过程发生重组的风险。若修饰过程中引入了病毒序列或转化序列,应对潜在风险进行充分评估,如是否存在重组病毒的风险、细胞成瘤性和致瘤性的变化,并在终制品中对序列残留进行控制。
10、存在安全性风险细胞的质量控制
对于肿瘤细胞或携带致瘤表型、病毒序列的细胞,应谨慎选用,若确因病毒生产需要使用,应采用更严格的宿主细胞核酸残留限度,并对完整细胞的残留进行控制。在制品放行检验中,除了控制宿主细胞DNA残留量和大小,还应对已知具有安全性风险的特定转化序列残留进行控制,如293T细胞的E1A、SV40大T抗原、Hela细胞的E6/E7基因,检测方法应具备足够的灵敏度和特异性。
对于含有内源性病毒的细胞,原则上不用于生产,若确因病毒生产需要使用,应评估其使用的必要性和安全性,如内源病毒的人体感染活性、免疫原性、工艺残留水平等,必要时,应在工艺中增加经验证的病毒去除/灭活工艺单元,并在适当的阶段对内源病毒的残留和活性进行检测,以确保不会对成品的安全性、有效性和质量可控性造成影响。
对于非哺乳动物来源的生产用细胞,除了种属相关的外源因子,还要考虑到宿主的种属差异可能会对病毒衣壳蛋白的表达比例及翻译后修饰情况产生影响,建议加强终产品的结构确证、免疫原性和体内生物分布的研究。
11、细胞基质的稳定性评价
传代稳定性研究的目的是为了确保细胞基质可以稳定地生产预期质量一致的制品和贮存在规定条件下的细胞可维持其生产能力。
细胞库的传代稳定性研究条件应代表或模拟商业化生产工艺,重点考察细胞基质的遗传稳定性、生产稳定性(如染色体检查、细胞生长特性等)、安全性(外源因子污染和成瘤性、致瘤性变化),一般应包括鉴别、微生物安全(如无菌、支原体等)、内/外源病毒因子、特定外源病毒因子(若适用)、逆转录病毒、染色体检查(二倍体细胞)、细胞生长特性、生产/包装病毒能力和病毒产品质量(如产物的完整性和一致性)等。同时,需考虑细胞库随着代次增加引起的成瘤性和/或致瘤性变化。经基因修饰建立的细胞系/株的传代稳定性研究还需关注传代过程中基因修饰部分的稳定性,如基因序列、拷贝数、蛋白表达稳定性。根据传代稳定性研究结果制定细胞库限传代次,用于生物制品生产的细胞最高限定代次须经批准,实际生产过程中应在细胞限传代次内进行病毒产品生产。
为了保证细胞库在贮存过程中的稳定性,需制定合理的贮存稳定性考察方案,关注在长期贮存过程中细胞活率、细胞生长特性、生产病毒能力等的变化。根据研究结果确定细胞库的贮存条件,细胞库在拟定的贮存条件下可满足生产需求。
六、基因治疗制品生产过程中的质量控制
本章节主要针对生产过程中的质量控制,包括生产工艺研究、中间过程控制、检查项目、质量标准和工艺验证等。病毒载体类基因治疗制品的生产工艺种类较多,并且涉及内容复杂。对制品特性的全面而准确的分析研究,对已有的、成熟的、有效的生产管理模式的借鉴以及现有的技术和质量管理理念的落实等,都是制品生产工艺设计和质量保障的重要基石。
病毒载体类基因治疗制品生产中的质量源于设计(QbD)和全过程质量控制是非常重要的理念,任何环节的疏漏,都有可能导致灾难性后果,因此,树立“以制品质量为中心的生产意识”尤为重要。生产过程中各种生产参数控制是质量控制的主体,全过程关键工艺参数控制和中间过程控制检查共同组成制品的生产过程质量控制。控制策略可包含8个方面:1)中间过程控制样品检测;2)工艺参数的控制;3)工艺性能的监控;4)产品表征;5)产品放行检测;6)产品稳定性考察;7)物料控制;8)厂房设施和设备控制。
1、基因治疗制品生产工艺设计/研究的考虑因素
生产工艺设计和研究是质量体系的重要组成部分。由于基因治疗制品的复杂性和特殊性,要求基于制品的目标产品质量特性,开展生产工艺设计/研究,并运用风险评估工具完善工艺开发,工艺设计/研究应贯穿基因治疗制品的全生命周期中,并随着技术的进步和认识的深入,不断补充和完善。
病毒载体类基因治疗制品的生产工艺设计应基于制品特性,除考虑安全性外,还要关注起始生物原材料的遗传稳定性,如适当的菌毒种种子批和细胞库管理模式,可以有效地控制生产中起始生物原材料遗传变异所带来的制品质量风险。
生产过程中原则上应尽力避免使用有毒有害的物质,若不得不使用有毒有害物质,应对这些物质的残留进行控制。
除此之外,在制品生产工艺设计/研究中还必须满足法规的强制要求,如《中国药典》凡例中关于抗生素的使用要求。
2、病毒载体类基因治疗制品生产过程的关键工艺研究
总体上讲,病毒载体基因治疗制品的生产步骤主要包括:细胞基质培养、接种毒种或转染质粒、病毒收获澄清/过滤、纯化和浓缩工艺、原液存储和检测、成品配制灌装等,不同的制品特性工艺存在一定差异。
细胞基质应符合细胞库的管理要求,在向生产容器中接种细胞基质前,对容器的清洁、培养基的除菌、细胞的复苏和扩增都非常重要;在向生产容器中接种细胞基质的过程中,应做好防污染的防护措施;细胞基质的培养需要对相关设备进行各种参数控制,使得细胞基质在适宜的环境中生长。
接种的毒种应符合菌毒种种子批的管理规范,包装用质粒应符合一定的质量管理要求,复苏和扩增后的种子或包装用质粒向生产用细胞基质接种时,应符合规定或验证后的扩增和接种程序,还要避免外源污染。
细胞培养过程应对温度范围、pH、CO2、接种活细胞密度、代次等过程工艺参数实时进行控制。以质粒转染的AAV上游工艺为例,还需要对细胞代次、质粒DNA(辅助质粒、血清型质粒、目的质粒)转染比例、转染试剂与质粒DNA的比例等工艺参数进行评估和工艺研究。
在生产用容器内病毒载体达到峰值时,通常是收获的时刻,收获时机是对目标物质收率和活性等质量属性有重要影响的关键工艺参数,可通过缩小模型和单因子法等进行试验,对收获时机进行确认,此时目标物质与众多物质混杂在一起,目标物质定量困难,通常需要靠工艺验证后的参数来控制,这是生产中重要的研究环节之一。
收获后料液的裂解方式和核酸酶消化方式对于产品的收率和工艺相关杂质残留的起始水平有重大影响。裂解液的类型和裂解时间、核酸酶的用量及消化时间等需要通过评估并确定风险等级再进行工艺探索和验证。收获后的纯化有过滤、离心、层析、浓缩和缓冲液置换等步骤,是逐步去除杂质的过程,这一过程带来的不仅是目标物质的富集,同时还有目标物质的损失,最大限度地去除杂质和获得目标物质最大收率,是纯化的目标。
原液的检测是工艺要求的重要环节,经过纯化的原液需要确定滴度(含量)或活性,并以此为依据进行半成品配制和成品灌装。因此,即使不对原液实施放行检验,也要有中间过程控制检查和样品检测。
成品配方配制和制备操作及过程,也是影响成品稳定性的重要因素。基因治疗制品一般都为无菌制品,需要采用无菌工艺进行灌装,可以参照国家药品监督管理局发布的《无菌工艺模拟实验指南》和《除菌过滤技术及应用指南》实施。
3、生产工艺中间过程的样品测试和留样
遵循质量源于设计(QbD)的原则,一般在产品开发初期会确定目标产品质量概况(QTPP)。QTPP考虑到产品的安全性和有效性,在理论上期望产品达到的一系列质量要求,可涉及到剂型、递送系统、包装系统,纯度、含量/浓度、稳定性、安全性、用药方式等。
QTPP描述了产品的设计要求,是确立关键质量属性(CQA)、关键工艺参数(CPP)和控制策略(Control Strategy)的基础。由QTPP导出一系列的产品质量属性,基于现有知识及已有的药学研究、非临床评价和临床评价数据,通过风险评估确定其对产品的安全性和有效性的影响,识别出关键质量属性,加上现有对工艺和产品的理解和知识,形成初步的控制策略。
在ICH Q10中控制策略的定义是“为了确保工艺性能和产品质量,基于目前对于产品和工艺的理解而形成的一套计划设定的控制措施,包括生产工艺参数,与原液和制剂生产相关的原材料、辅料及包装材料的参数和属性、设施和设备运行条件、过程控制、产品质量标准以及与监测和控制的分析方法及频率”。控制策略的形成是从产品的理解到工艺的理解的持续优化过程,通过工艺研发、工艺表征等过程,采用DoE和不同的风险评估工具,识别影响关键产品质量属性的关键物料属性、关键工艺参数(CPP)以及其他变因,组合成一套控制措施,来实现产品质量的持续稳定受控。
中间过程控制样品检测是在生产的特定步骤实施采样并测试,对生产工艺进行及时监控并实时反馈生产过程中的某些产品质量情况,具体项目和监控步骤,可基于对工艺的理解和知识以及对关键质量属性的影响,经过风险评估确定。通常会考虑各主要生产操作步骤的产物产量和/或主要杂质,用以监控该步骤的工艺性能,以及支原体、微生物负载,内毒素等安全性指标,如:对UPB取样检测微生物限度、内毒素、支原体以及外源因子等,在收获、层析、超滤等步骤会采样检测产物产量(如基因组滴度等)以及微生物限度和内毒素。通常在临床试验药品生产和商业化生产初期会加强过程监控和检测,随着生产批次的增多以及生产经验的积累可逐步减少某些检项和频率。
采样过程应不影响正常的生产,不能因为采样而引入污染。
留样可参照GMP 2010版第二百二十五条和“临床试验药品附录”中第三十六条的要求实施,若制剂的组分与原液一致、储存条件一致,特别是采用原液和制剂生产过程不进行冻存的,可考虑直接对制剂成品进行留样。
4、病毒载体类基因治疗制品的生产条件
细胞基质复苏后需要逐级扩增到一定数量规模后才能开始生产过程,扩增过程应尽量选择与生产相近的环境条件进行。所有这些步骤的接种量和扩增时间等工艺参数都需要通过工艺验证数据获得,并且应规定下来形成文件,指导后续细胞基质准备过程。细胞基质生产结束时的代次应不大于细胞库稳定性验证中证明细胞可以稳定传代的最高限定代次。
病毒种子批的复苏与扩增也应逐级放大,各种参数需要工艺验证获得,形成文件指导后续种子准备过程。种子批的稳定性研究,应与种子的最终用途密切相关,若只是辅助生产,生产结束后种子的代次要低于种子批稳定性验证中证明种子稳定的最高限定代次;若种子最后需要形成制品,并且进入人体,需要种子批稳定性验证,证明其在人体中使用达到极限高代次时仍然稳定。质粒扩增依赖于细菌种子批扩增,这一过程可能涉及抗生素的有关要求,参见《中国药典》凡例。质粒的制备环境要求与质粒的最终用途有关,若是裸质粒制品,则需要参照GMP实施。若是作为起始原材料使用,应符合2020年版《中国药典》三部中“人用基因治疗制品总论”有关要求。不同产品的质粒生产需额外注意不同质粒生产的共线风险,避免质粒生产的交叉污染风险。
5、病毒载体类基因治疗制品的纯化工艺选择
纯化工艺是制品生产的重要环节,是制品中目标物质富集、纯度提升、去除杂质等的关键步骤,是提升制品质量的有效步骤之一。纯化工艺设计与制品的特性密切相关,从总体上讲,分为开放性纯化工艺和封闭性纯化工艺。开放性纯化工艺的生产管线不能完全封闭,需要存在与外界直接接触的过程,如密度梯度离心等,但这样的工艺管线有一定的弊端,既增加污染机会,也容易造成泄露;封闭管线系统,相对安全,在无菌接口的配合下,基本实现密闭纯化,此工艺更适用于可进行柱纯化工艺的制品。
病毒载体基因治疗制品颗粒相对较大,在培养、纯化及浓缩过程中可能会因为对剪切力敏感而失活,因此在进行层析及浓缩工艺设计时,应考虑尽可能地采用减小这些破坏因素的纯化工艺,如控制流速、减小切向流压力,但是还必须考虑纯化工艺对杂质的去除效果。以AAV的下游层析工艺为例,需要对层析上样载量、流速、上样pH、电导率、洗脱pH和洗脱柱体积等进行工艺探索和验证。纯化工艺的研究和验证,需要基于质量源于设计的理念,并且运用风险评估和实验设计等工具摸索和验证,确定工艺步骤和参数等。纯化工艺还有一个重要的原则需要推荐,即尽可能地选用容易扩大生产规模的纯化工艺方法,为后续工艺放大和扩大生产提前做好准备。
6、病毒载体基因治疗制品分装工艺的考虑因素
经纯化获得的原液一般需要进行相应的检测,指导后续半成品配制(若适用)和成品灌装,对于从原液到成品为连续工艺的制品,可在风险评估及工艺验证的基础上进行原液风险放行。配方溶液配制步骤和操作对于病毒载体基因治疗制品也非常重要,经工艺验证获得的方法和参数应固化成生产文件。
灌装需要进行模拟灌装验证,确认灌装环境、极端灌装条件以及灌装量等,这一步骤应参考国家药品监督管理局颁布的“无菌工艺模拟实验指南”和“除菌过滤技术及应用指南”实施。
7、病毒载体类基因治疗制品工艺验证的考虑因素
FDA在2011年颁布的《工艺验证:一般原则与实践》里将工艺验证定义为收集并评估从工艺设计阶段一直到商业化生产的数据,用这些数据建立科学依据来证明该工艺能够始终如一地生产出优质产品。它将整个工艺验证分为3个阶段(工艺设计、工艺确认和持续工艺确认),整合了ICH Q8、Q9、Q10、Q11等相关指南的一些新理念(如质量源于设计、生命周期方法、质量风险管理、药物质量体系等),涵盖了产品的整个生命周期。
第一阶段工艺设计的主要目标是开发一个稳健的生产工艺以及建立适当的控制策略,以确保产品质量始终如一,然后在第二阶段中对控制策略进行确认,将其应用于商业化工艺中。第一阶段的主要工作是定义目标产品质量概况(QTPP)与评估确定关键质量属性(CQA),并进行初始的风险评估以对工艺参数进行初步分类。这个评估主要是基于已有知识或早期开发工作,评估结果为工艺表征研究提供基础,从关键性分类中确认和缩减了工艺参数数目,有助于高效建立参数范围。工艺表征研究可以根据需要使用单变量与多变量研究进行实验,使用实验设计(DoE)方式有助于理解多个参数的交互作用,从而帮助最终确定关键工艺参数(CPP)和非关键工艺参数(Non-CPP)及其可接受范围,进而支持建立工艺控制策略。控制策略包含的元素包括但不限于原材料控制、工艺参数控制、中间工艺控制、性能参数监控、中间品和产品质量标准、稳定性考察等。需要注意的是,产品生命周期内的风险评估需要根据相关分子的先验知识、平台知识,以及来自工艺、非临床与临床开发的特定知识和数据不断迭代更新。
第二阶段工艺确认的目的是证明该工艺可以按预期工作并产生可重现性的商业化产品,主要包括厂房、公用设施、设备的确认(需要在工艺性能确认之前完成)和工艺性能确认(PPQ)。监测PPQ批次是工艺验证的主要要素,以显示工艺的一致性、杂质去除能力,以及满足CPP、中间工艺控制、工艺性能参数与CQA的可接受标准的能力。PPQ证明了在商业化生产规模下工艺设计的有效性和工艺控制策略的适用性。
在PPQ研究中,需要运行的批次数是基于风险来确定的,具有完整的先验知识、工艺开发、工艺表征和多批成功放大生产(生产规模同商业化生产)数据和经验的,PPQ则需要较少的运行批次,反之,则需要较多的运行批次。CDE颁布的《体内基因治疗产品药学研究与评价技术指导原则(试行)》中对于生产工艺的确认与验证的批次描述到:验证研究的批次数量与工艺的复杂性、变异度,以及前期工艺研究的充分性、平台经验等有关,一般不少于3批,若有其他特殊情况,建议提前与监管机构开展沟通交流。目前,很多基因治疗产品都是用于罕见病,市场需求量很小,建议在前期开发和生产数据较多,以及对产品和工艺理解比较充分的情况下,企业可基于风险评估,提前与CDE进行沟通是否酌情减少PPQ的生产批次(做1~3批)。
第三阶段持续工艺确认(CPV)是在产品生命周期内将继续进行工艺例行的持续监测与评价。持续工艺监测提供了证据,表明该工艺在商业化生产工艺中仍处于控制状态且处于已验证状态。
8、基因治疗制品中非目标病毒的清除和工艺验证
在2022年9月ICH Q5A(R2)征求意见稿中,首次纳入了基因工程病毒载体和病毒载体衍生产品,该指南明确指出了对于适用于某些可进行病毒清除而不会对产品产生负面影响的病毒载体类产品,需要进行病毒风险控制和必要的病毒灭活/或清除步骤。如何验证非目标病毒清除工艺主要考虑以下3点:
(1)病毒清除验证指示病毒的选择
指示病毒主要分为3类:“相关”病毒、特异性“模型”病毒和非特异性“模型”病毒。
a.“相关”病毒是指已被鉴定的病毒或其同种病毒,其可能会污染细胞或生产过程中使用的任何其他试剂或材料的病毒。应证明灭活/去除工艺能灭活/去除此种病毒。
b. 特异性“模型”病毒是与“相关”病毒密切相关(同种或同属),并与其具有类似理化特性的病毒。若得不到“相关”病毒,或它不太适用于清除病毒工艺评价研究,应使用特异性“模型”病毒代替。
c. 当研究目的是确定生产工艺灭活/去除病毒的总体能力,即确定方法的可靠性时,应使用具有不同特性的非特异性“模型”病毒进行病毒清除特性研究。选择的非特异性“模型”病毒要包括以下特性:具有单链和双链的DNA和RNA基因组、脂包膜和非脂包膜、大小尺寸、对物理化学处理的耐受性。
对于病毒载体类产品,若生产过程中使用了辅助病毒(杆状病毒、HSV、腺病毒),在临床早期阶段就应该进行病毒清除研究。在临床早期应至少将该辅助病毒作为指示病毒进行研究并在工艺性能确认(PPQ)阶段增加指示病毒验证。生产工艺应能充分地清除辅助病毒,基于风险对对数下降因子进行评估。对于HEK293瞬时转染工艺平台,在临床早期阶段通常不要求进行病毒清除研究,建议在PPQ前完成验证。
在生物制品许可申请(BLA)/新药申请(NDA)阶段,病毒灭活步骤(Low pH或S/D灭活)一般选用2种指示病毒,纳滤一般选用2种或4种指示病毒,层析步骤一般选用4种指示病毒。指示病毒选择需要考虑的其他问题如下:
a. 尽可能地培养出高滴度的病毒,并对病毒进行纯化,以减少对验证试验的干扰;
b. 应有一种有效和可靠的测定方法对要测试的每一道生产工艺中所使用的每种病毒进行检测;
c. 有些病毒可能会对从事研究的人员造成健康损害,对此应加以重视。
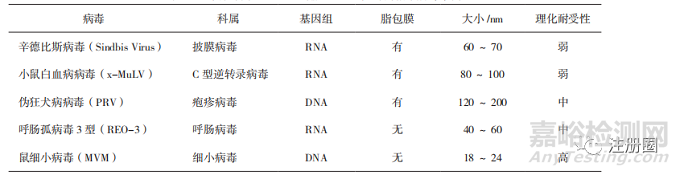
对于使用三质粒瞬转,HEK293细胞表达的AAV载体产品,由于过程中不使用辅助病毒,可以用表1所列病毒作为指示病毒。
▲ 表1-三质粒转染 HEK293 细胞 AAV 生产时的指示病毒举例
若使用含有内源性病毒的昆虫细胞(如含有弹状病毒的 Sf9 细胞)生产病毒载体产品,需要研究下游工艺清除弹状病毒的能力,结合风险评估,证明整个生产工艺能充分去除弹状病毒,保证产品的安全。
(2)病毒清除工艺要求
完整的病毒清除工艺应同时包含病毒灭活(如低pH和S/D灭活)和病毒去除步骤(基于结合/非结合机制如阴离子交换层析,或基于尺寸排阻机制如纳滤)。一般认为,单个工艺步骤病毒滴度降低4 log及以上为有效的病毒清除步骤,1~3 log认为是辅助的病毒清除步骤。考虑到检测和统计误差,病毒滴度下降较少(如低于1 log)的步骤不计入总去除指数内。
病毒清除验证一般使用缩小模型(Scale-down Model)进行,需要考虑缩小模型的代表性和样品的代表性。至少分别做2次独立的病毒清除研究来证实病毒清除的可重复性,一般是使用1批次样品重复2次。
因为层析介质的使用次数可能会影响病毒去除的效果,因此,若工艺中使用层析工艺作为病毒清除的步骤,在做病毒清除验证时,应考虑新旧填料对病毒清除效率的影响。
(3)病毒检测方法
在病毒清除工艺验证中,病毒的检测方法要求高灵敏度、高特异性以及良好的稳定性和重复性。目前,病毒检测的方法主要包括:噬菌斑检测法(定量)、TCID50检测法(半定量)、qPCR(定量),其他检测方法还有电镜法等。
9、病毒载体类基因治疗制品工艺验证中UPB的采样和检测要求
UPB被翻译为未经处理原液,是生产工艺验证中用于病毒安全性验证的采样。采样点在生产目标物收获过程的末期,即在不影响正常生产的情况下,在最长培养时间条件(或最有可能采集到目标物之外病毒条件)下采集收获液。
除特殊病毒会与目标物质一起被浓缩富集外,其他外源、内源病毒的量在目标物质达到最大量值的时候,通常也达到峰值,因此,在此阶段采样检测,更容易测出是否有病毒污染。
UPB的检测通常应涵盖工艺验证的连续多批次,检测项目以非特异安全检测项目为主,一般包括病毒外源因子检查、微生物限度(或无菌检查)、支原体检查、逆转录酶活性测定等,若有特殊要求可增加特异性病毒检查项目或其他检验项目。
10、病毒载体基因治疗制品生产工艺的稳定性研究
制品的质量稳定或批间一致是制品存在的生命线,而实现这一目标的关键手段就是生产工艺的稳定性。生产工艺的稳定性,包括原辅料持续来源的稳定供给、细胞基质细胞库的稳定储存和使用、菌毒种种子批的稳定储存和使用、各种生产仪器和设备的校
准和使用、检验检测方法的稳定和数据的可靠性等。
生产工艺稳定性研究通常通过风险评估,确认后进行有效措施改进,形成正反馈,进而提高工艺稳定性。
提高生产工艺的稳定性是系统而长期的过程,在生产工艺研发之初,稳定生产工艺需要进行大量的工艺表征工作,以及工艺参数摸索和确认。在上市申请之前开展工艺验证工作,确定关键工艺参数及其操作范围。
在持续生产过程中,关键设备和仪器的更换,有可能产生影响制品质量的风险。为保证生产工艺和制品质量可控,国家药品监管机构通常要求按批准规程生产,不得随意变动,如需变更,应参照相关变更程序。
11、保证病毒载体类基因治疗制品活性的手段
依据病毒载体基因治疗制品的特性,其颗粒相对较大,对剪切力较敏感,对紫外线敏感,在保存过程容易失活。
首先,工艺方面,在对产品纯化及浓缩时,应考虑尽可能地采用减小这些破坏因素的工艺,如控制流速、减小切向流压力等;制剂方面,应筛选适宜的处方和内包材,避免病毒产生聚集和吸附,从而导致活性不稳定或者下降。
其次,应根据制品在稳定性影响因素方面的特点对制品进行稳定性测试,以确保制品在适宜的环境条件下进行贮藏和使用。如使制品尽量处在相对较低温度以及避免强光照射等,从而延长其稳定存在时间。
冻融对病毒载体活性影响较大,从目前的技术条件来看,冷冻到(-70±10)℃以下保存,仍然是较为有效保持病毒活性的方法;脱离低温环境的制品若需再次放回,应有冻融稳定性研究数据支持。
解冻的制品能在2~8 ℃或室温的存放时间,或是否能够进行可控温度链管理,需要进行较为充分的验证。对解冻后制品的外观和可见异物的检查应给予足够重视。
12、生产工艺变更原则
基于质量源于设计(QbD)和全生命周期管理的理念,为保障基因治疗制品临床前、临床试验和上市产品的质量一致性要求,生产工艺变更应参考国家药品监督管理机构颁布的《药品上市后变更管理办法(试行)》和《已上市生物制品药学变更研究技术指导原则(试行)》相关规定和要求。涉及重大生产工艺的变更,应对变更前后的制品质量、安全性和有效性进行比较和评估,以证明变更前后制品特性的一致性,并确保任何质量属性方面的改变对制品的安全性和有效性无负面影响。
13、基因治疗制品生产所用质粒的生产及稳定性考察
由于质粒载体(或质粒DNA)是重要的起始原材料,建议纳入质量管理体系进行管理,视同制品,若建立相应的主种子批和工作种子批,参照GMP相关要求生产,建立质量标准并检验。目前,各种指南没有强制性条款要求质粒应按GMP生产。由于基因治疗制品的复杂性和变异性,对生产用原材料来源和质量有较高的要求,质粒生产工艺和质量属性的稳定性影响最终制剂产品的稳定性,基于风险管理要求,建议生产多批次来考察稳定性。
14、基因治疗制品生产所用质粒的灌装规格和包材要求
目前,法规和指导原则没有对质粒灌装规格和包材有明确的要求,按生产用量分装,留出检验检测和稳定性试验的样品量。建议稳定性试验的样品包装材质与生产分装的容器相同。
15、基因治疗制品所用质粒的工艺表征和工艺验证研究
建议开展质粒的工艺表征和验证研究,这有利于制品质量可控,也有利于监管机构评价产品质量。建议在上游工艺中,在发酵罐水平进行补料策略、碳源的探索优化,选择最优补料策略及碳源。对发酵的溶氧、收获时间条件进行优化,以单位产量及产品DNA同质性等为响应优化工艺参数。在下游工艺中,在裂解工艺进行裂解体系、裂解时间的优化,优化层析工艺的上样载量和洗脱条件,以DNA同质性比例、E.coli宿主DNA残留、收率等为响应优化工艺参数。
16、质粒的无菌检查及取样要求
基因治疗制品生产使用的质粒是重要的起始原材料,基于风险评估和相关指导原则要求,按原材料或中间过程控制要求取样、留样,进行无菌检查,以保证生产过程(涉及细胞培养)达到无菌要求。
17、AAV基因治疗制品在放大生产前的潜在风险点
对于AAV基因治疗制品生产工艺路线的选择,需根据产品的目标质量概况进行风险评估,测算产品所需的生产规模和关键质量属性,包括单位产量、效价、空实心率等的要求,应避免在工艺放大后出现重大变更。
基因组完整性、rcAAV产生的风险、质粒DNA残留水平、宿主DNA残留水平、衣壳错包DNA水平不仅与目的基因(Gene of Interest,GOI)设计有关,也和生产使用的细胞株/上游工艺条件相关,应在工艺放大前进行工艺可行性评估,并根据产品的特性,结合实际情况采用不同分析手段拓展质量研究。
AAV由于其自身特性,存在易产生聚集以及吸附、冻融稳定性差等问题,建议在工艺放大前做评估测试,并结合预期临床用途、剂量规格、给药系统、容器密封系统的要求来优化筛选制剂处方,以提高AAV的制剂稳定性。
18、AAV基因治疗制品的工艺研究
AAV基因治疗制品可应用实验设计(Design of Experiments,DoE)等工具对关键工艺参数进行开发。如在有代表性的缩小规模的模型测试时,以裂解液滴度、空实心比例、宿主DNA残留等为响应进行转染条件,如:活细胞浓度(Viable Cell Density,VCD)密度、P/D(转染试剂/质粒总量,PEI/DNA)、DNA用量等多变量工艺参数表征,得到最优转染条件。对澄清过滤工序的滤器进行筛选确认并验证。对超滤浓缩工序所使用的超滤膜包或膜柱的孔径、跨膜压差、置换次数等进行确认并验证。对层析的载量、洗脱条件等进行确认。在除菌过滤工艺环节应对膜材质进行筛选确认并验证。应有稳定性数据支持灌装工艺的操作时长,应考察AAV制品与包装材料和给药器具的相容性,增强临床剂量的准确度和临床给药的安全性。
七、基因治疗制品的质量研究及质量控制
基因治疗制品的质量研究应贯穿于制品全生命周期,在质量源于设计(QbD)的理念下,从生产工艺设计(制品特性的研究)、生产准备(原辅料、种子批和细胞库的检定)、生产纯化(工艺的验证)、原液成品(放行标准的制定)、效期制定(稳定性研究)进行质量研究,控制质量风险,确保制品的安全性、有效性和质量可控性。放行检验研究包括:如何设立质量控制项目、质量控制方法的选择和标准限度范围等;方法学研究及标准物质研究;成品稳定性研究及质量评价项目设立原则等。
1、基因治疗制品的质量控制研究与风险评估
风险评估既是一种方法或手段,也是一种思维方式。基因治疗制品的质量风险评估贯穿于全生命周期质量控制体系,其中的风险识别尤其重要,因为这是风险评估的开端。
风险分析是风险评估中的重要环节,基因治疗制品的特殊性和复杂性都对制品质量风险分析提出了更高的要求,这一过程涉及到制品生产工艺的各个相关环节。
在工艺研究中应先明确产品目标质量概况,利用对制品特性认识、前期研发的经验和行业的先验知识等通过风险评估方法如风险排名、故障模式影响分析 (Failure Mode and Effects Analysis, FMEA)等适宜的工具进行关键质量属性(CQA)和关键工艺参数(CPP)的评估,并将评估的结果输出到工艺研究中。在工艺研究中,可结合实验设计(DoE)工具进行工艺开发验证。应结合制品特点,对于制品工艺特性关联较大的杂质进行充分研究。
基于质量源于设计(QbD)的整体框架有助于建立系统化、以目标为导向的制造工艺开发流程和全面的分析控制策略。而风险评估作为实践的重要方式,最大的好处是利用各种基于风险的方法确保流程保持在适当的限制范围内,并减少开发工作的随机性,有利于将已有先验知识和开发实验数据有效地结合,从而科学地识别基因治疗制品的关键物料属性(起始原材料及原材料)、不同阶段产品的关键质量属性(中间品、原液、成品、稳定性研究样品)。
2、基因治疗制品的关键质量属性(CQA)的确定
在基因治疗药物的设计和生产中,根据预期的目标产品质量概况,如预期适应证和临床用途、给药途径,剂型,给药系统、规格等,建立药物研发的设计基础。根据已有的先验知识和不断开展的早期研究,采用适当的风险工具如风险排名、故障模式影响分析,依据每一步有可能带来的质量风险,定义重大、中度和轻度风险并赋值,确定相应的关键质量属性并进一步评估工艺开发关键工艺参数,制定工艺及分析质控的策略,以确保产品安全性和工艺稳定性。
对于病毒载体类基因治疗制品,影响其安全性和稳定性的因素包括但不限于产品相关杂质、工艺相关杂质、含量的变化、核酸和蛋白外壳的表征属性以及一些安全性因素。其中涉及的检验项目包括野生型/复制型病毒检测、聚集体比例、空实比、宿主DNA残留量、残留宿主DNA片段大小、宿主蛋白残留、生产用原材料残留、含量、纯度、鉴别、装量/装量差异、生物学活性、无菌检查、支原体检查、内外源病毒检查、细菌内毒素检查、异常毒性检查、水分(若为冻干制剂)、外观(若病毒变化会引起颜色、澄清度的改变)、可见异物、不溶性微粒等。
3、基因治疗制品的表征分析方法
基因治疗制品的表征分析主要是指采用分析技术手段对产品序列、结构和理化性质等特征的分析检测和研究。根据产品特点,病毒载体类基因治疗制品的表征分析方法的确定可从核酸水平、蛋白外壳水平以及完整病毒颗粒整体水平上考虑。在核酸水平,需要分析重组载体基因组的完整性和均一性,包括对全基因组/关键基因的测序(如NGS等)、突变位点的PCR鉴别、对基因组的限制性酶切图谱、琼脂糖电泳、毛细管电泳检测碱基对大小等。在蛋白水平,可进行鉴别试验[如免疫印迹(WB),酶联免疫吸附试验(ELISA)等]、氨基酸序列分析[如液质联用(LC-MS)等]、翻译后修饰研究(如LC-MS等)、修饰位点确定(如LC-MS等)、质量肽图分析(如LC-MS等)、电荷异质性分析[如毛细管等电聚焦(cIEF)、离子色谱(IEC-HPLC)等]、蛋白分子量测定[如毛细管电泳(CE)、LC-MS等]、异构体/聚集体研究[如分子排阻色谱(SEC-HPLC)等]等。在病毒颗粒整体水平上,则进行颗粒属性分析[如电镜、分析型超速离心检测、动态光散射法(DLS),差示扫描荧光法(DSF)、SEC-HPLC、紫外光谱检测等]。
4、基因治疗制品质控项目的设置
《基因治疗产品非临床研究与评价技术指导原则(试行)》规定“质量研究内容应覆盖所有可能与产品安全性、有效性相关的特性,一般包括结构、鉴别、一般理化特性、纯度、生物学活性、基因转导效率、杂质、基因型、表型等,具体研究项目应根据产品类型、作用机制、原材料和生产工艺决定”。《溶瘤病毒产品药学研究与评价技术指导原则(试行)》规定“质量研究项目需全面充分,尽可能涵盖所有可能与产品安全性、有效性相关的质量项目,一般包括鉴别和结构分析,生物学活性,含量,纯度、杂质和污染物,以及其他特性等”。具体检验项目应基于产品类型、生产工艺、质量研究、稳定性和风险评估等确定,一般包括以下项目:
(1)鉴别试验。根据基因治疗制品的情况,应在核酸序列水平采用限制性酶切图谱分析、PCR、RT-PCR、核酸序列测定等方法对载体基因、目的基因、缺失片段以及其他影响目的基因表达的重要部分和基因型进行鉴定。还可同时在蛋白水平采用电泳、免疫印迹、免疫中和试验等方法,对结构蛋白、表达产物、表型特征等进行鉴别。
(2)纯度和杂质。在适用的情况下,可采用HPLC、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、紫外吸收(如A260/A280比值测定)、分析型超速离心法(AUC)等方法评估总纯度。
对于工艺相关杂质的检测应包括宿主细胞成分和工艺添加物的残留。如来自生产细胞基质或细菌的宿主细胞蛋白可采用ELISA、质谱等方法进行分析,宿主细胞DNA总量检测可采用DNA杂交、Pico-Green、Q-PCR、数字PCR等方法,残留宿主DNA片段大小检测可采用Q-PCR和/或毛细管电泳等方法,风险基因E1A检测可采用Q-PCR、数字PCR等方法;若在生产中使用了辅助病毒以及质粒DNA可采用Q-PCR等方法进行检测,牛血清、核酸酶、抗生素可采用ELISA进行检测等;若在生产中使用了其他对人体有害的试剂(如有机溶剂等),以及转染试剂、亲和配基、裂解试剂、超速离心介质等,也应在制品放行检验中采用ELISA、HPLC等方法进行检测。若在生产过程中使用致瘤细胞系,总残留DNA水平应严格控制并保持在最低水平。
某些工艺相关杂质对人体危害较小,经充分验证,证明生产工艺可以将其有效去除,可不列入常规放行检验项目。
产品相关杂质包括:复制型病毒或野生型病毒,可采用Q-PCR、噬斑法等方法进行检测;病毒的聚集体、裂解物、空壳等非功能形式,可采用HPLC、AUC法等方法进行检测;共包装的非目的基因序列(如包装错误基因的AAV),可尝试碱性琼脂糖电泳、CE、AUC、质谱、NGS等方法进行检测。
对于质粒应控制不同质粒形态的比例。其中在AAV的生产中,可采用琼脂糖凝胶电泳、毛细管电泳、AEX-HPLC等检测质粒超螺旋比例。
(3)生物学活性。根据制品具体情况应建立至少1个生物学活性指标,其属性反映制品的生理和/或药理作用模式。活性测定通常包括对基因转移效率(感染性/转导效率/传递效率)(如TCID50、Q-PCR等)、目的基因表达水平(如Western Blot、ELISA等)、表达产物功能或整个制品的直接活性进行评估。在可能情况下,活性测定应在确定基因治疗制品的量效关系基础上对目的基因或其产物的功能活性进行定量测定。首先应考虑开发体外生物效价检测方法,通常是在体外感染、转染或转导易感细胞系,然后进行目的基因表达产物的一些功能测定(如测定酶活性、细胞生长的刺激或抑制、报告基因法等)。当转基因表达的生物学功能表现出的活性范围过宽或仅能产生半定量甚至仅为定性结果时,需使用ELISA或其他具有严格规定范围的免疫学或生物化学读数的方法测定治疗序列的表达水平,作为补充或替代的活性测定方法(若该方法可获得广泛的特性数据证明所有表达的蛋白质都具有生物活性,则可替代生物活性测定方法)。若体外方法不可行,应考虑在动物离体组织或整个动物上的检测方法,适当情况下,可采用转基因动物或移植了人体组织或系统的动物。活性测定需要建立相应的活性标准物质或参比物质,用于计算被测试制品的相对效价或作为对照。溶瘤病毒还应检测溶瘤活性(如TCID50法,即细胞半数杀伤时的病毒MOI值)和选择性增殖(一般采用噬斑法或Q-PCR法)或选择性杀伤活性(如TCID50法或Q-PCR法)。
(4)含量。应对病毒总颗粒数(如ELISA、A260/A280、HPLC等)、感染性滴度/感染性颗粒数(如TCID50、噬斑法等)、基因组DNA/RNA 或质粒的拷贝数(如Q-PCR、数字PCR等)进行适宜的组合来测定原液和成品的含量,并用参比物质/对照物质进行比较计算或对照控制。在制品为病毒载体等情况下,还应进行感染性滴度/颗粒数(或基因组滴度)比例的测定和控制。
(5)一般安全性试验。在生产的各个步骤中,因环境因素和原辅料引入会带来微生物污染的风险,具体引入的微生物种类根据制品的具体情况而定,可开展无菌检查、细菌内毒素检查、异常毒性检查、支原体检查、分枝杆菌检查、外源病毒因子检测等。若病毒载体对于安全性试验有影响,可采用中和抗体中和掉制品本身的病毒毒性后,再进行检测。具体检测方法与其他生物制品一致,可参见2020年版《中国药典》。
(6)其他检测项目。应根据相关制品的特性而定,通常的检测项目包括外观(如性状、颜色)、可见异物、不溶性微粒、pH值、渗透压摩尔浓度、装量、水分和赋形剂。根据具体情况或具体剂型检测其他物理化学性质,如平均粒度及分布、乳光、折射率、平均Zeta 电位、平均包封率、释放效应等。具体检测方法参见2020年版《中国药典》。
在检测项目的设置上,应根据制品的自身特点,分别在制品的生产各阶段全面合理地开展,以充分论证产品的安全性、有效性和工艺的稳定性。
在基因治疗的质量研究中,不只包含上述已列出的检验项目,还应包括稳定性检查,以及根据制品自身特点增加的相应检项。在质量研究过程中,应根据实际情况,尽可能地开发和采用灵敏度高、专属性好的方法来验证产品的安全性和有效性,并用多种方法相互印证,以不断增进对制品的了解。基因治疗制品的质量研究贯穿该类制品的研发、生产和上市使用全生命周期,是随着科技和认识水平的不断提升而不断完善和提高的过程。
5、检测项目的分析方法选择和标准限度制定
质量标准是保证产品质量稳定、安全有效的质量控制策略的重要组成部分,质量控制项目的制定,应重点关注已证明的在产品安全有效方面有意义的结构表征和生物学活性等方面,即关键质量属性(CQA)。根据CQA来制定质控项目,选择的质控方法应切实反映相应特性变化,方法的自动化程度和普及性也应作为考量因素。质量控制方法的建立,建议参照ICH Q14和Q2相关要求开发并经过充分的验证。定量试验应包括方法的线性、使用范围、准确度、精密度(包括重复性和中间精密度)、检测限、定量限和耐用性等验证项目;定性试验应包括特异性、灵敏度、耐用性等验证项目。
质量标准的制定以控制最终产品的质量和批间一致性为目的,包括检验项目、分析方法、标准限度。制定质量标准,应首先确定检验方法,并在保证制品安全性的前提下,充分考虑制品有效性和本身特点,兼顾生产工艺的稳定生产范围,结合检测方法的变异性,通过多批次产品的测定并进行统计学分析来制定一个合理的限度范围。
6、病毒载体的滴度和比滴度
病毒载体的滴度按不同层面可以分为总颗粒数、基因组滴度和感染滴度。总颗粒数即病毒颗粒含量,一般可采用ELISA方法测定。基因组滴度是病毒基因组拷贝数,通常通过Q-PCR法或数字PCR法进行定量。感染滴度是具有感染活性的病毒颗粒含量,对于具有细胞杀伤能力的病毒,通常采用细胞病变法(如PFU或TCID50法)进行病毒感染滴度的测定;对于不具有细胞杀伤能力的病毒,虽然不能直接观察,但是可通过检测是否有病毒基因扩增,从而间接使用TCID50法进行测定。
比滴度通常以感染滴度与总颗粒数的比值或感染滴度与病毒基因组滴度的比值来表示,其可以反映单位病毒的感染能力,是表征制品特性的一个指标。比滴度可间接衡量制品的有效性、免疫原性,也可直接衡量工艺的稳定性,因此,需要对其加以规定和控制。
7、复制型病毒或野生型病毒的检测
对于基因治疗制品,通常为非复制型病毒载体,为保证其安全性,需要对复制型病毒进行控制。目前,复制型病毒检测方法除了针对复制相关基因的PCR法,还包括敏感细胞感染试验法。敏感细胞感染试验法是将待测样本接种于敏感细胞上进行多次传代以扩增潜在的复制型病毒,在培养末期
通过观察病变、检测复制相关基因等方式判断样本中是否有复制型病毒。复制型病毒检测方法要求具有较高的灵敏度,对方法进行建立及验证时,可以采用复制型病毒作为阳性对照,同时,设置灵敏度对照,验证方法的最低检出水平。对于有安全级别要求的病毒,应考虑在相应的生物安全实验室中进行。
对于溶瘤病毒制品,其本身就是复制型或条件复制型病毒,通常会改造病毒基因组以降低其对正常细胞杀伤性或增强肿瘤细胞靶向性。在病毒包装或生产过程中,这些病毒可能会通过重组或回复突变形成野生型病毒。为保障产品安全性,需要控制野生型病毒,可以考虑针对病毒种子与野生型病毒在核酸序列或生长特性方面的差异,建立适宜的方法对野生型病毒进行检测。
对于非产品相关的内、外源复制型病毒的检查,应采用以非特异性方法为主、特异性方法重点补充的检查原则;对于需要用中和抗体中和后进行的检查,应对可能漏检的病毒(可能被中和抗体一起中和的病毒)进行特异性检查补充。对于复制型病毒或野生型病毒的检查不能放弃对检测量和检测灵敏度的追求,即只承认在现有方法下未检出。为避免误判,检查过程应小心谨慎,逐步证明在制品中是否有非目标“活”病毒存在。
8、病毒载体工艺相关杂质的质量控制要求
病毒载体的工艺相关杂质主要包括宿主DNA残留、宿主蛋白残留及其他生产用物料残留等,若生产中使用了质粒或辅助病毒,还应考虑质粒DNA或辅助病毒残留。残留物质越少越好,然而在实际生产过程中,残留物质难以完全去除。对于各种残留物质,应基于风险评估的原则,加以科学控制。
宿主蛋白在人体内会引发免疫反应,影响产品的安全性和有效性,应采用高灵敏度的分析方法检测产品的宿主蛋白残留。在工艺过程中,应测试和分析纯化不同阶段的宿主蛋白残留量,从而评估工艺的清除能力,并结合给药剂量评估产品中宿主蛋白残留的可接受标准。
宿主DNA残留则有可能引入致瘤性和致感染性的风险。而对于含有已知致癌基因的宿主细胞,如SV40和大T抗原基因、myc以及活化的ras基因等,则要严格控制此类基因的残留。
目前,CDE关于基因治疗产品相关指导原则提出对宿主DNA残留片段的规定,这有助于进一步降低宿主DNA残留所带来的致癌性和致感染性风险。根据目前的研究显示,最小功能基因的大小约为200 bp。
9、质粒DNA残留的质量控制要点
在AAV的三质粒生产中,质粒作为一种生产起始原材料,需要对其残留予以检验和控制。制品中质粒DNA残留的质量控制,主要用Q-PCR扩增特定区域检测。为简化检验步骤,该区域最好为转染的三质粒所共有;为明确区分质粒DNA、宿主DNA和重组AAV病毒DNA,该区域不应在宿主基因组和重组AAV病毒基因组中出现。针对该区域设计特异性引物,建立Q-PCR或数字PCR检测方法,并进行验证后,纳入质控项目。
10、基因治疗制品检测方法验证和可接受标准
基因治疗制品不是一个“纯”的单一物质,是包括蛋白、核酸和糖组成的复杂结构,而且病毒类基因治疗制品是有活力的病毒载体。出于生物安全性考量,对于活病毒载体的检验仍须是全面严谨的,方法的验证也须是科学完整的。病毒类基因治疗制品在检验方法的建立和验证过程中,要同时考虑核酸和蛋白外壳两方面因素,在检测方法的建立和验证过程中,应考虑不同因素之间的干扰,相较于其他的治疗类生物制品更为复杂。
确定可接受标准是一个必须面对的难题,不在于定多少量值,而在于定的是否科学合理。当有法规或行业标准可以参考时,若符合实际情况,可直接套用或借用。但是,在没有任何可参考的情况下,方法验证中的相关参数可以借鉴如重复性、定量限(LOQ)等,长期和多批次数据积累的回顾性分析数据(如95%的可信区间)也可用作可接受标准。
11、标准物质的使用
在基因治疗制品质量控制的各个阶段,标准物质可以简化检验方式,减小误差,是质量检验的一把标尺,可应用于质量控制的各个阶段。
(1)质粒DNA标准物质,主要用于PCR鉴定、限制性酶切图谱。
(2)病毒理化对照物质,因病毒类基因治疗制品的复杂性,该类标准物质很难覆盖所有理化项目,可根据不同的检验项目制定不同标准物质,如病毒颗粒数标准物质(可用于病毒颗粒数检测和蛋白外壳鉴别)、基因组滴度标准物质、感染滴度标准物质、AAV空壳标准物质等。
(3)病毒活性标准物质,对于插入的外源基因,可使用该基因所表达蛋白的相应活性标准物质。溶瘤病毒类则可加入溶瘤活性标准物质。
(4)系统适用性对照品:分离度对照(纯度)、灵敏度对照(复制性病毒、野生型病毒)、阳性对照、阴性对照等。标准物质的制备应遵循标准物质相关规定,在其使用领域进行充分验证,包括重复性、准确性、稳定性等。
12、标准物质的研制
标准物质的研制一般包括:①对候选标准物质的质量检验;②对候选标准物质的协作标定,至少需要3家实验室;③对候选标准物质的稳定性研究。稳定性研究包括强制条件试验、加速稳定性研究、长期稳定性研究等。强制条件稳定性研究是为考察各种极端因素对产品的影响,了解影响稳定性的因素及可能的降解途径与降解产物,为长期稳定性研究提供依据。包括高温、反复冻融等,再检测候选标准物质的关键质量属性,如病毒的外观、可见异物、不溶性微粒、含量、活性、无菌等;质粒的A260/A280、超螺旋比例、PCR鉴别、限制性酶切图谱等。加速稳定性通过提高存放温度探讨药物的稳定性,为长期稳定性研究提供依据,具体包括不同温度下候选标准物质的CQA稳定性验证。长期稳定性是在实际储存条件下开展的稳定性研究,可以作为设定产品保存条件和有效期的主要依据。标准物质的制备和标定可参考2020年版《中国药典》三部“生物制品国家标准物质制备和标定规程”。
13、原液和成品质量控制策略
原液(DS)和成品(DP)在质量控制中,都是重要的质控点,其中DP为终点质控点;DS为分装前生产过程控制质控点,对分装定量具有重要意义。
成品在原液的质量控制基础上,要考虑由原液到成品这一步所引入的辅料风险和污染风险。在质量研究中,应在原液和成品中全面考虑与制品特性、安全性、有效性和工艺稳定性相关的技术指标。
DS和DP的检验共同构成了制品的放行检验。应根据检测项目的特性与风险制定相应的质量控制策略,将检测项目分别放在DS和DP阶段,部分项目若无法在DP或DS中进行检测,或采用其他中间过程控制阶段的样品进行检测更有利于对产品质量进行控制时,可以考虑通过检测适当的中间产物对产品的质量进行控制。
14、基因治疗制品的放行检验
按照2020年版《中国药典》三部“人用基因治疗制品总论”的要求,基因治疗制品的放行检验主要从结构确证、有效性、必要的安全性等方面展开。选择切实可以控制制品质量的检测项目组成放行标准,对于不能产生实际质量控制作用的检测项目,经风险评估后可不纳入。对于设置检验项目所在生产流程的具体位置,可根据制品特性和工艺特性选择在适宜的生产过程控制质控点。同时,还应兼顾检测成本和可及性。
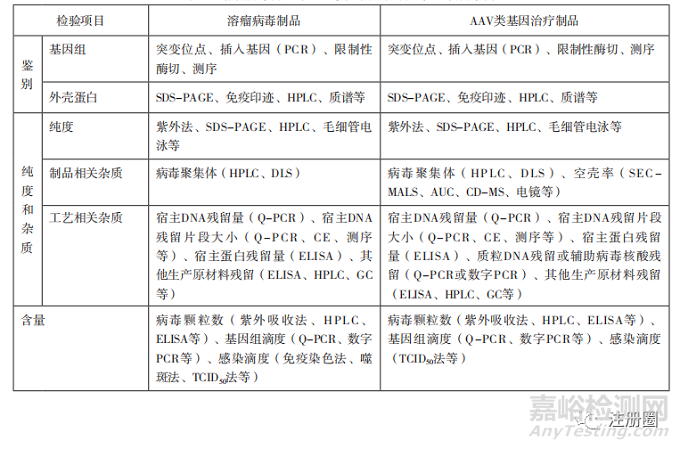
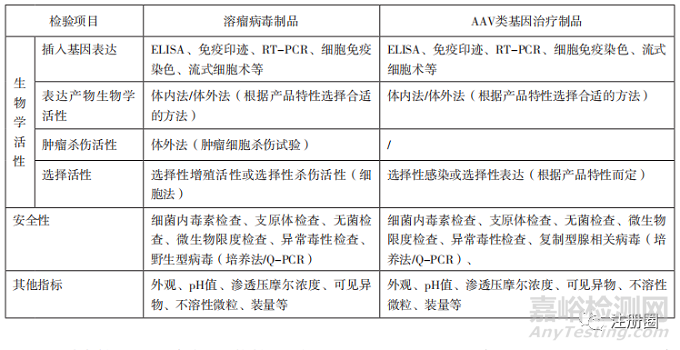
下文选取条件复制型病毒中有代表性的溶瘤病毒制品,非复制型病毒中有代表性的AAV类基因治疗制品,将建议选择采用的检验项目如表2列举。
表2-溶瘤病毒制品与 AAV 类基因治疗制品检验项目举例
基因治疗制品强调生产全过程控制,原液过程控制质控点和质量标准的设置,更有利于生产工艺的平衡和后续不同规格的申报。
15、AAV基因治疗制品病毒空壳率的控制
不同AAV制品的病毒空壳率差异显著,导致的原因很多,如产品特性的不同(病毒血清型及插入外源基因差异)、包装体系的不同(三质粒系统/杆状病毒系统)、纯化工艺的不同(超速离心/离子交换层析)、分析方法的不同(AUC/离子交换层析/SEC-MALS)。目前,各种指南都建议对AAV基因治疗制品的空壳率进行控制,但控制范围、设定原则和标准还没有统一。当前各制品均缺少病毒空壳详实的药效研究,评价空壳率与药效的相关性,需要基于安全性和有效性的考虑,综合考虑产品特点、临床试验情况、分析方法变异性等。
16、核酸酶残留限度的考量
在病毒类基因治疗制品的生产中,不管是复制型病毒载体生产中涉及的宿主DNA,还是非复制型病毒载体生产中所涉及的宿主DNA和质粒DNA,均需要在工艺中进行去除。目前,生产企业一般采用核酸酶去除制品中的游离核酸。这一过程可能会带来核酸酶残留,需对其加以控制。这类工艺相关杂质的可接受水平和标准限度,需要结合非临床和/或临床数据或研究经验及业界与监管共识等合理制定。
17、基因治疗制品中宿主DNA残留(HCD)限度
和核酸片段大小的控制各种指南中都建议对宿主细胞 DNA 残留量和片段大小进行控制,生产中若使用了肿瘤细胞系(如 Hela 细胞),或携带致癌基因、病毒改造序列的细胞(如 HEK293T),建议尽量将残留 DNA控制在 10 ng/剂以内,将 DNA 残留片段大小控制在 200 bp 以下。目前的工艺条件下很难实现这个要求,需要生产企业不断改进生产工艺提高产品质量,同时开发出科学合理的检测方法。
八、基因治疗制品的稳定性研究
以病毒为载体的基因治疗制品具有遗传不稳定性和变异性,如何保证制品在货架期的稳定存在和在运输时的恶劣环境下稳定存在以及使用时对温度变化耐受等,都需要实验来模拟回答。影响稳定性的因素可能包括:内包材溶出物、储存时长、运输颠簸、高温、光照等。稳定性的研究就是对制品在使用期间出现的特殊情况造成的影响给予预测性提前回答,是制品商业化的重要保障方案之一。
1、基因治疗制品中与稳定性相关的特性
基因治疗制品是一类特殊的生物制品,与蛋白药物相比,病毒载体类基因治疗制品具有自身的特点:有效成分是具有核酸和蛋白质的生命体,受环境条件变化的影响较大,对热、紫外线、冻融等因素特别敏感,病毒颗粒在保存过程中容易聚集,剂型大多为液体(因冻干过程对其生物学活性具有明显影响)等,应根据制品的特点,开展相应的稳定性研究。
2、基因治疗制品稳定性研究的主要内容
开展稳定性研究之前,需建立稳定性研究的整体计划或方案,包括研究样品、研究条件、研究项目、研究时间、运输研究、研究结果分析等方面。稳定性研究一般包括长期稳定性研究、加速稳定性研究和强制条件试验研究。长期稳定性研究是在实际储存条件下开展的稳定性研究,可以作为设定产品保存条件和有效期的主要依据。加速稳定性研究是在高于实际储存温度条件下开展的研究,对于病毒类制品,建议温度一般设置为-20 ℃和4 ℃,25 ℃和37 ℃为较高温度,一般作为高温条件。强制条件试验研究是在极端情况下进行的稳定性研究,如高温、光照、振动、反复冻融、氧化等。加速稳定性研究和强制条件试验研究可以为长期稳定性研究方案提供支持性数据。
3、基因治疗制品稳定性研究的样品要求
基因治疗制品稳定性研究的样品通常包括原液和成品,对因不能连续操作而需保存一定时间的中间产物也应进行相应的稳定性研究,原液若直接灌装成成品则无需进行原液的长期稳定性研究。稳定性研究的样品批次数量应至少为3批。稳定性研究样品的生产工艺与质量应一致(即具有代表性),研究用成品应来自不同批次原液。成品稳定性研究应采用与实际贮存相同的包装容器与密闭系统;原液或中间产物稳定性研究可以采用与实际应用相同的材质或材料的容器和密封系统。对于规格不同的样品,稳定性数据不能互相代替,最高规格和最低规格应至少各检定3批,中间规格的制品可依据不同浓度规格之间的内在联系及相互支持适当减少研究批次,但是检测项目必须完整。
4、基因治疗制品稳定性研究的考察条件
稳定性研究条件应充分考虑到今后的贮存、运输及其使用的整个过程。根据对各种影响因素(如温度、湿度、光照、反复冻融、振动、氧化、酸碱等相关条件)的初步研究结果,制定长期、加速和强制条件试验等稳定性研究方案。
温度:长期稳定性研究的温度条件应与实际保存条件相一致,原液的温度可设置为4 ℃或(-70±10)℃,成品的温度可设置为(-70±10) ℃;病毒载体类制品一般不需要强制降解试验;加速稳定性研究的温度条件一般介于长期与强制条件试验之间,通常可以反映产品可能短期偏离于实际保存条件的情况,可设置4 ℃、25 ℃和37 ℃。
反复冻融:成品的保存温度一般为(-70±10)℃,在生产、运输和使用过程中可能会发生冻融,应验证在多次反复冻融条件下产品质量的变化情况。
光照:病毒对紫外线敏感,成品在使用过程中可能受到光线中紫外线的照射,应考察光照对产品质量的影响。
湿度:若能证明包装容器与密封系统具有良好的密封性能,则不同湿度条件下的稳定性研究可以省略;否则,需要开展相关研究。临床用药情况:对于一些基因治疗制品,若单次给药时间较长的(如静脉滴注)、使用前需要配制或合并的,应开展相应的稳定性研究,以评估实际使用情况下产品的稳定性。
5、基因治疗制品稳定性研究的检测项目
检测项目应包括产品质量变化敏感的,且反映产品安全性和/或有效性的考查项目,如效价、纯度、杂质和含量等。对于病毒载体类产品稳定性研究可参照《生物制品稳定性研究技术指导原则(试行)》和ICH Q5C要求,结合产品特性确定检测项目。
(1)活性:活性是稳定性研究中的重点研究项目,活性测定通常包括对基因转移效率(感染性/转导效率/传递效率)、治疗序列表达的水平、表达产物的功能或整个制品的直接活性(如肿瘤细胞杀伤活性等)的测定。活性应尽可能地采用定量的方法测定。活性测定需要采用相应的活性标准物质或参比物质,使用的参考品应该是经过标准化的物质,还需要关注应用参考品的一致性和其自身的稳定性。
(2)纯度和杂质:可采用HPLC、SDSPAGE、紫外吸收(如A260/A280比值测定)等方法评估产品的总纯度水平。杂质包括制品相关杂质和工艺相关杂质,其中制品相关杂质的含量更能反映产品的稳定性,应分析载体降解及聚集情况。在强制因素研究中经过检测工艺相关杂质若未显著变化,可经过评估不列入长期稳定性考察项。降解产物的限度应根据临床前研究和临床研究所用各批样品分析结果的总体情况来制定。长期稳定性研究中,若发现有新的降解产物出现或者是含量变化超出限度时,建议对其进行鉴定,同时开展安全性与有效性的评估。
(3)含量:应对总颗粒数、感染性滴度或感染性颗粒数、基因组DNA/RNA进行分析,还应对总颗粒数或基因组拷贝数等物理数量与感染性滴度的比例进行测定。
(4)颗粒特性:病毒载体类基因治疗制品的颗粒特征容易受到贮存时间、温度、反复冻融等因素的影响而发生变化,是反映制品稳定性的重要指标,应进行考察,检测项目包括:可见异物、不溶性微粒、粒度和粒度分布、折射率、聚集体分析等。
(5)其他:一些检测项目也是稳定性研究
中较为重要的方面,需要加以关注,如外观、pH值、无菌检查等。在特殊条件下,选用替代方法需要经过充分的验证后使用,如采用容器密封完整性测试替代稳定性研究过程中的无菌检查等。使用非破坏性容器密封完整性测试方法检测的样品,也可用于其他不受影响的质控检测项目。添加剂或赋形剂在制剂的效期内也可能降解,若初步稳定性试验有迹象表明这些物质的反应或降解对药品质量有不良影响时,应在稳定性研究中加以监测。稳定性研究中还应考虑到包装容器和密封系统可能对样品具有潜在的不良影响,在研究设计过程中应关注此方面,如增加包装系统密封性检测。
6、基因治疗制品稳定性研究的时间设置
对于成品,若有效期为2年及以上,则需在第12个和第24个月,分别进行一次考察项目的检测,并在24个月后,根据具体稳定性研究目的设置适当的时间间隔进行考察项目的检定。对于有效期为1年以内的成品,则每3个月进行一次考察项目的检测。长期稳定性研究时间点设定的一般原则是,第1年内每隔3个月检测1次,第2年内每隔6个月检测1次,第3年开始可以每年检测1次。若有效期(保存期)为1年或1年以内,则长期稳定性研究应为前3个月每月检测1次,以后每3个月1次。在某些特殊情况下,可灵活调整检测时间,如基于初步稳定性研究结果,可有针对性地对产品变化剧烈的时间段进行更密集的检测。原则上,长期稳定性研究应尽可能地做到产品不合格为止。产品有效期的制定应根据长期稳定性研究结果设定。强制和加速稳定性研究也应尽可能地观察到产品不合格。
7、基因治疗制品的运输稳定性研究
基因治疗制品要求冷链运输,对产品的运输过程应进行相应的稳定性模拟验证研究。稳定性研究中需充分考虑运输路线、交通工具、距离、时间、条件(温度、湿度、振动情况等)、产品包装情况(外包装、内包装等)、产品放置情况和监控器情况(温度监控器的数量、位置等)等。稳定性研究设计时,应模拟运输时的最差条件,如运输距离、振动频率和幅度及脱离冷链等。通过验证研究,应确认产品在运输过程中处于拟定的保存条件下可以保持产品的稳定性,并评估产品在短暂的脱离拟定保存条件下对产品质量的影响,应对产品脱离冷链的温度、次数、总时间等制定相应的要求。
8、基因治疗制品稳定性研究的结果分析
稳定性研究中应建立合理的结果评判方法和可接受的验收标准。研究中不同检测指标应分别进行分析,且应对产品进行稳定性的综合评估。同时,开展研究的不同批次的稳定性研究结果应该具有较好的一致性,建议采用统计学的方法对批间的一致性进行判断。同一批产品,在不同时间点收集的稳定性数据应进行趋势分析,用以判断降解情况。验收标准的制定应在考虑到方法学变异的前提下,参考临床用研究样品的检测值对其进行制定或修正,该标准不能低于产品的质量标准。通过稳定性研究结果的分析和综合评估,明确产品的敏感条件、降解途径、降解速率等信息,制定产品的保存条件和有效期(保存期)。
九、结束语
本概述汇总了基因治疗制品研发、生产和质量控制中的常见问题,以2020年版《中国药典》、CDE和ICH指导原则为基础,参考其他指南和规范,结合部分行业专家的经验和意见建议,撰写本考虑概述,希望给从业者、行业研发和质量控制人员以启发,共同推动基因治疗行业质量控制的进步,促进产业的健康发展。
参考文献
[1] 中华人民共和国药典:三部[S]. 2020:52-56,凡例,5-7,11-20.
[2] 国家药品监督管理局药品审评中心. 体内基因治疗产品非临床研究与评价技术指导原则(试行)(2021年第49号)[EB/OL].(2021-12-03)[2023-04-03].
https://www.cde.org.cn/main/news/viewInfoCommon/41bc557bec23a6ebfb0e148cc989f041.
[3] 国家药品监督管理局药品审评中心. 溶瘤病毒产品药学研究与评价技术指导原则(试行)(2023年第2号)[EB/OL].(2023-02-10)[2023-04-03].
https://www.cde.org.cn/main/news/viewInfoCommon/09618d0682fc9161adc0a3f63de486f6.
[4] 国家药品监督管理局药品审评中心. 预防用DNA疫苗临床前研究技术指导原则[EB/OL].(2003-03-20)[2023-04-03].
https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=bee5a01182004cca5c96f4d171cbdbbb.
[5] 国家药品监督管理局药品审评中心. 预防用以病毒为载体的活疫苗制剂的技术指导原则[EB/OL].(2003-03-20)[2023-04-03].
https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=fb0a8557c244ff9e658407cd299e0ed8.
[6] 国家药品监督管理局. 人基因治疗研究和制剂质量控制技术指导原则 [EB/OL].(2003-03-20)[2023-04-03].
https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=65a2d7ba914ad1e0ccd72e6a952b0dc6.
[7] 中华人民共和国卫生部. 卫生部令第79号 药品生产质量管理规范[S]. 2011.
[8] FDA. Guidance for Industry, Potency Tests for Cellular and Gene Therapy Products[S]. 2011.
[9] FDA. Guidance for Industry, Preclinical Assessment of Investigational Cellular and GeneTherapy Products[S].2013.
[10] FDA. Guidance for Industry, Manufacturing Considerations for Licensed and Investigational Cellular and Gene Therapy Products During COVID-19 Public Health Emergency[S].2021.
[11] FDA. Draft Guidance for Industry, Human Gene Therapy for Neurodegenerative Diseases[S]. 2021.
[12] FDA. Guidance for Industry and Food and Drug Administration Staff, Regulatory Considerations for Human Cells, Tissues, and Cellular and Tissue-Based Products: Minimal Manipulation and Homologous Use[S]. 2021.
[13] FDA. Guidance for Industry, Long Term Follow-up After Administration of Human Gene Therapy Products[S]. 2020.
[14] FDA. Guidance for Industry Chemistry, Manufacturing, and Control (CMC) Information for Human Gene Therapy Investigational New Drug Applications (INDs) [S]. 2020.
[15] FDA. Guidance for Industry, Human Gene Therapy for Hemophilia[S]. 2020.
[16] FDA. Guidance for Industry, Human Gene Therapy for RareDiseases[S]. 2020.
[17] FDA. Guidance for Industry, Human Gene Therapy for Retinal Disorders[S]. 2020.
[18] FDA. Guidance for Industry, Testing of Retroviral Vector Based Human Gene Therapy Products for Replication Competent Retrovirus During Product Manufacture and Patient Follow-up[S]. 2020.
[19] FDA. Draft Guidance for Industry, Interpreting Sameness of Gene Therapy Products Under the Orphan Drug Regulations[S]. 2020.
[20] FDA. Guidance for Industry, Evaluation of Devices Used with Regenerative Medicine Advanced Therapies[S]. 2019.
[21] FDA. Guidance for Industry, Expedited Programs for Regenerative Medicine Therapies for Serious Conditions[S].2019.
[22] FDA. Same Surgical Procedure Exception under 21 CFR 1271.15(b): Questions and Answers Regarding the Scope of the Exception[S]. 2017.
[23] FDA. Guidance for Industry, Deviation Reporting for Human Cells, Tissues, and Cellular and Tissue-Based Products Regulated Solely Under Section 361 of the Public Health Service Act and 21 CFR Part 1271[S]. 2017.
[24] FDA. Guidance for Industry, Recommendations for Microbial Vectors Used for Gene Therapy[S]. 2016.
[25] FDA. Guidance for Industry, Design and Analysis of Shedding Studies for Virus or Bacteria-Based Gene Therapy and Oncolytic Products[S]. 2015.
[26] FDA. Guidance for Industry, Considerations for the Design of Early-Phase Clinical Trials of Cellular and Gene Therapy Products[S]. 2015.
[27] FDA. CVM GFI #218 Cell-Based Products for Animal Use[S]. 2015.
[28] FDA, Guidance for Industry, Determining the Need for and Content of Environmental Assessments for Gene Therapies,Vectored Vaccines, and Related Recombinant Viral or Microbial Products[S]. 2015.
[29] FDA. Guidance for Industry, BLA for Minimally Manipulated, Unrelated Allogeneic Placental/Umbilical Cord Blood Intended for Hematopoietic and Immunologic Reconstitution in Patients with Disorders Affecting the Hematopoietic System[S]. 2014.
[30] FDA. Guidance for Industry and FDA Staff, IND Applications for Minimally Manipulated, Unrelated Allogeneic Placental/Umbilical Cord Blood Intended for Hematopoietic and Immunologic Reconstitution in Patients with Disorders Affecting the Hematopoietic System[S].2014.
[31] FDA. Guidance for Industry, Preclinical Assessment of Investigational Cellular and Gene Therapy Products[S].2013.
[32] FDA. Guidance for Industry, Preparation of IDEs and INDs for Products Intended to Repair or Replace Knee Cartilage[S]. 2011.
[33] FDA. Guidance for Industry, Clinical Considerations for Therapeutic Cancer Vaccines[S]. 2011.
[34] FDA. Final Guidance for Industry, Potency Tests for Cellular and Gene Therapy Products[S]. 2011.
[35] FDA. Guidance for Industry, Cellular Therapy for Cardiac Disease[S]. 2010.
[36] FDA. Guidance for Industry, Considerations for Allogeneic Pancreatic Islet Cell Products[S]. 2009.
[37] FDA. Guidance for FDA Reviewers and Sponsors, Content and Review of Chemistry, Manufacturing, and Control (CMC) Information for Human Somatic Cell Therapy Investigational New Drug Applications (INDs)[S]. 2008.
[38] FDA. Guidance for Industry, Eligibility Determination for Donors of Human Cells, Tissues, and Cellular and Tissue Based Products[S]. 2007.
[39] FDA. Guidance for Industry, Guidance for Human Somatic Cell Therapy and Gene Therapy[S]. 1998.
[40] EMA. Questions and Answers on Comparability Considerations for Advanced Therapy Medicinal Products (ATMP)[S]. 2019.
[41] EMA. The Overarching Guideline for Human Gene Therapy Medicinal Products is the Guideline on the Wuality, Non clinical and Clinical Aspects of Gene Therapy Medicinal Products[S]. 2014.
[42] EMA. Questions and Answers on Gene Therapy[S]. 2014.
[43] EMA. Reflection Paper on Design Modifications of Gene Therapy Medicinal Products during Development[S]. 2009.
[44] EMA. Reflection Paper on Quality, Non-clinical and Clinical Issues Relating Specifically to Recombinat Adeno associated Viral Vectors[S]. 2007.
[45] EMA. Considerations-Oncolytic Viruses[S]. 2008.
[46] EMA. Guideline on Quality, Non-clinical and Clinical Aspects of Medicinal Products Containing Genetically Modified Cells[S]. 2008.
[47] EMA. Guideline on the Non-clinical Studies Required before First Clinical Use of Gene Therapy Medicinal Products[S]. 2006.
[48] EMA. Guideline on Non-clinical Testing for Inadvertent Germline Transmission of the Gene Transfer Vectors[S].2005.
[49] EMA. Reflection Paper on Management of Clinical Fisks Deriving from Insertional Mutagenesis[S]. 2012.
[50] EMA. Guideline on Follow-up of Patients Administered with Gene Therapy Medicinal Products[S]. 2007.
[51] EMA. Guideline on Safety and Efficacy Follow-up and Risk Management of Advanced Therapy Medicinal Products[S].2008.
[52] EMA. Guideline on the Risk-based Approach According to Annex I, Part IV of Directive 2001/83/EC Applied to Advanced Therapy Medicinal Products[S]. 2013.
[53] USP 40. General Information <1047> Gene Therapy Products[S]. 2017.
[54] ICH Q5A(R2): Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin(Draft)[S]. 2022.
[55] ICH Q5C: Stability Testing of Biotechnological/Biological Products[S]. 1995.
[56] ICH Q5D: Derivation and Characterisation of Cell Substrates Used for Production of Biotechnological/Biological Products[S]. 1997.
[57] ICH Q5E: Comparability of Biotechnological/Biological Products Subject to Changes in their Manufacturing Process[S]. 2004.
[58] ICH Q6B: Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products[S]. 1999.
[59] ICH Q8(R2): Pharmaceutical Development[S]. 2008.
[60] ICH Q9: Quality Risk Management[S]. 2005.
[61] ICH Q10: Pharmaceutical Quality System[S]. 2008.
[62] ICH Q12: Technical and Regulatory Considerations for Pharmaceutical Product Lifecycle Management[S]. 2019.
[63] ICH Q2(R2): Validation of Analytical Procedures (Draft)[S].2022.
[64] ICH Q14: Analytical Procedure Development (Draft)[S].2022.
[65] 国家药品监督管理局药品审评中心. 已上市生物制品药学变更研究技术指导原则(试行)(2021年第31号)[EB/OL].(2021-06-25)[2023-04-03].
https://amr.hainan.gov.cn/himpa/HICDME/zcfg/yp/202107/t20210702_3004469.html.
[66] 国家药品监督管理局. 药品上市后变更管理办法(试行)(2021年第8号)[EB/OL].(2021-01-12)[2023-04-03].
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210113142301136.html.
[67] 国家药典委员会&中国食品药品国际交流中心. 治疗用生物制品病毒污染风险控制要点[EB/OL].(2021-01-15)[2023-04-03].
https://www.ouryao.com/thread-708222-1-1.html.
[68] EMEA. Guideline on Virus Safety Evaluation of Biotechnological Investigational Medicinal Products[S].2009.
[69] 国家食品药品监督管理局. 生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则[EB/OL].(2005-12-18)[2023-04-03].
http://gdcec.gd.gov.cn/publicfiles//business/htmlfiles/rzzx/cmsmedia/image/ypzcsp2/doc7644.pdf.