随着过程分析技术( process analysis technology,PAT) 在制药行业越来越受到重视,美国食品药品监督管理局( FDA) 等官方机构正在积极推动应用PAT 技术,力图从过程、工艺上保证产品的质量,改变目前主要依靠认证认可检查的现状。本文综述了制药行业中的PAT 相关法规/指导原则发展进程以及常用的PAT 工具和相关应用进展,为加强我国制药行业对PAT 的理解提供一定参考,推动制药企业将其融入生产过程,从药品质量的源头抓起,提高药品质量。
过程分析技术( process analytical technology,PAT) 是主要指以保证产品最终质量为目的,通过对药品制造过程中有关原料、辅料等物料以及工艺的关键参数及指标进行实时测定的过程,是实现质量源于设计( QbD) 理念的有效工具。采用PAT 用于优化制药工艺和质量控制,实现药品从研发到生产的技术衔接和产品质量一致性,从而实现制药工程项目的全生命周期管理。本文综述了PAT 在制药行业中的相关法规、工具及应用等现状,以期对我国制药行业发展有所启发。
1、制药行业中的PAT相关法规/指导原则
PAT 理念最早源于1993 年美国分析化学家协会(AOAC) 发起的一次论坛,后于2004 年由美国食品药品监督管理局(FDA) 正式发布了关于PAT 的制药工业指导原则[1-2]。同时也是制药工业的第一个正式的法规性指导原则。该指导原则的发布,使得越来越多的制药企业开始重视QbD 理念,并开始引入PAT 以实现药品生产过程的全程监控,以更好的保证药品的质量。
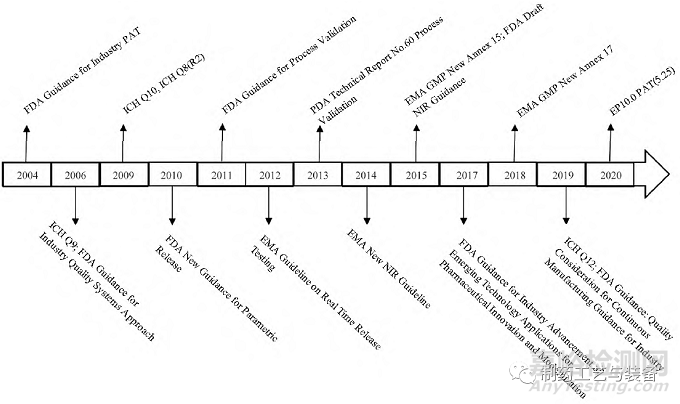
为了推行科学监管理念,鼓励制药企业不断创新与发展,各国监管部门和组织均对PAT 的相关指南、标准或应用作了极大的努力(图1) [3-5]。如FDA 于2006 年发布了动态药品生产管理规范(CGMP) 工业指南, 2011 年发布了改版的工艺验证指南, 2013 年美国注射剂协会发布的第60 号技术报告中,均在相关章节阐述了PAT 技术的重要性,以及相关技术规范及要求。2015 年FDA 又发布了工业界开发和申报近红外分析方法指导原则草案。同时人用药品注册技术规定国际协调会(ICH) 也发布了多个相关文件, ICH Q8、ICHQ9、ICH Q10 和ICH Q12 等,来表达产品开发、技术转移、商业化生产等行为中QbD 和PAT 理念的重要性,从而细化了PAT 在生产过程中需深刻理解的具体范围和要求,是实施PAT 所需的理论基础之一。
图1 欧美制药工业中过程分析技术( PAT) 相关指导原则概览
同时欧美制药发达国家的药典为协助或推进实行PAT技术,作了大量的工作,其中美国药典(USP) 两项最主要的工作是: 在其PAT 主要分析技术手段近红外光谱< 1119 >和拉曼光谱< 1120 > 章节中对二者作为PAT 应用工具的应用范围、技术要求、仪器设备性能确认等作了详细的说明和规定。欧洲药典(EP) 作为欧洲地区唯一的药品质量标准指导性文献,由欧洲药品质量管理局(EDQM) 出版发行,其在EP10. 0 最新版本中增加了目前全球唯一的专门性PAT药典指导原则: PAT(5. 25) 。其在具体内容中着重于描述分析技术与制造过程的衔接,以此作为加强过程控制和提高过程理解的手段。并同时还新增或修订了PAT 相关的多个技术章节,包括近红外光谱(2. 2. 40) 、拉曼光谱(2. 2. 48) 、化学成像(5. 24) 、化学计量学方法用于分析数据(5. 21) 等。
由上述欧美国家制药领域PAT 相关法规、指南及指导原则可知,PAT 技术于2004 年FDA 首次在制药工业提出至今,随着各类仪器技术的发展,以及连续制造(CM) 、智慧制造等理念的发展,PAT 技术已逐步从构思、实验室阶段逐渐向制药工业应用化发展,并对各国的药监部门如何监管审批提出了新的挑战。
2、制药行业中的PAT工具
PAT 中的分析是涉及多学科的综合分析,PAT 中的过程是贯穿于整个药品生产的过程。FDA 提出的PAT 测量包括3 种类型,即: 近线检测(at-line)、在线检测(on-line)、线内检测(in-line)。近线测量涉及将样品从工艺流程转移到分析设备,分析设备与工艺流程相互脱离,但又靠近工艺流程,使检测过程延迟小,因此可以根据测量的结果进行工艺调整。在线检测是将生产过程中的样品从生产装备中引出后自动引入分析仪器进行监测并根据试验性质决定转移的部分可否返回工艺流; 在线分析方式中,PAT 工具与生产流程分别作为侧线与主线组合在一起。线内检测通过在生产设备或流程内部需要检测质量的部位安装传感器或者测量探头进行分析工作,PAT 工具与生产设备往往可视作一体式。在线与线内2种检测方式将分析技术转移到过程流中,通常支持快速和自动化的过程调整。
相比传统的分析技术,PAT 具有以下优势: 促进参数的快速测试而不破坏样品; 可以立即做出关键决策和流程调整; 提高自动化程度,保证操作人员的安全性; 能够确定和解释所有的变异的关键来源; 使用的材料所建立的设计空间、工艺参数、制造、环境和其他条可以准确可靠地预测产品质量属性[6]。
目前,PAT 研究的分析工具包括光谱技术、光学成像技术,动态光散射、气相色谱(GC) 、质谱(MS) 、核磁共振(NMR) 、红外光谱(IR) 、紫外-可见光谱(UV-Vis) 及X 射线荧光(XRF) 等。其中制药行业研究最多,且应用最广的是光谱技术主要是: 近红外光谱(NIR) 技术、拉曼(Raman) 光谱技术[7]。
2.1近红外光谱
由于NIR是PAT最常用的分析工具之一,各国药典都有相关章节的收载。同时欧洲药品管理局(EMA) 和FDA都要相关的重要指导原则。2015 年FDA发布了工业界开发和申报近红外分析方法指导原则草案(< Development and submission of near infrared analytical procedures,Guidance for industry,Draft guidance >),该指导原则明确了制药工业在新药申请及申请主文件中采用NIR方法的开发、验证、变更需考虑的关注点以及需提交的文件资料。NIR光谱具有快速、无损和同时测定多种性质的优势,已逐步应用于药品生产的多个环节,如混合、干燥、压片、包衣、预处理、包装等,为生产过程提供在线、实时的质量信息[8]。
现代NIR技术由NIR仪、化学计量学软件技术和统计校正模型3个部分组成。一般操作流程是,根据样品的NIR谱图特性,采用适合的化学计量学方法,建立校正模型,实现定性、定量分析或者在线过程分析。此外,硬件部分,干涉仪的发展和应用促使傅里叶变换型光谱仪的抗震能力大大增强,可实现便携、车载的功能,大大增强了其应用于生产过程环境的适用性。
2.2拉曼光谱
尽管近红外光谱技术在制药行业仍占主导地位,但Raman光谱技术的利用正变得越来越广泛。Raman 光谱是一种非弹性散射光谱,因为其与入射光频率不同的散射光谱进行分析以得到分子振动、转动方面信息,并应用于分子结构研究的一种分析方法。
药物的生产过程很容易导致晶型转化,特别是当亚稳态的晶型作为主药的时候。药品开发过程中,最佳的剂型设计,辅料的正确选择,生产方式的制定,与溶出试验的监控是一套完整的流程。而Raman 光谱是唯一1个能够从药品分子的层次,适用于上述整个流程中每一环节的药品晶型实时监测的仪器[9]。
2020年版《中国药典》、USP、EP都提到了一种最新的拉曼光谱技术———空间位移拉曼光谱(SORS) ,SORS 可分析数毫米厚的样品,也可以对不透明包装内的材料进行化学分析。例如,乙醇是常用的医疗用品和有机溶剂,当其被装在透明聚对苯二甲酸乙二醇酯(PET) 塑料中。用传统Raman仅得到包装的光谱信息,而通过SORS 甚至能够获得21 mm厚度的PET 瓶内的乙醇谱图[10]。因此,SORS 能够轻松实现原辅料鉴别,减少物料开包检测带来的污染风险,更好地满足日益严格的法规要求。
2.3其他
除了上述提到的几种传统的PAT 工具,目前有越来越多的新型分析方法加入进来。激光诱导荧光技术(LIF) 是在药物制剂中进行荧光材料的选择(通常有效成分) 。LIF 技术是一种非破坏性的PAT 分析工具,用来分析搅拌动力学和混合一致性,以及药片有效成分的含量。LIF 在制药行业有非常大的用处,因为近两百种的活性成分中60%有发荧光的特性。在线LIF 的好处是获得实时混合动力学的结果和减少由于取样所导致的错误和时间浪费[11]。
聚焦光束反射测量技术(FBRM) 可以在原位条件下,实时追踪颗粒和液滴的变化情况。最初是作为实时在线颗粒表征技术而发明的,经不断研究与完善,现能对高浓度的浆料和颗粒体系进行实时测量。FBRM 独特的设计结构确保即使在高浓度及不透明的溶液体系下,依然能对颗粒粒径和相对颗粒数进行高重复性和高重现性的测量[12]。
激光诱导击穿光谱(LIBS) 技术通过超短脉冲激光聚焦样品表面形成等离子体,进而对等离子体发射光谱进行分析以确定样品的物质成分及含量。超短脉冲激光聚焦后能量密度较高,可以将任何物态的样品激发形成等离子体,LIBS(原则上) 可以分析任何物态的样品。LIBS 以其可原位、在线、同时分析多种元素成分的优点,成为流程工业现场检测关注的重要技术[13]。
2.4模型建立方法
在将PAT 工具用于制药过程监测时,由于物料体系复杂,待测关键工艺参数(CPAs) 或关键质量属性(CQAs) 的谱图信息可能相互重叠或被其他干扰信息掩盖,无法从中直接获取所需信息,且采集过程中存在因仪器或环境而引入的噪声。因此,通常需要使用化学计量学方法提取有用信息,并选择合适的算法建立多元定性或定量分析模型,以实现分析目的。解决定性分析问题需要用到化学计量学中的模式识别方法。模式识别方法根据学习过程可分为有监督模式识别方法和无监督模式识别方法。常用的有监督模式识别方法有: 距离判别(如马氏距离、欧式距离) 、K-最邻近(KNN) 、线性判别分析(LDA) 等; 而无监督模式识别中则是主成分分析、聚类分析等方法最为常用。常用的定量分析方法有主成分分析(PCA) 、偏最小二乘(PLS)、人工神经网络(ANN) 以及支持向量机(SVM) 和最小二乘支持向量机(LS-SVM) 等[14]。此外,PLS、SVM、LS-SVM 也被用于定性分析。
PCA 是一种无监督的技术,通常用于减少数据的维数和对高光谱图像中的信息进行分类。PCA 的核心是数据降维,从而消除原变量中的重叠信息。所得新变量为原变量的线性组合,新变量具有数目少、相互正交、能较好地表征原变量数据结构特征等优点。PCA 用于分析NIR,FTIR 和LIBS 光谱等[15]。
PCA 算法通过选择主成分数可有效滤除无效信息,同时解决了共线性问题,适用于复杂分析体系。不足之处在于PCA 仅对自变量矩阵进行分解降维,并没有将因变量矩阵的噪音考虑在内,无法保证参与回归的主成分与被测组分或性质相关。基于上述思想,PLS 算法同时分解自变量矩阵和因变量矩阵,然后将获得的自变量和因变量的得分矩阵进行多元线性回归,既达到了降维的目的,又具有模型简单稳健、预测精度高、计算量小等优点,已成为目前过程分析领域应用最为广泛的分析算法[16]。
ANN 是解释因素和响应变量之间的非线性数据的强大工具,其原理是给网络各种训练样本,然后根据网络实际输出和正确目标值之间的偏差修改各神经元间的连接权重,网络不断朝误差减小的方向进行变化,直到实际输出值与正确目标值的偏差满足所需精度。人工神经网络由1个输入层和1个输出层组成,其中输入层从外部源( 数据文件,图像,硬件传感器等) 接收数据,1个或多个隐藏层处理数据,输出层基于网络功能提供1个或多个数据点[17]。
PAT是以确保成品质量为目标设计、分析与控制制造的一体化系统。样品数据被采集后,经处理系统筛选、校正、验证后,将得到的结果重新反馈于工艺流程,并对工艺流程进行调控,从而实现自动化生产。
3、PAT在制药行业中的应用
目前礼来、强生、辉瑞等公司已运用PAT 实现了药品的连续制造,并获得了FDA 的批文。诺华、葛兰素史克、龙沙以及天津天士力、华润江中等药企也通过PAT 实现了产品的中控放行。PAT 在医药行业的应用也受到了国内外许多专家和学者的关注[18]。
3.1在化学药品生产过程中的应用
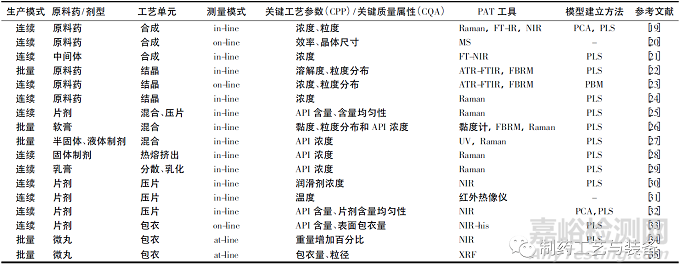
化学药品智能化生产随着数据化管理逐渐进步,而质量控制依赖人工手段滞后于生产过程。部分大型制药企业研究的在线分析技术在化学药品合成、混合、干燥、压片、结晶、包衣、包装等生产过程已发挥作用。近5 年部分相关文献汇总,见表1。
表1 近5年过程分析(PAT) 在化学药品生产中部分应用实例文献列表
原料药(API) 合成是药品生产的起始步骤,也是决定药品安全有效的关键步骤。PAT 工具可实时监测合成过程变化趋势,判断合成终点,实现智能化控制合成过程。Loren等[20]报道了一种苯海拉明连续合成的高度集成方法。质谱(MS) 在整个系统中用于在线反应监控、离线产量定量,并作为反应筛选模块,利用带电微滴中的反应加速进行高通量路线筛选,针对反应效率进行了优化。Mitic 等[21]在管层流反应器进行9-烯丙基-2-氯硫杂蒽-9-醇的脱水反应,研究者设计线内FT-NIR 装置实时监测该化合物反应过程并建立PLS模型,在线分析结果通过了近线NIR 结果及离线的HPLC 结果验证并具有较高的预测准确率。此外,利用在线分析所得数据建立反应的动力学模型更精确地反映生产过程。
结晶是制药工业生产API 中最常见的分离纯化操作。近年来,应用PAT 工具对结晶过程进行实时监测,促进了研究人员对结晶过程机理的进一步理解。同时,将PAT 工具应用于结晶过程的开发、优化、设计、分析和调控,有助于确保API、工艺参数和最终产品的关键质量属性达到设计指标,从而最终实现QBD 的理念。最常用的技术包括用于溶液浓度测量的衰减全反射傅里叶变换红外光谱(ATR-FTIR) 和用于监测颗粒数量及其尺寸分布变化的FBRM[22-23]、用于颗粒直接可视化的颗粒视觉和测量以及用于监测多晶型转变的拉曼光谱[24]。
物料混合过程是制剂生产过程中的关键环节,混合不充分将使药品质量不均一而混合过久则极大地浪费资源。传统监控物料混合过程的方法分析时间长、破坏样品、多次取样药品污染风险增加等弊端。因此,将NIR、Raman 等方法应用于实时监测药物的原辅料混合过程与FDA 提出的PAT的宗旨一致,对于确保最终产品的质量(例如片剂的含量均匀性) 至关重要。Nagy 等[25]运用线内拉曼光谱监测3组分(咖啡因、葡萄糖、硬脂酸镁) 模型药物系统的连续混合和压片过程。使用PLS 定量方法对API 含量,混合均匀性和片剂含量均匀性进行实时分析。在线拉曼光谱监测表明,连续式搅拌机能够生产出具有高均质性的共混物。还建立了基于拉曼光谱的API 进料器反馈控制,从而创建了一种“过程分析控制技术”(PACT) ,保证了所生产混合物中所需的API含量。
压片通常是获得片剂最终形式的最后一步。在工业规模上,PAT 的应用可以快速分析可以测量更多的样品,从而提高了质量保证的统计意义。Sasakura 等[30]和Pauli 等[32]均研究了采用线内NIR 定量监测压片设备进料管中API 或辅料浓度变化的可行性。Lee 等[31]的研究结果显示了线内红外热成像技术在相同压制力下生产的相同配方片剂之间进行区分的潜在能力。
在制药工业中,为了实现药物的持续释放或控制释放,通常对多颗粒制剂如微丸进行包衣。Nishii 等[33] 和Naidu等[34]分别采用NIR 在线检测和近线检测方式监测包衣过程的均匀性,Nakano 等[35]证明了近线XRF 可用作监测颗粒包衣过程的PAT,并成为制药生产中的强大工具。
3.2在生物药中的应用
生物制药过程比传统的化学药制药过程更为复杂。生物制药过程所用原料较复杂,批次间存在质量差异,且生物技术药物对生产过程极为敏感。因此,固定的工艺操作条件无法满足质量控制需求,需要将PAT 用于生物制药过程监测,保证生物技术药物产品质量。
以发酵或细胞培养为代表的生物制药上游环节,是整个生物制药的最关键环节之一。通过检测和控制CQAs,药品质量的提高和生产成本的降低均存在较大空间。发酵液和细胞培养液的特点是组成复杂,通常气、固、液三相共存,其组分和含量不断变化。因此将PAT 用于生物制药过程监测,也具有较大挑战。已有研究中使用光谱技术监测的指标多为与发酵/培养“环境”、细胞生长和产品质量相关的指标。Sun 等[36]利用微型近红外光谱仪线内监测发酵过程中氨基葡萄糖含量,控制发酵过程,这种便携式仪器的实施能够减少时间和分析成本。Eamonde-White 等[37]报道,利用表面增强拉曼光谱技术(SERS) 以及拉曼光谱联合非线性模型预测控制器(NMPC) ,对中国仓鼠卵巢(CHO) 细胞培养中营养物浓度等参数进行在线监控,正在从实验研究往GMP 生产应用上发展。
生物技术产品下游加工常用的纯化操作包括复性、层析、过滤和制备色谱等,整个处理过程由若干个目的明确的操作单元组成,相互影响。常用的PAT 方法是通过在线液相色谱分析技术、NIR 分析技术检测目标生物药物纯度变化,建立纯化终点判断方法,优化药物纯化工艺,提高生物药的得率,减少纯化过程中生物药的活性破坏。West 等[38]展示了新型的PAT 方法,可在超滤和渗滤工艺操作过程中同时监控多个质量属性。并开发了体积排阻色谱(SEC) 方法,对在线PAT 模式下赋形剂精氨酸,组氨酸和高分子量物质的测量。Lofgren 等[39]介绍了使用线内弱阴离子交换柱(捕获步骤) 捕获澄清的上清液,然后进行病毒灭活步骤和抛光步骤,实现CHO 细胞系产生的重组蛋白的纯化,集成的连续过程大大提高了产率及生产率。
药品制备步骤中,将辅料和活性药物等配制起来,制成最终的配方。为增加生物制品稳定性,最后一步往往通过冻干流程实现。1 个良好的冻干工艺,应具有产品质量稳定、时间短、能耗低、冻干周期可控、可验证的特征。在药品冻干过程中,监控温度以及准确判断一次升华干燥和解析干燥结束点是冻干工艺中需要控制的关键。Ten Have 等[40]利用线内真空阀开闭频率监测卡介苗(BCG) 的中试和生产规模的冻干过程,以确定生产规模初次干燥的终点。Vam 等[41]开发了一种近红外光谱方法在线监测生物制药的旋转冷冻小瓶的干燥行为,这种方法可以使冻干过程可视化,并可以确定初次和二次干燥的终点。
3.3在生物药中的应用
中成药生产方式较为传统,产品研发时对工艺理解不足,导致目前中药质量控制主要依靠生产经验和终产品检测,缺乏调控方法,不能有效应对药材质量波动和工艺参数波动对产品质量的影响。中药制药过程中间体和终产品大多成分复杂。对于部分中药品种,其制药中间体和终产品缺乏物质基础及分析方法研究,无法明确影响PAT 实现的干扰因素。
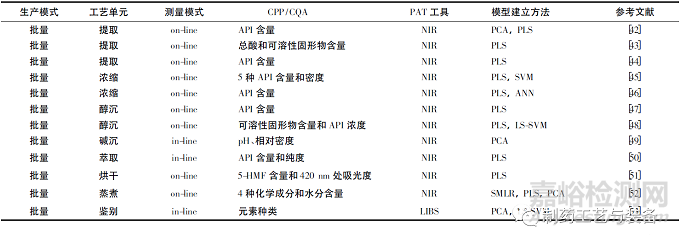
传统的中成药制药过程包括提取、浓缩、水/醇沉、过滤、配液等。从药材炮制到制药过程,再到终产品检测,PAT 均已在中成药制药过程监测中发挥了重要作用,为增加过程了解和提高质控水平提供了依据。PAT 在中成药制药过程监测中的部分应用见表2。
表2 近10年PAT在中成药生产中部分应用实例文献列表
提取过程是对传统中药制备过程中的一个重要步骤。活性成分提取过程的本质是溶质溶解在溶剂中的传质过程。为了提高生产效率和确保最终产品的质量,采用快速,可靠,无损在线实时测量方法在中药制药中具有重要的价值。Gao等[42]利用水作为监测中药提取过程的探针,NIR 用于在线监测药物提取过程,提出了一种利用水谱来了解整个提取过程并快速确定丹酚酸B( 中药丹参的主要活性药物成分) 含量的方法。Yang 等[43]同样用NIR 光谱技术,在线监测金银花提取过程。并建立了4 种不同的PLS 模型,比较了它们在预测2个质量参数( 总酸和可溶性固形物) 方面的性能。
浓缩过程是影响中成药生产的必不可少的单元操作。浓缩过程的目的是除去存在于先前连接中间的溶剂(例如水,乙醇等) 。传统上,浓缩过程的终点是由浓缩物的密度决定的,浓缩物的密度可能无法反映活性成分含量的变化并无法准确地判断终点。因此,有必要确定有效成分的含量以监测浓缩过程。例如,NIR 光谱技术被Liu 等[45]用于在线监测中药灵芝灵口服液浓缩过程中的多个物理及化学参数。Xue等[46]采用相同的PAT 工具建立了葛根渗滤浓缩过程中葛根素的快速测定方法,以高效液相色谱分析值为参考,通过PLS 回归和ANN 生成校正模型。这些研究都证明了NIR 模型可用于浓缩过程中的在线质量控制。
水/醇沉是中药生产中最常用的纯化方法之一。在此过程中,去除了大量杂质,包括蛋白质,多糖,盐,单宁和色素。提取物的初始组成,乙醇的浓度,乙醇的体积和沉淀温度,所有这些变量都可能相互影响,并影响最终产品的质量属性。因此,至关重要的是监视和控制这些变量并了解它们的复杂关系,以最大程度地减少沉淀过程中批次间的差异,从而确保一致的输出。Jin 等[48]研究了NIR 光谱在丹红注射液生产过程中醇沉工艺在线定量监测中的应用。分析关键的中间质量属性: 可溶性固形物( SSC) 和丹参素的浓度( DSS) 等。而Li 等[49]以复方阿胶口服液的碱沉法为例,对线内收集的NIR 光谱进行多路主成分分析。结果表明,基于近红外光谱的多变量工艺轨迹可以有效反映批次间的重现性,也有助于中药生产中故障批次的诊断。
从表2可以看出,在中药制药过程监测中,NIR 光谱技术是应用最广泛的PAT 工具,PLS 算法是使用最广泛的建模方法。除了以上介绍的几个中成药生产的重要步骤,PAT 工具在其他工艺过程中也有应用。例如,Xiong 等[50]以液-液萃取为典型实例,以探索线内NIR 光谱结合多变量分析在中药分批生产过程监控中的潜力。Li 等[51]以槟榔,麦芽和山楂3 种中药材的烘干过程为实例,使用NIR 建立了5-( 羟甲基)糠醛( 5-HMF) 含量和420 nm 吸光度的两种模型,该模型对于在线分析和质量控制具有鲁棒性,准确性和可重复性。Zhou 等[52]探索了NIR 光谱技术用于在线监测天麻根茎蒸制过程的潜在用途,以确定在蒸煮过程中4 种化学成分和水分变化。在上面的基础上,NIR 可以有效地实时监视产品质量,从而获得最佳质量的产品。
4、结论及展望
随着智能制造、连续制造在制药业的应用日益广泛,PAT的应用也愈发广泛。PAT 工具与化学计量学相结合,可以成为强大的实时监控系统,并通过防止过程中的危险故障而提供安全的过程操作。采用PAT 替代传统的质量控制实验室检测,不仅可以提高生产效率,降低质量控制实验室检测费用,减少废液的产生,实现绿色生产; 还可以提升产品批次间的一致性。目前各国监管机构也都鼓励制药企业在生产过程中采用PAT。
PAT 在国内药品生产领域的研究仍处于起始阶段。我国医药生产长期以来采用传统的生产方式,大多数企业的制药过程自动化程度不高,控制方案简单,控制效果不尽人意。许多制药企业规模小、经济实力比较弱,而实现PAT 的成本相对较高。制药行业更倾向于将资金投入新产品开发中,对于提高产品质量、节约成本的新技术投入认识不足。这是很多制药企业的价值观念。但近几年来随着科学技术的不断发展,国内在药物生产过程研究的PAT 也逐渐取得很大观念突破,明白生产质量一致性与高效率的重要性。未来配合药品监管系统与法规对QbD /PAT 的逐渐认可,PAT 将会成为药品生产过程智能化监测的必然方法。
参考文献
[1] DZIKI W,JIANG Z,RADSPINNER D A,et al. The FDA process analytical technology( PAT) initiative - an alternative pharmaceutical manufacturing practice( aPMP) [J]. Pharmacop Forum,2004,30( 6): 2254-2262.
[2] WANG P,ZANG H C,ZENG Y Z. Causes and control of quality risks in drug production process[J]. Chin Pharm J (中国药学杂志) ,2011,46( 13) : 969-972.
[3] CHEW W,SHARRATT P. Trends in process analytical technology[J]. Anal Methods,2010,2( 10) : 1412-1438.
[4] LEE S L,O’CONNOR T F,YANG X C,et al. Modernizing pharmaceutical manufacturing: from batch to continuous production[J]. J Pharm Innov,2015,10( 3) : 191-199.
[5] KOMECKI M,SCHMIDT A,STRUBE J. PAT as key-enabling technology for QbD in pharmaceutical manufacturing-A conceptual review on upstream and downstream processing[J]. Chim Oggi,2018,36( 6) : 44-48.
[6] SHENG P P,LUO S Q,YIN L H. Application of process analysis technology in pharmaceutical production process[J]. Chin J Pharm Anal ( 药物分析杂志) ,2018,38( 5) : 748-757.
[7] KIM E J,KIM J H,KIM M S,et al. Process analytical technology tools for monitoring pharmaceutical unit pperations: a control strategy for continuous process verification[J]. Pharmaceutics,2021,13( 6) : 919-967.
[8] ZHOU Z L. Quality control of traditional Chinese medicine using near infrared spectroscopy[D]. Guangzhou: South China University of Technology,2017.
[9] NAGY B,FARKAS A,BORBAS E,et al. Raman spectroscopy for process analytical technologies of pharmaceutical secondary manufacturing[J]. AAPS Pharmscitech,2019,20( 1): 1-16.
[10] NICOLSON F,JAMIESON L E,MABBOTT S,et al. Through barrier detection of ethanol using handheld Raman spectroscopyconventional Raman versus spatially offset Raman spectroscopy(SORS) [J]. J Raman Spectrosc,2017,48( 12) : 1828-1838.
[11] BUTTE P,LAPCHAK P. Continuous laser induced fluorescence spectroscopy( CLIFS) technique for screening drugs by assessing the metabolic effects in real-time[J]. Neurology,2013,80( Suppl 7) : 65.
[12] WERNER P,MUNZBERG M,HASS R,et al. Process analytical approaches for the coil-to-globule transition of poly( N-isopropylacrylamide)in a concentrated aqueous suspension[J]. Anal Bioanal Chem,2017,409( 3) : 807-819.
[13] SHAH S K H,IQBAL J,AHMAD P,et al. Laser induced breakdown spectroscopy methods and applications: a comprehensive review[J]. Radiat Phys Chem,2020,170( 1) : 1-23.
[14] YAN X. Studies on the application of machine learning in pharmaceutical process analysis[D]. Hangzhou: Zhejiang University,2020.
[15] BEATTIE J R,ESMONDE-WHITE F W L. Exploration of principal component analysis: deriving principal component analysis visually using spectra[J]. Appl Spectrosc,2021,75( 4) : 361-375.
[16] BIANCOLILLO A,MARINI F. Chemometric methods for spectroscopybased pharmaceutical analysis[J]. Front Chem,2018,6(1) : 1-14.
[17] ZHANG C,GUO Y,LI M. Review of development and application of artificial neural network models[J]. Comput Eng Appl( 计算机工程与应用) ,2021,57( 11) : 57-69.
[18] DONG Q,ZANG H C,LIU A H,et al. Application of process analysis technology in pharmaceutical field and its enlightenment to China's pharmaceutical industry[J]. Chin Pharm J ( 中国药学杂志) ,2010,45( 12) : 881-884.
[19] GUOVEIA F F,RAHBEK J P,MORTENSEN A R,et al. Using PAT to accelerate the transition to continuous API manufacturing[J]. Anal Bioanal Chem,2017,409( 3) : 821-832.
[20] LOREN B P,WLEKLINSKI M,KOSWARA A,et al. Mass spectrometric directed system for the continuous-flow synthesis and purification of diphenhydramine[J]. Chem Sci,2017,8 ( 6 ) :4363-4370.
[21] MITIC A,CEVERA-PADRELL A E,MORTENSEN A R,et al.Implementation of near-infrared spectroscopy for in-line monitoring of a dehydration reaction in a tubular laminar reactor[J]. Org Process Res Dev,2016,20( 2) : 395-402.
[22] MCDONALD M A,MARSHALL G D,BOMMARIUS A S,et al.Crystallization kinetics of cephalexin monohydrate in the presence of cephalexin precursors[J]. Cryst Growth Des,2019,19 ( 9):5056-5074.
[23] TRAMPUZ M,TESLIC D,LIKOZAR B,et al. Process analytical technology-based( PAT) model simulations of a combined cooling,seeded and antisolvent crystallization of an active pharmaceutical ingredient ( API) [J]. Powder Technol,2020,366 ( 1 ) :873-890.
[24] ACEVEDO D,YANG X C,MOHAMMAD A,et al. Raman spectroscopy for monitoring the continuous crystallization of carbamazepine[J]. Org Process Res Dev,2018,22( 2) : 156-165.
[25] NAGY B,FARKAS A,GYURKES M,et al. In-line Raman spectroscopic monitoring and feedback control of a continuous twinscrew pharmaceutical powder blending and tableting process[J].Int J Pharm,2017,530( 1-2) : 21-29.
[26] BOSTJIN N,DHONDT W,VERVAET C,et al. PAT-based batch statistical process control of a manufacturing process for a pharmaceutical ointment[J]. Eur J Pharm Sci,2019,136( 1) : 1-9.
[27] BOSTJIN N,HELLINGS M,VAN DER VEEN M,et al. In-line UV spectroscopy for the quantification of low-dose active ingredients during the manufacturing of pharmaceutical semi-solid and liquid formulations[J]. Anal Chim Acta,2018,1013( 1) : 54-62.
[28] NETCHACOVITCH L,THIRY J,DE BLEYE C,et al. Global approach for the validation of an in-line Raman spectroscopic method to determine the API content in real-time during a hotmelt extrusion process[J]. Talanta,2017,171( 1) : 45-52.
[29] BOSTJIN N,VAN RENTERGHEM J,VANBILLEMONT B,et al. Continuous manufacturing of a pharmaceutical cream: investigating continuous powder dispersing and residence time distribution(RTD) [J]. Eur J Pharm Sci,2019,132( 1) : 106-117.
[30] SASAKURA D,NAKAYAMA K,CHIKUMA T. Application of the quantitative detection of a change in concentration of magnesium stearate in a feeder tube of tableting manufacture by real-time near-infrared spectroscopy[J]. Pharmazie,2015,70 ( 10): 636-639.
[31] LEE H P,GULAK Y,CUITINO A M. Transient temperature monitoring of pharmaceutical tablets during compaction using infrared thermography[J]. AAPS Pharmscitech,2018,19 ( 5 ) : 2426-2433.
[32] PAULI V,ROGGO Y,PELLEGATTI L,et al. Process analytical technology for continuous manufacturing tableting processing:A case study[J]. J Pharm Biomed Anal,2019,162(1) : 101-111.
[33] NISHII T,MATSUZAKI K,MORITA S. Real-time determination and visualization of two independent quantities during a manufacturing process of pharmaceutical tablets by near-infrared hyperspectral imaging combined with multivariate analysis[J]. Int J Pharm,2020,590(1) : 1-7.
[34] NAIDU V R,DESHPANDE R S,SYED M R,et al. PAT-based control of fluid bed coating process using NIR spectroscopy to monitor the cellulose coating on pharmaceutical pellets[J]. AAPS Pharmscitech, 2017,18(6) : 2045-2054.
[35] NAKANO Y,KATAKUSE Y,AZECHI Y. An application of XRay fluorescence as process analytical technology( PAT) to monitor particle coating processes[J]. Chem Pharm Bull,2018,66(6) : 596-601.
[36] SUN Z Y,LI C,LI L,et al. Study on feasibility of determination of glucosamine content of fermentation process using a micro NIR spectrometer[J]. Spectrochim Acta Part A,2018,201( 1) : 153-160.
[37] EAMONDE-WHITE K A,CUELLAR M,UERPMANN C,et al.Raman spectroscopy as a process analytical technology for pharmaceutical manufacturing and bioprocessing [J]. Anal Bioanal Chem,2017,409(3) : 637-649.
[38] WEST J M,FEROZ H,XU X,et al. Process analytical technology for on-line monitoring of quality attributes during single-use ultrafiltration/diafiltration[J]. Biotechnol Bioeng,2021,118(6):2293-2300.
[39] LOFGREN A,GOMIS-FONS J,ANDERSSON N,et al. An integrated continuous downstream process with real-time control: A case study with periodic countercurrent chromatography and continuous virus inactivation[J]. Biotechnol Bioeng,2021,118(4) : 1664-1676.
[40] TEN HAVE R,REUBSAET K,VAN HERPEN P,et al. Demonstrating functional equivalence of pilot and production scale freezedrying of BCG[J]. Plos One,2016,11( 3) : 1-13.
[41] VAN BOCKSTAL P J,DE MEYER L,CORVER J,et al. Noncontact infrared-mediated heat transfer during continuous freezedrying of unit doses[J]. J Pharm Sci,2017,106( 1) : 71-82.
[42] GAO L L,ZHONG L,ZHANG J,et al. Water as a probe to understand the traditional Chinese medicine extraction process with near infrared spectroscopy: A case of Danshen( Salvia miltiorrhizaBge)extraction process[J]. Spectrochim Acta Part A,2021,244(1): 1-11.
[43] YANG Y,WANG L,WU Y J,et al. On-line monitoring of extraction process of Flos Lonicerae Japonicae using near infrared spectroscopy combined with synergy interval PLS and genetic algorithm[J]. Spectrochim Acta Part A,2017,182( 1) : 73-80.
[44] LI Y,SHI X,WU Z,et al. Near-infrared for on-line determination of quality parameter of Sophora japonica L. ( formula particles): From lab investigation to pilot-scale extraction process[J].Pharmacogn Mag,2015,11( 41) : 8-13.
[45] LIU R H,SUN Q F,HU T,et al. Multi-parameters monitoring during traditional Chinese medicine concentration process with near infrared spectroscopy and chemometrics[J]. Spectrochim Acta Part A,2018,192( 1) : 75-81.
[46] XUE J T,YANG Q W,JING Y,et al. Rapid determination of puerarin by near-infrared spectroscopy during percolation and concentration process of puerariaelobatae radix[J]. Pharmacogn Mag,2016,12( 47) : 188-192.
[47] WU Z S,XU B,DU M,et al. Validation of a NIR quantification method for the determination of chlorogenic acid in Lonicera japonica solution in ethanol precipitation process[J]. J Pharm Biomed,2012,62( 1) : 1-6.
[48] JIN Y,WU Z Z,LIU X S,et al. Near infrared spectroscopy in combination with chemometrics as a process analytical technology(PAT) tool for on-line quantitative monitoring of alcohol precipitation[J]. J Pharm Biomed,2013,77( 1) : 32-39.
[49] LI W L,HAN H F,CHENG Z W,et al. A feasibility research on the monitoring of traditional Chinese medicine production process using NIR-based multivariate process trajectories[J].Sensor Actuat B Chem,2016,231( 1) : 313-323.
[50] XIONG H S,GONG X C,QU H B. Monitoring batch-to-batch reproducibility of liquid-liquid extraction process using in-line near-infrared spectroscopy combined with multivariate analysis[J]. J Pharm Biomed,2012,70( 1) : 178-187.
[51] LI K Y,WANG W Y,LIU Y P,et al. Near-infrared spectroscopy as a process analytical technology tool for monitoring the parching process of traditional Chinese medicine based on two kinds of chemical indicators[J]. Pharmacogn Mag,2017,13( 50) : 332-337.
[52] ZHOU Y M,YANG J,LI C,et al. Near-infrared spectroscopy as a process analytical technology tool for monitoring the steaming process of gastrodiaerhizoma with multiparameters and chemometrics[J]. J Anal Methods Chem,2020,2020( 1) : 1-12.
[53] LIU X N,CHE X Q,LI K Y,et al. Geographical authenticity evaluation of Mentha haplocalyx by LIBS coupled with multivariate analyzes[J]. Plasma Sci Technol,2020,22( 7) : 1-7.
本文作者谢升谷、黄艳、孙逍、郑金琪、陶巧凤,浙江省食品药品检验研究院、国家药品监督管理局仿制药评价关键技术重点实验室、浙江省药品接触材料质量控制研究重点实验室、浙江工业大学。