随着社会进步和人类健康需求的提高,人用疫苗研发及生产技术发展迅速,我国在疫苗研发技术和生产工艺的改进取得了长足的发展。分别阐述了灭活病毒性疫苗、多糖蛋白结合疫苗、基因工程疫苗规模化生产工艺和技术的国内外现状和未来发展趋势。
疫苗在保障国民健康和国家生物安全方面发挥了巨大作用。我国自实施计划免疫以来,传染病的发病率和死亡率得到有效控制,成功消灭了天花、脊髓灰质炎和孕妇新生儿破伤风,常见儿童传染病如麻疹、腮腺炎、风疹、百日咳、白喉、破伤风、乙型性脑炎、流行性脑脊髓膜炎等疾病的发病率和死亡率下降幅度在95% 以上,乙肝感染降到1% 以下,具有巨大的社会效益和经济效益。我国疫苗产业虽已取得了长足的进展,但疫苗产业的自主创新能力、新产品转化、关键核心技术应用、规模化生产工艺和技术水平,同发达国家相比仍有一定差距。而且随着全球经济一体化和社会的迅速发展,抗生素滥用、大气污染等多种因素影响,传染病的多发和高发态势仍然没有得到根本改变,生物恐怖的危害也不断加剧,一些重大疾病及新发、突发传染病,如艾滋病、流感、登革热、手足口病、埃博拉等仍严重威胁着人类生命健康。
1、国内外灭活病毒性疫苗的生产工艺与技术
灭活病毒性疫苗为通过化学、热处理或辐射处理经培养纯化的病毒性疫苗,其主要优点是:与活病毒疫苗相比更稳定和安全,不会发生因疫苗接种而导致的感染;被灭活但仍可被机体的免疫系统识别,并产生有效的免疫应答;可用于免疫系统相对较弱的个体;稳定性较好,无需冷冻,方便运输。其缺点主要为免疫原性相对较弱,一般需进行多次接种。
目前已经上市的灭活病毒性疫苗主要有脊髓灰质炎灭活疫苗、甲型肝炎灭活疫苗、流感病毒灭活疫苗、人用狂犬灭活疫苗、乙型脑炎灭活疫苗、双价肾出血热灭活疫苗(表1)[1]。
表1 已上市灭活病毒性疫苗
1.1细胞基质和培养方式
目前国内外灭活病毒性疫苗的细胞基质主要为人二倍体细胞、原代细胞、鸡胚细胞和Vero细胞。其中人二倍体细胞主要有2BS 株、KMB-17 株、WI-38 株和MRC-5 株。各种细胞的特性不一样,培养方式也不一样。人二倍体细胞传代比例和传代代次比较受限,不利于大规模细胞培养,且对培养基和牛血清质量要求较高。原代细胞主要有地鼠肾细胞、沙鼠肾细胞,操作繁琐,存在外源因子污染风险。人二倍体细胞和原代细胞的培养方式主要为转瓶、细胞工厂,这两种培养方式较为传统,每批培养体积较小,较为费时费力,其生产规模仅仅是转瓶或细胞工厂数量上的增加,难以规模化放大。
Vero细胞是第一个可连续传代的哺乳动物细胞,来源于非洲绿猴肾细胞,目前广泛用于疫苗的生产,为灭活病毒性疫苗常用的细胞基质。国内外主要采用微载体生物反应器进行Vero细胞培养。与细胞工厂培养方式相比,微载体生物反应器培养具有明显的优点:可进行高密度培养;可保证细胞在规定细胞传代限定代次内进行分级放大,易于进行规模化放大。国外已有企业建立了在8 周内从1mL 安瓶到6000L 生物反应器的Vero细胞放大生产工艺,在整个规模化放大过程中Vero细胞的产量和活性并不降低[2]。表2 显示了不同反应器规模细胞培养的生长状态。从中可以看出,在反应器内进行15 ~ 6000L 规模化放大培养时,Vero细胞密度体现较好的一致性[2]。
表2 不同规格生物反应器培养Vero细胞
正是由于Vero细胞在病毒性疫苗生产中的应用,使得现代病毒性疫苗的生产进入工业化、规模化时代,生产过程更加可控,批间一致性更好。目前国内外主流的以Vero细胞为基质的疫苗生产均采用微载体生物反应器培养工艺。
以Vero细胞为基质生产的灭活病毒性疫苗主要有脊髓灰质炎灭活疫苗、狂犬病灭活疫苗、日本乙型脑炎灭活疫苗,目前Vero细胞还被用于小儿轮状病毒活疫苗Rotateq1(Merck)和Rotarix1(葛兰素史克)[3]、H5N1大流感疫苗Preflucel1(Baxter)[4]、日本脑炎疫苗Ixiaro1(Intercell)的生产[2]。此外,还被批准用于天花活疫苗ACAM20001(Sanofi Pasteur)的生产[2]。
Vero细胞等传代细胞培养均采用含血清培养,但含血清培养对于病毒性疫苗的下游纯化也有较高的要求,需要严格控制血清中BSA的含量、纯化的回收率等一些关键的指标,所以无血清细胞培养技术成为国内外细胞培养研究热点之一。Vero细胞的研究的另一个热点是进行细胞悬浮化高密度培养。与使用微载体不同,细胞进行悬浮化培养后,细胞的贴壁特性发生了改变,细胞不需要消化可直接传代,并且可以提高细胞的发酵密度。
1.2生产工艺
国内外的灭活病毒性疫苗均需要经过收获、澄清、浓缩、纯化、灭活等生产工艺。其中纯化主要采用柱层析或蔗糖密度梯度离心法。这两种方式各有优缺点:层析法便于线性放大,批间一致性较好,但是试剂成本较高;蔗糖密度梯度离心法纯化的抗原成分单一,可有效区分空心和实心病毒颗粒,但每批处理量较小,后期需要除糖处理。国内外上市的灭活病毒性疫苗多采用层析纯化工艺。
目前病毒灭活主要采用β-丙内酯和甲醛两种灭活剂。β-丙内酯常温下是无色黏稠状液体,主要通过作用于病毒RNA从而达到灭活病毒的效果。目前上市的疫苗中采用β-丙内酯灭活的主要有狂犬疫苗和双价肾出血热灭活疫苗。
在疫苗研究初期人们就已使用甲醛进行细菌和病毒性疫苗的灭活。甲醛对于病毒核酸和蛋白质都具有破坏作用。甲醛对单链核酸的破坏最为有效,因此常被用于RNA 病毒的灭活。脊髓灰质炎灭活疫苗、甲型肝炎灭活疫苗、流感病毒灭活疫苗、乙型脑炎灭活疫苗等均采用甲醛灭活工艺。
1.3质量控制
灭活病毒性疫苗的主要控制指标为病毒抗原活性成分、纯度以及宿主细胞DNA、宿主细胞蛋白(HCP)、灭活剂等的残留成分控制。纯度的检测方法主要有HPLC、SDS-PAGE 或比活等指标。其中不同疫苗对Vero细胞残余DNA 含量要求不太统一,WHO生物学标准化专业委员会评估残留DNA引起的转化事件的风险后认为注射产品的DNA含量每剂小于10ng均可以接受[5]。目前,国内的狂犬疫苗等中的Vero细胞残余DNA含量标准为每剂不高于100pg。但美国上市的IPV(IPOL®,Sanofi Pasteur)Vero细胞残余DNA含量每剂低于10pg。国内上市的sIPV DNA含量为每剂不高于50pg。Vero细胞HCP含量一般为每剂不高于50ng。
2、多糖蛋白结合疫苗规模化生产工艺与技术
2.1国外行业现状
2.1.1 肺炎球菌结合疫苗
目前,全球已上市的肺炎球菌结合疫苗有3 种,分别是惠氏(Wyeth)公司生产的7 价肺炎球菌结合疫苗Prevnar7(2000 年上市)和13 价肺炎球菌结合疫苗Prevnar13(2010 年上市),以及葛兰素史克公司生产的11 价肺炎球菌结合疫苗Synfl orix(2009 年上市)[6-8]。
(1)Prevnar
Prevnar7 配方中包括了4、6B、9V、14、18C、19F、23F 共7 个血清型的结合物,Prevnar13 包括了1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F、23F 共13 个血清型的结合物,比Prevnar7 多6 个型别的结合物(1、3、5、6A、7F、19A),两者均以CRM197 为载体蛋白,均为磷酸铝佐剂吸附剂型。惠氏公司结合物制备采用的工艺路线为:将天然多糖进行酸水解降低分子量至适宜范围(有些型多糖在氧化反应中自行降解,不需要预先进行水解),用高碘酸钠氧化多糖邻羟基使多糖重复单位产生醛基,醛基与CRM197 分子上的氨基,在还原剂(如NaBH4)存在的条件下发生还原胺化反应生成酰胺键,该方法被称为还原胺化法。这种方法的优点是对多糖重复单位上的邻羟基进行可控的修饰,不破坏多糖分子的其他结构,易于质控。缺点是还原胺化反应需要的时间较长,有的型结合反应需要5d。在0.5mL Prevnar13 中,有12 种血清型多糖各2μg,4μg 6B型多糖,0.125mg 磷酸铝佐剂。Prevnar13的剂型为不含胶乳的单剂预充式注射器灌装注射液[9-10]。
(2)Synfl orix
Synfl orix 配方包括1、4、5、6B、7F、9V、14、18C、19F、23F 共10 个血清型结合物。该产品使用了3 种不同的载体蛋白,其中1、4、5、6B、7F、9V、14、23F 载体蛋白为不可分型流感嗜血杆菌表面蛋白D(PD),19F 载体蛋白为白喉类毒素(DT),18C 载体蛋白为破伤风类毒素(TT)。剂型同样为磷酸铝佐剂吸附剂型(0.5mg 磷酸铝佐剂/ 剂)。每剂疫苗含1、5、6B、7F、9V、14、23F 这7 个血清型多糖各1μg,4、18C、19F 各3μg。所采用的技术路线为对除5、6B、23F 这3 个型外的其他天然多糖分子进行微流化(microfl uidization)处理以降低分子量,在不同条件下用1- 氰基-4-(二甲氨基)吡啶四氟硼酸盐[1-cyano-4-(dimethylamino)pyridinium tetrafl uo-roborate,CDAP]将多糖的羟基活化为氰酸酯,活化后的多糖的氰酸酯通过与载体蛋白或己二酸二酰肼(adipicdihydazide,ADH)衍生的载体蛋白的氨基或肼基形成异脲衍生物而实现结合。其原理与传统的溴化氰活化法相同,但活化条件更加温和,活化物副反应发生率低,对多糖的结构改变较少。与还原胺化法相比,耗时少。此方法的缺点是活化时间仅几十秒,要在这几十秒内对溶液迅速变化的pH 进行控制并不容易,由于多糖活化和结合是连续完成的,难以对多糖活化进行有效质控,反应条件偏碱性,对多糖上碱性条件敏感的基团难免会造成破坏,结合载体蛋白利用率不高[11]。
2.1.2 脑膜炎球菌多价结合疫苗
当前国际上脑膜炎球菌结合疫苗的发展趋势为包含A、C、Y、W135 等4 个血清群的多价结合疫苗,目前全球已上市的有3 家产品,分别为赛诺菲巴斯德的Menactra、诺华的Menveo(2014 年被葛兰素史克收购)、葛兰素史克的Nimenrix。
此外,还有一种联合疫苗,葛兰素史克的C、Y 群脑膜炎球菌与b 型流感嗜血杆菌结合疫苗,其产品名为Menhibrix。
(1)Menactra
液体剂型,2005年获得批准上市,规格为0.5mL,其中含A、C、Y、W135群脑膜炎球菌多糖各4μg,含载体蛋白白喉类毒素DT约48μg。
其基本工艺路线为:①用弱酸和双氧水水解多糖,制备多糖水解物;②各群多糖水解物分别按照不同工艺进行衍生(A 群衍生物为多糖溶液中加入EDAC 和ADH,在A 群多糖的磷酸基团上连接肼基。C 群、Y 群、W135 群衍生物为利用氰基硼氢化钠将ADH 与多糖的末端醛基结合,衍生出肼基。然后多糖衍生物溶液加入EDAC,直接与DT 结合)。
(2)Menveo
2010 年获得批准上市。A群为冻干剂型,C、Y、W135 群为液体剂型,规格为0.5mL。每剂含A群多糖10μg,C、Y、W135 群多糖各5μg,载体蛋白为CRM197 蛋白。
其基本工艺路线为:首先多糖用弱酸水解为分子量约为12 ~ 16 个重复单位的片段;在还原剂作用下,将多糖的末端醛基还原成氨基;然后经酯化产生末端活性酯基团;最后与CRM197 结合[12]。
(3)Nimenrix
2012 年获得批准上市,为冻干剂型,蔗糖作为赋形剂。每剂含A、C、Y、W135 群多糖各5μg,载体蛋白为破伤风类毒素。
其基本工艺路线如下。①将荚膜多糖进行降解。②采用氰基活化法活化多糖。③ A 群和C 群结合:多糖用CDAP 活化后与ADH 进行衍生,然后与TT结合;④ Y 群和W135 群结合:用CDAP 活化后直接与TT 结合。
(4)Menhibrix
2012 年获得批准上市。为冻干剂型,赋形剂为蔗糖。每剂含b 型流感嗜血杆菌荚膜多糖2.5μg,C、Y 群多糖各5μg。载体蛋白为破伤风类毒素。每剂含12.6mg 蔗糖。
2.2国内行业现状
2.2.1 13 价肺炎球菌结合疫苗
国内企业尚无上市的产品,当前进度领先的为玉溪沃森,已经完成Ⅲ期临床疫苗的接种工作,兰州生物正在进行Ⅱ期临床研究,民海生物也已进入了临床研究。
2.2.2 AC 群脑膜炎球菌结合疫苗
我国在20 世纪80 年代已开始研发A 群脑膜炎球菌结合疫苗(TT 为载体),上海生物制品研究所采用的先将蛋白质衍生后与多糖偶联的工艺,动物实验表明该法可增强结合物中多糖的免疫原性[13],但研究未能进一步持续下去。后来国内多使用先将多糖衍生,再与蛋白质载体偶联的方法研制脑膜炎球菌结合疫苗。
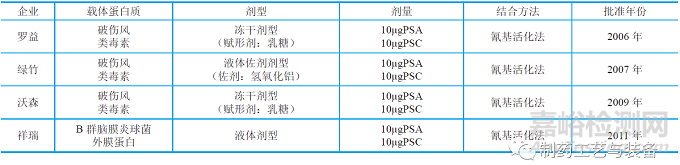
2006 年以来我国先后有4 家企业的AC 群脑膜炎球菌结合疫苗获准生产(表3)。这些产品都以TT 为载体,每剂每群多糖含量为10μg,以乳糖为保护剂;均采用氰基活化法进行多糖的衍生;结合物都采用柱层析纯化工艺。
表3 我国已上市的AC 群脑膜炎球菌结合疫苗
2.2.3 ACYW135 群脑膜炎球菌结合疫苗
ACYW135 群脑膜炎球菌结合疫苗在国内尚未形成上市产品,据统计,国内已有6 家企业获得临床研究批件并进入临床阶段。进度最快的已经完成Ⅲ期临床研究,正在进行数据统计。
3、基因工程疫苗规模化生产工艺和技术
基因工程疫苗是指使用DNA 重组技术,改造病原微生物的基因组,以降低其致病性,提高其免疫原性;或者将病原微生物基因组中的一个或多个保护性抗原编码的基因片段克隆到表达载体,通过原核或真核表达系统诱导表达外源蛋白,经纯化等工艺步骤制成疫苗,接种动物产生保护性抗体,达到防治传染病的目的。近年来,随着分子生物学、反相遗传学和结构生物学等理论研究和技术方法的不断突破,以及专业仪器的不断升级,基因工程疫苗的进展也日新月异。目前利用基因工程技术已经使用和正在研制开发的新型疫苗主要有基因工程亚单位疫苗、基因工程活载体疫苗、核酸疫苗、合成肽疫苗、转基因植物疫苗等,这些疫苗统称为基因工程疫苗。与传统疫苗相比,基因工程疫苗具有如下诸多优势:①抗原成分明确,表达通路清楚可控,安全性高;②生产成本低,工艺步骤稳定,易于规模化放大;③质量控制的方法和标准具有一定通用性,从而提高安全性;④通过载体或抗原蛋白的上游设计,可构建能够对多种疾病产生保护的多价疫苗。现在基因工程疫苗已成为生物制品产业发展的一种趋势,在各种疾病的防控方面发挥重要作用。
基因工程疫苗的生产技术流程包括四个步骤:上游保护性抗原/ 表位和表达载体设计,基因工程菌/ 细胞构建,大规模发酵培养,目的蛋白纯化。基因工程蛋白的研发和规模化生产进入门槛高,尤其是建立工业规模生产平台,需要技术、人才和资本的多年积累。其中,高表达工程菌株/ 细胞株的构建和下游生产纯化工艺是关键技术[14]。以提高单位制品产量、细胞高密度培养及表达[15]、简化生产工艺、降低生产成本、保证大规模生产制品质量为目的的核心工艺开发已成为各大生物公司竞相开展的前沿课题。
3.1国外基因工程疫苗规模化生产工艺与技术
国际上一些知名疫苗制造企业在基因工程疫苗的制备方面已开始逐渐走向工艺规模化、自动化和一次性化制备阶段。工艺的规模化情况在一定程度上反映了制造工艺的先进性和稳定性。在大幅降低了疫苗产品成本的同时也降低了疫苗批间质量差异带来的风险。规模化培养是常规疫苗生产领域的主要技术,目前国际主流的培养规模为3000 ~8000L,多采用批式或批式加量培养,进行计算机二级控制,实现完全自动化[16]。近几年,针对不同宿主细胞特点和疫苗制品生产工艺,用于疫苗生产的个性化细胞培养基的需求不断增加,市场供求已趋于正规化。自动化是规模化生产的目标和趋势,即采用自动化的分离纯化体系,包括细胞破碎、微滤、超滤和层析等技术,同时,整体柱、移动模拟床色谱、膜色谱等新兴技术也逐渐应用于规模化生产中。自动化的优点在于生产过程中减少人力成本,提高效率,降低人为操作误差及污染风险。一次性产品包括规模化生产过程中接触制品的装置、器具和耗材,其应用可使制品质量可控、便于验证。一次性细胞培养反应器已发展为生物医药(包括疫苗)产品生产的主要形式,其发展对于降低疫苗生产成本、提高经济效益、确保制品的安全具有重要意义。国外疫苗生产企业多采用“个性化”服务的方式与某些企业合作建立一种“协议服务”的商业关系。通过模块化、平台化操作研制最适合自身产品特点的个性化技术应用于生产实践,厂家为客户提供最优化的技术服务以及相关的技术支持,例如定制培养基、定制层析介质等,帮助其提高产能,实现生产效率的大幅度提升[16]。规模性自动化、多参数系统化的疫苗生产技术平台为疫苗生产效率提高、生产工艺的一致性以及疫苗质量的稳定提供了保障。
3.2国内基因工程疫苗规模化生产工艺与技术
中国生物医药企业起步于20 世纪80 年代初期,经过30 年的努力,生物医药产业取得一定发展,生物产业已初具规模,在发展中国家属于较高水准。但我国疫苗的规模化生产工艺研究起步较晚,大多处于半自动化阶段,其根本原因在于,研发人员在“研究和生产的关联意识”和“质量源于设计”等理念上认识的差距,致使初期的研发设计与规模化生产制备脱节。临床前期的研究很少考虑到工艺的可放大性和终产品质量的可控性。制备工艺往往仅限于实验室规模,不适合规模化生产。如纯化工艺中,实验室研究阶段广泛的采用超速离心和亲和层析法,均为间断性操作且费用较高,很难应用于生产。随着国外疫苗研发和生产企业在国内广泛设厂投产及国内疫苗质量控制监察体系的不断完善,这方面差距在逐渐缩小。此外,疫苗生产用表达系统和宿主细胞方面,国外的研发机构通常拥有专利技术保护,具有相对成熟的技术储备;规模化生产的仪器设备方面,无论是高密度发酵的生物反应器还是规模化分离纯化的层析介质、膜分离技术[17],几乎所有的关键仪器设备都依赖进口,这极大地限制了我国疫苗规模化发展的进程。
基因工程疫苗领域重点在于上游设计,在疫苗研发初期综合考虑工艺放大可行性、质量可控性甚至厂房和设备需求,可迅速实现规模化生产占领市场,同时降低生产成本,提高生产效率,确保安全。因此,相比传统疫苗,我国的基因工程疫苗更容易在产业化能力方面与国际接轨。
4、未来发展趋势与展望
4.1灭活病毒性疫苗技术和工艺的发展趋势
灭活病毒性疫苗技术和工艺的发展趋势主要体现在以下几点。产业化与规模化程度进一步提高,微载体生物反应器规模更大、高密度发酵技术参数的优化等;新型细胞基质研究,进一步提高细胞基质的安全性和培养浓度;细胞和病毒培养基的优化,包括无动物来源的培养基配方研究等;纯化技术的进一步提高,最大限度提高目标抗原纯度和比活;利用反向遗传学等技术进行疫苗生产用毒株的改造。
4.2多糖蛋白结合疫苗技术和工艺的发展趋势
使用符合欧盟标准的原料多糖, 并在此基础上把原料多糖的C 多糖、残余蛋白和核酸含量控制在1% 以内。载体蛋白质使用精制后进一步纯化的TT,TT 单体含量达到90%,并使用基质辅助激光解吸- 飞行时间(MALDI-TOF)质谱技术检测蛋白质准确的分子量和单体含量。通过这些技术研发,使结合效率提高至30% ~ 40%,建立新的过程质量控制方法和临床效果评价方法,与国际接轨。
4.3基因工程疫苗技术和工艺的发展趋势
目前以基因工程制品为主导的基因工程应用产业已成为全球发展最快的产业之一,发展前景广阔。基因工程制品主要包括细胞因子、抗体、疫苗、激素和寡核苷酸药物等。它们对预防人类的肿瘤、心血管疾病、遗传病、糖尿病、包括艾滋病在内的各种传染病、类风湿疾病等有重要作用。在很多领域特别是疑难病症上,基因工程制品起到了传统化学药物难以达到的作用。中国生物医药市场将成为仅次于美国的全球第二大生物医药市场,预计在10 年创新发展的基础上,基因工程疫苗行业将迎来最佳时期。同时,基因工程疫苗的产业化也面临不小的挑战。由于在规模化方面中国长期以来以仿制为主,没有形成具有技术优势的领域,不能发挥技术的累积效应,制约了具有自主知识产权的产品的研发。因此, 面对国际新药研发的过程细化精准, 拥有自主知识产权,并依托研发产品的创新性平台技术是基因工程疫苗规模化生产的重中之重。平台技术的延续性和创新性将为更多基因工程疫苗的开发提供更广阔的发展空间。
参考文献
[1] 普洛特金. 疫苗学[M]. 梁晓峰,罗凤基,封多佳,译. 北京:人民卫生出版社,2011.
[2] BARRETT P N,MUNDT W,KISTNER O,et al. Vero cell platform in vaccine production:moving towards cell culture-based viral vaccines[J]. Expert Review of Vaccines,2009,8(5):607-618.
[3] DENNEHY P H. Rotavirus vaccines:an overview[J]. Clinical Microbiology Reviews,2008,21(1):198-208.
[4] EHRLICH H J,MÜLLER M,HELEN M L,et al. A clinical trial of a whole-virus H5N1 vaccine derived from cell culture[J]. New England Journal of Medicine,2008,358(24):2573-2584.
[5] GRACHEV V,MAGRATH D,GRIFFITHS E. WHO requirements for the use of animal cells as in vitro substrates for the production of biologicals (requirements for biological substance No. 50)[J].Biologicals,1998,26(3):175-193.
[6] ISAACMAN D J,MCINTOSH E D, REINERT R R. Burden of invasive pneumococcal disease and serotype distribution among streptococcus pneumoniae isolates in young children in Europe:impact of the 7-valent pneumococcal conjugate vaccine and considerations for future conjugate vaccines[J]. Int J Infect Dis,2010,14(3):e197-e209.
[7] Centers for Disease Control and Prevention. Licensure of a 13-valent pneumococcal conjugate vaccine(PCV13) and recommendations for use among children - Advisory Committee on Immunization Practices(ACIP),2010[J]. MMWR,2010,59(9):258-261.
[8] World Health Organization. Recommendations to assure the quality,safety and efficacy of pneumococcal conjugate vaccines-proposed replacement[R]. Geneva:WHO,2009.
[9] European Directorate for the Quality Cont rol of Medicines.Pneumococcal polysaccharide conjugate vaccine(adsorbed)&Pneumococcal polysaccharide vaccine(European Pharmacopoeia7.0)[S]. Strasbourg:EDQM,2011.
[10] HAUSDORFF W P,RAINER S G,PARADISO P R,et al.Multivalent pneumococcal polysaccharide-protein conjugate composition:US2009/0130137 A1[P/OL]. 2013-10-12 [2017-01-18].http://xueshu.baidu.com/s?wd=paperur i%3A%28139514b107c1938cf0ef16f31460e7a1%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_vurl=http%3A%2F%2Fwww.f reepatent son l i ne.com%2F8603484.html&ie=ut f-8&sc_us=12202160909721446929.
[11] BIEMANS R L,GARCON M J,HERMAND P V,et al. Vaccine comprising streptococcus pneumoniae capsular polysaccharide conjugates:US2009/0017059 A1[P/OL]. 2016-11-09 [2017-01-18].http://xueshu.baidu.com/s?wd=paperuri%3A%28ea2c5f bcfa774e3b9398712edcf4e846%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_vurl=ht tp%3A%2F%2Fwww.f reepatentsonline.com%2Fep1973564.html&ie=ut f-8&sc_us=16108862752235471684.
[12] BRÖKER M,DULL P M,RAPPUOLI R,et al. Chemistry of a new investigational quadrivalent meningococcal conjugate vaccine that is immunogenic at all ages[J]. Vaccine,2009,27(41):5574-5580.
[13] 朱为,尹行,余生玲,等. A 群脑膜炎球菌多糖结合物的免疫原性研究[J]. 中华微生物学和免疫学杂志,2002,5(22):299-302.
[14] 朱俊颖,孙晔,蒋丽华,等. 疫苗规模化分离纯化研究进展[J]. 生物技术进展,2015,5(6):405-413.
[15] XIAO C Z,HUANG Z C,LI W Q,et al. High density and scaleup cultivation of recombinant CHO cell line and hybridomas with porous microcarrier Cytopore[J]. Cytotechnology,1999,30(1):143-147.
[16] 安芳兰,董文教,武发菊,等. 国内外疫苗规模化生产技术研究进展[J]. 贵州畜牧兽医,2016,40(5):19-22.
[17] SU N B,YU X,YIN Y,et al. Large-scale pur i f icat ion of pharmaceutical-grade plasmid DNA using tangential fl ow fi ltration and multi-step chromatography[J]. Journal of Bioscience and Bioengineering,2013,116(3):281-286.
本文作者于晓辉、李启明、李秀玲、沈荣、张爱华、张云涛,中国生物技术股份有限公司、北京生物制品研究所有限责任公司、兰州生物制品研究所有限责任公司。