口服药物制剂的生物利用度和治疗效果与胃肠道环境中药物活性成分的溶解能力、吸收或渗透情况有关,溶出是控制药物吸收的关键步骤,因此,溶出度试验不仅在口服固体药物制剂的研发与质量控制中发挥着不可或缺的作用,而且在半固体制剂、透皮制剂、吸入制剂、微球等复杂制剂或新型药物剂型中也得到越来越多的应用。
日本药品管理部门开展了“药品品质再评价工程”并建立了日本橙皮书,美国食品药品监督管理局(U.S.Food and Drug Administration,FDA)也建立了“固体制剂溶出度数据库”,故而中国也有建立溶出度数据库的计划。
溶出度技术中的篮法和桨法最早作为质量控制方法被广泛应用,但由于溶出介质的体积、溶出装置及流体动力学特征等与体内生理环境的差异,存在一定的局限性。随着制药技术的发展和生物药剂学在药品监管科学中的应用,传统溶出装置和方法在口服固体制剂特别是缓控释制剂(modified release,MR)和新型制剂的研发与质量控制中遇到了越来越多的挑战。
近年来,药品监管机构期望申报机构在药品研发阶段建立既能区分药物不同处方、生产工艺,又能预测药物体内行为或具有体内外相关性(in vitro-in vivo correlation,IVIVC)的溶出方法。目前,《美国药典》(United States Pharmacopeia,USP)、《英国药典》(British Pharmacopoeia,BP)及《欧洲药典》(European Pharmacopoeia,EP)除篮法与桨法外,均收载了往复筒法,见表1。
研究表明,往复筒法可避免样品在溶出杯底部堆积,对不同处方、工艺的样品具备更好的区分力,可更好的模拟体内的胃肠道变化,并且对于质量控制研究也具有较好的借鉴意义。
国内外关于往复筒法的研究历史相对较短,我国对于该方法的研究也刚刚起步。据了解,国内已有上市药物制剂采用往复筒法进行溶出行为考察,也有一些仪器公司正在开发该装置。
《中华人民共和国药典》(Chinese Pharmacopoeia,ChP)2020年版在溶出度和释放度测定法通则中增订了往复筒法。借此契机,本文对往复筒法的历史发展背景、装置组成和工作原理、主要特点及在药物制剂中的应用进行了回顾,并对往复筒法未来的发展进行展望,为今后往复筒法在国内的应用提供参考。
发展历史
往复筒法的历史最早可以追溯到20世纪70年代,伦敦大学的Arnold Beckett教授等提出使用旋转瓶法评估缓控释制剂特别是微丸的溶出特性,这种方法创造了与篮法和桨法的运动状态完全不同的流体力学系统。
该装置为采用pH梯度的介质开展溶出研究提供了可能,也为模拟药物制剂在胃肠道内的过程提供了新思路。但由于转瓶法操作烦琐以及未能实现自动取样等系统自动化方面的局限性,没有获得更多相关机构的认可和应用。
20世纪80年代,Arnold Beckett教授提出了往复筒法设计,并委托英国GB Caleva Ltd.公司制造,这是第一个往复筒法装置的原型机。
随后,Vankel公司在Beckett教授的授权下,继续优化设计,实现了与自动取样器、紫外可见分光光度仪(UV/VIS)和HPLC等分析仪器设备的灵活联接和商业化生产,将该装置命名为BIO-DIS,意为可模拟人体生理环境的溶出装置并注册成为其商品名。
1996年,在Arnold Beckett教授的指导下,美国Logan公司设计了DISSOⅢ-Classic装置;后续推出的ADRⅢ-7,实现了往复筒法与往复支架法的一体化设计,并进行了仪器自动化的改进。
20世纪90年代,ERWEKA公司收购了英国GB Caleva Ltd.公司,开始生产销售往复筒法设备,该设备亦可实现往复筒法与往复支架法的一体化。
以往国内往复筒法溶出仪用户的国外供应商为Agilent、ERWEKA、LOGAN;目前,天大天发、富科思和深圳锐拓等国内企业也实现了往复筒法溶出仪的商业化生产和销售;另外,印度的ElectroLab等公司也有往复筒法设备,但是国内市场比较少见。
往复筒法继承了旋转瓶法良好的流体力学特性,能自动切换不同pH梯度的溶出介质和不同的往复速率,可更好地模拟药物制剂在胃肠道内的过程。
1991年往复筒法首次被USP收载,1993年USP对马来酸氯苯那敏缓释片、茶碱缓释颗粒和磷酸丙吡胺缓释颗粒进行协作标化研究,最终选定茶碱缓释颗粒和马来酸氯苯那敏缓释片作为往复筒法校正用缓释制剂。
2004年后,取消了茶碱缓释颗粒,只采用马来酸氯苯那敏缓释片作为校正用缓释制剂。往复筒法作为标准方法已有近30年的历史,方法较成熟,且已被USP、BP、EP及ChP收载。
据近年关于FDA溶出数据库的研究报告:桨法是溶出度检查项中最常用的方法,也是普通口服固体制剂(immediate relaease,IR)体外溶出研究的首选方法;在溶出数据库方法中,桨法占总方法的70%,篮法占17%,其他方法约占13%(主要为往复筒法或往复支架法)。
随着各国药品监管机构及药典对于既具有体外区分力,又能预测体内的溶出度方法的期待,往复筒法也将受到药品研发、生产和监管机构专业人员更多的关注。
仪器装置及其工作原理
仪器组成
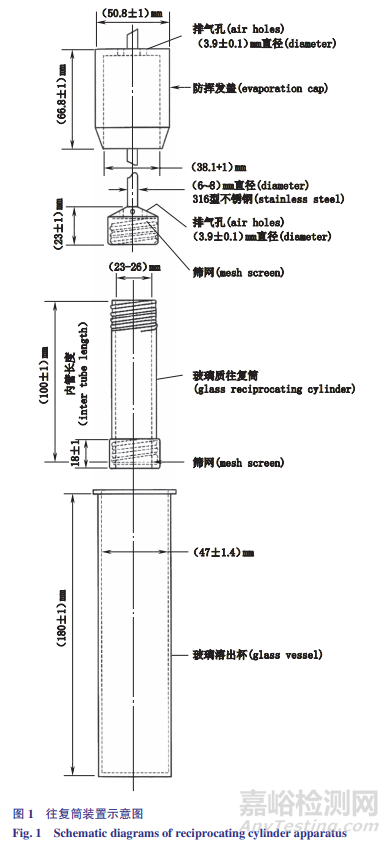
往复筒法的仪器主要由多排平底圆柱形溶出杯、内部的两端带有塑料材质帽子的玻璃往复筒、尼龙或不锈钢材料制成的抗吸附筛网、带动往复筒在玻璃容器内垂直往复运动的金属棒以及加热水浴槽组成,其示意图见图1。
工作原理
在测定过程中,将装有溶出介质的圆柱形溶出杯置于恒温水浴中,将样品放置在玻璃往复筒中,筛网装在往复筒顶部和底部,然后将塑料帽与金属棒连接,置于大小合适且保持在37℃±0.5℃水浴的玻璃容器中,并使往复筒在溶出杯中做浸入与浸出溶出介质的往复运动,透过筛网流经圆筒的溶出介质,在药物的溶出过程中提供了液-固界面剪切力。
USP规定上下往复的高度为9.9~10.1cm,为了达到理想的测定结果,使用该装置时要保持往复筒运动的持续稳定性(往复速率的变化保持在±5%范围内)。
当前排试验结束后,将圆筒上升离开介质,可进入下一排装有同种或不同种溶出介质的溶出杯中,然后按新设定的往复速率继续试验。
该装置的溶出杯设计成平底圆柱形,除另有规定外,标准装置的最大容积约300mL,通常放置200~250mL的溶出介质,最少不能低于150mL。相比于篮法和桨法,溶出介质体积的变化对试验结果影响较大,因此,在装置中均安装了防蒸发盖(如图1所示),减少溶出介质体积的变化。
采用往复筒法的溶出介质体积一般为250mL,为了满足难溶性药物溶解的漏槽条件,除了在介质中添加适量表面活性剂或采用生物溶出介质外,还可以通过更换溶出杯来实现,既保持药物的持续溶解,又符合药物制剂在胃肠道内溶解释放和吸收的动态情况,从而使所用体积具有一定的灵活性。
虽然通过其他措施可以在一定程度上克服溶出体积的影响,但是,除非对已有标准装置进行改装,扩大溶出杯的体积外,目前标准装置还不能在更大程度上灵活调节介质体积。
从原理上看,往复筒法应当适用于几乎所有的口服固体制剂和非溶液型制剂的溶出研究,但可能由于溶出介质体积的限制,使得这一具有通用性的方法未能得到更多的应用。
往复筒法仪器装置一般有7个通道,6排溶出杯,通常情况下,6个通道用于测定样品,1个通道用于标准溶液对照,各通道可独立运行,相互之间不受干扰。
在整个测试过程中,首先计算得到各溶出时间间隔内的溶出量,累积溶出量为规定溶出时间内各溶出间隔的溶出量之和,进而绘制累积溶出曲线。
往复筒法的特点
溶出介质组成的灵活性
药物口服进入体内,在胃肠道中溶解释放后被机体吸收而发挥作用,人体内环境会随着食物摄入等正常生理活动的变化而变化,因此,为了更好地预测体内的生物利用度,进行体外溶出或释放测定时,应尽可能地模拟药物在胃肠中的状况。
一般采用盐酸或醋酸缓冲液(acetic acid buffer solution,ABS)模拟胃液环境,pH6.8的磷酸盐缓冲溶液(phosphate buffer solution,PBS)模拟肠液环境,但这只能反映胃肠道pH的变化,不能真实地反映出胃肠道实际状况(缓冲能力、渗透压、表面张力、粘度等)。因此,为了预测食物效应对药物溶出的影响,有必要采用生物相关性的溶出介质模拟空腹和进食状态下的胃肠道生理环境。
目前模拟空腹状态下胃液(fast state simulated gastric fluid,FaSSGF)、进食状态下胃液(fed state simulated gastric fluid,FeSSGF)、空腹状态下肠液(fast state simulated intestine fluid,FaSSIF)和进食状态下肠液(fed state simulated intestine fluid,FeSSIF)的溶出介质的主要组成如表2所示。
对于难溶性的生物药剂学分类系统(biopharmaceutical classification system,BCS),Ⅱ类和Ⅳ类药物可适当地添加表面活性剂等方法改善其溶解性,以便于更好地模拟体内环境,必要时还需要使用二甲硅油等消泡剂,避免产生气泡导致溶出介质体积变化或影响药物的溶出。
传统的篮法和桨法一般只能采用固定pH的介质,对于pH依赖型药物,很难适应开展处方筛选和比较研究的要求;对于难溶性的BCSⅡ类药物有一定的局限性;与药物制剂在胃肠道中实际溶出的环境相差大,很难预测体内效应。
往复筒法可以几乎不受限制地连续改变介质的pH或其他组成,考察一系列pH梯度或不同介质对药物释放的影响,既可以在单排溶出杯中进行多点取样,也可以将往复筒从一个溶出杯移动到下一个溶出杯,每个溶出杯可以填充不同的介质,使介质的组成具有极强的灵活性。
与此同时,往复筒法可提供更接近于人体胃肠道蠕动的复杂生理环境变化的介质条件,在模拟生理条件的变化方面具有明显优势。
Kerolayne等在一系列pH梯度介质中(pH1.2 HCl溶液中1h、pH4.5 ABS中2h、pH5.8 PBS中1h、pH6.8 PBS中5h、pH7.2 PBS中1h)测定格列齐特缓释片随时间变化的累积释放度,在采用往复筒法和模拟禁食胃肠道生物溶出介质的条件下,建立了IVIVC模型,拟合曲线后得到的相关性系数为0.9970,可达到A级相关,表明该方法能够建立良好的IVIVC。
流体动力学的灵活性
往复筒法的流体动力学模式由圆筒的往复运动产生,既可以通过改变装置的物理参数,比如圆筒底部的筛孔尺寸可以微调流体动力学,筛网尺寸越小,流体出入圆筒的阻力越大;也可以通过直接调整往复速率,获得不同的流体动力学模式。
往复速率通常在5~40dip·min-1的范围内变化,Missaghi等表示,对于含有苯海拉明的可膨胀基质体系,即使在低往复速率(8dip·min-1)下,往复筒中的流体动力学也能表现良好。
在适当的往复速率下,往复筒法可以产生与篮法或桨法相似的溶出曲线,故往复筒法可以作为一种通用方法替代其他的质控用溶出方法,并且提供了比篮法和桨法更具有区分力的溶出曲线,进而更好地反映制剂的释放特性,特别是评估缓控释制剂的性能更为突出。
Rohrs等证明往复筒法5dip·min-1的往复速率条件,相当于篮法或桨法中50r·min-1的搅拌速率。
与篮法或桨法相比,往复筒法几乎没有流体动力学死区,药物制剂会一直保留在往复内筒中且不会粘附在内筒的侧面,另外,未溶解的材料不会聚集在溶出杯的底部,避免了堆积效应对溶出的影响,使得溶出方法能更真实地反映药物制剂释放特性和溶出行为。
应用的局限性
相对于篮法和桨法,往复筒法所需要的溶出介质体积较小,对于规格较大、溶出较快且溶解度较高的药物,溶出过程中可能会出现过饱和的现象,无法满足漏槽条件,溶出介质的体积对于药物溶出的影响较大,此时,往复筒法就不太适用于该类药物的溶出。
另外,如果药物颗粒太小,或者药物崩散后样品粉末很细,未溶解的部分容易通过筛网进入到溶出介质中;如果药物黏性较大,样品粉末容易粘附在筛网上,出现堆积现象,使流体动力学发生改变,采用往复筒法对这些特殊制剂的溶出行为进行研究时,想要筛选出既能保证样品粉末不从筛网漏下或不粘附在筛网上,又能保证流体动力学性质的溶出方法,仍存在较大难度。
往复筒法在药物制剂中的应用
虽然往复筒法是在崩解仪的基础上建立的,但也可用于非崩解剂与咀嚼片溶出度的测定。目前USP41版中碘塞罗宁钠片、碳酸锂缓释片、硝苯地平缓释片、氟西汀迟释胶囊等9个品种采用往复筒法进行溶出度测定。
另外,在FDA的溶出度数据库中,有马来酸氯苯那敏缓释片、碳酸镧咀嚼片、维奈妥拉片等6个品种采用往复筒溶出度测定法。因为往复筒法可以自主改变介质的pH和组成,故在Klein等和Li等的文章中,使用该装置用于测定pH敏感依赖型制剂的释放曲线。
此外,除装置独特的优点外,往复筒法还具有很强的通用性,不仅适用于普通的片剂、胶囊剂等口服固体制剂,还可以通过在往复筒内添加玻璃珠等材料,开展缓控释制剂、微丸、软胶囊、定位释放制剂、定时释放制剂及肠溶迟释制剂等新型药物制剂的溶出度研究。
在口服缓控释制剂中的应用
口服缓控释制剂按照其结构以及其释药机理,大致分为骨架型、膜控型与渗透泵型3种,主要释药原理有溶出、扩散、溶蚀、渗透泵与离子交换等。
缓控释制剂在体外评价时应研究不同pH条件下的释放,选择与体内吸收特性最相关的不同pH介质作为质量控制条件。由于往复筒法在介质选择上的优越性,国内外越来越多的研究者采用该方法对缓控释制剂体外释放度进行研究。
一些研究证实往复筒法能够预测缓控释制剂在体内的吸收情况,并且可以预测食物对药物释放的影响。
比如,Satomi等分别使用桨法、往复筒法与流通池法,在模拟禁食与饱腹状态下的多种生物溶出介质中进行溶出特性研究,使用去卷积法模拟体内药代动力学曲线,并与已发表的临床体内药代动力学数据进行比较,观察人体服用加巴喷丁恩那卡比缓释片后体内吸收曲线的可变性。
结果表明,与桨法和流通池法相比,通过在体外试验设计中引入胃排空的变异因素,往复筒法能够与制剂的体内性能建立良好的相关性,建立了预测口服加巴喷丁恩那卡比缓释片的体内药代动力学与食物效应的溶出度测定方法。
该研究表明,往复筒法能较好预测食物对多糖缓释骨架片释放的影响以及禁食状态下药代动力学特性。
在缓释微球制剂中的应用
微球是药物包载或吸附在高分子聚合物上形成的微小球状给药系统,具有长效缓释性与靶向性。目前国内对于微球的体外释放没有明确的指导原则和专家共识,一般认为采用流通池或往复筒法能够得到具有良好体内外相关性的溶出曲线。
Sandile等用往复筒法研究制剂辅料、往复速率等因素对溶剂蒸发法制备卡托普利微球的体外释放特性的影响。结果表明,在较低的往复速率下,微球周围的流动更平稳,更有规律,随着往复速率的增加(大于20dip·min-1),会导致涡流的形成,进而出现复杂的流体动力学模式。
由于微球是球形的,所产生的流体动力学行为会不同程度地对微球的溶出产生影响。在较高的往复速率下产生湍流的介质,可能会削弱包载微球的凝胶层,导致凝胶层的网状结构被破坏,进而使药物释放得更快。
研究发现,羟丙甲纤维素有利于增加微球的悬浮力,但形成的凝胶层较薄,易被破坏;丙烯酸树脂能够降低药物在溶出介质中的渗透性,延迟微球的释放,Trapani等也证实丙烯酸树脂是一种良好的药物分散材料,常用于肠溶包衣材料与控释药物制剂的制备,故选择联合使用羟丙甲纤维素与丙烯酸树脂制备卡托普利微球能够产生良好的释药特性。
在口服普通制剂中的应用
目前,口服普通(常释)制剂通常选择篮法或桨法进行释放度的测定,往复筒法可以帮助研究者获得更具有体外区分力的溶出曲线并能更好地预测体内的释药情况。
Brenda等采用篮法、桨法和往复筒法,通过选择不同的往复速率和筛网孔径大小等条件,对比研究了氢氯噻嗪、阿替洛尔和卡托普利3种不同BCS分类系统的抗高血压普通制剂的体外释药情况,研究结果表明,往复筒法能够得到与篮法、桨法相似的溶出曲线,且往复筒法能更好地区分不同质量属性的药物。
另外,Yu等以高溶解性的美托洛尔和雷尼替丁,低溶解性的阿昔洛韦和呋塞米为模型药物,通过桨法(50r·min-1)和往复筒法(5、15和25dip·min-1)分别测定了原研和仿制片剂的溶出曲线,并用f2相似因子法比较了2种方法的溶出曲线。
研究发现,在极低的往复速率下(如5dip·min-1),往复筒法给出了相当于桨法50r·min-1下的流体动力学条件。在适当的搅拌速率下,往复筒法得到的美托洛尔、雷尼替丁和阿昔洛韦片剂的溶出曲线与桨法类似,且具有良好的区分力,但呋塞米片未能实现完全溶出。
虽然往复筒法主要用于缓释药物的溶出/释放度测定,但其也可用于美托洛尔和雷尼替丁等溶解性良好的药物制剂,以及阿昔洛韦等难溶性药物制剂的溶出度测定。
在肠溶迟释制剂中的应用
肠溶制剂是指由肠溶包衣材料制成的制剂,属于延迟释放制剂,目的是避免药物在胃液中释放,确保药物到达肠道快速释放后被人体吸收。
目前国内外对于肠溶制剂的溶出度测定主要采用篮法与桨法,分别测定人工胃液中与缓冲液中的释放量,但改变溶出介质操作较烦琐,酸液的残留也可能会对测定产生影响。而往复筒法可以方便解决介质转换的问题,更好地开展肠溶包衣制剂的释放特性研究。
Joshi等采用往复筒法在0.1mol·L-1的盐酸溶液2h,pH6.8磷酸盐缓冲液45min的条件下,研究溶出介质体积(150、200、250mL)和往复速率(5、15、25dip·min-1)对异烟肼肠溶微丸释放的影响,通过响应面法进行实验设计、建立数学模型和优化研究,最终拟合出往复速率25dip·min-1、介质体积225mL的最优溶出条件,方法学验证结果表明,该溶出试验的条件具有较好的准确性与稳定性。
对于酸敏感型药物的肠溶制剂,Janice等分别采用桨法(75r·min-1)与往复筒法(30dip·min-1),研究美沙他酮骨架片在含有2%十二烷基硫酸钠的pH1.5、3.0、4.5、6.8、7.4和纯水的溶出介质中的释放情况。
桨法在不同溶出介质中溶出度结果进行比较,药物在pH1.5溶出介质中的释放量最小,平均释放量为7.2%±0.7%;75min后,药物在pH4.5与纯水溶出介质中释放量较高,分别为96.3%±3.0%、91.9%±7.0%;但在pH7.4的溶出介质中不能完全释放,释放量为55.7%±15.0%,说明溶出介质的pH对美沙他酮骨架片的溶出具有显著影响。
往复筒法的溶出结果与桨法一致,在pH1.5、4.5、6.8的溶出介质中的释放度分别为3.3%±0.3%、78.8%±6.3%、90.2%±4.5%,但往复筒法可以方便地同时改变所有介质的pH,能更可靠地评估pH对药物溶出的影响。
在结肠定位制剂中的应用
口服结肠定位给药系统是指通过适当的处方工艺,使药物避免在胃、十二指肠、空肠与回肠释放,定位在结肠释药的制剂,具有避免首过效应,提高结肠治疗作用的优点。目前未见针对结肠靶向制剂释放研究的指导原则,一些团队采用往复筒法对结肠给药系统的体外释药行为进行了研究。
Wong等采用往复筒法考察了以瓜尔胶为主要辅料的复方地塞米松与布地奈德结肠给药制剂,在模拟胃液(simulated gastric fluid,SGF)、模拟肠液(simulated intestine fluid,SIF)与模拟结肠液(simulated colon fluid,SCF)中药物的释放情况。
瓜尔胶是一种用于回肠、盲肠和结肠远端递送和释放的可生物降解材料,结肠生理环境下会产生半乳甘露聚糖,药物溶出的速率与半乳甘露聚糖的浓度有关。
研究表明,在装有SGF、SIF和SCF溶出杯中的往复速率分别为20、20和3dip·min-1,释放介质中半乳甘露聚糖浓度为0.01mg·mL-1时,2种药物在不同时间的释放度与禁食状态下患有溃疡性结肠炎的临床受试者的体内吸收情况一致。
此外,Klein等也开展了相似的研究,采用往复筒法和模拟禁食胃肠道介质,考察了咖啡因结肠靶向制剂的体外释放特性,将体外溶出曲线与12个健康受试者的体内吸收曲线通过数学模型建立了良好的体内外相关性,二者几乎完全吻合。已有研究表明,往复筒法对于预测结肠定位制剂的体内释药和吸收行为具有较好的指导和实用价值。
在软胶囊中的应用
近年来,由于软胶囊可以掩盖药物的不良气味,实现液态药物的固体化越来越受到欢迎。
软胶囊的溶出测定方法与片剂和硬胶囊类似,一般采用篮法或桨法测定,但对于含有油性溶液或多种原料药混悬液的软胶囊,在使用篮法或桨法测定的过程中,油滴可能悬浮在介质中,阻碍药物的释放。
采用往复筒法进行溶出测试时,可看到油滴能很好地分散在往复筒内,从而有效保证了测定结果的准确性。因此,除了流通池法外,科学家也经常会选择往复筒法作为研发与验证软胶囊溶出度的替代方法。
在最近的一项研究中,采用篮法(150r·min-1)、桨法(100r·min-1)和往复筒法(30dip·min-1),在含有4%十二烷基硫酸钠的pH6.8的磷酸缓冲液中测定黄体酮软胶囊的体外溶出度,结果表明,90min内药物释放均达到85%以上,但往复筒法能明显区分4种粒径不同、制剂中卵磷脂含量不同的黄体酮软胶囊制剂。
值得注意的是,溶出速率与卵磷脂的含量相关,因为卵磷脂可以增加悬浮液体的分散性,另外粒径越小,粘度越高,溶出速率越低。
Jantratid等也证实往复筒法可成功用于填充脂质的软胶囊的释放研究,该研究表明,与桨法相比,往复筒法可使脂质材料在介质中获得更充分的分散,具有显著优势。
总结与展望
往复筒法装置的特点和已有研究表明,在模拟药物制剂的体内溶出性能及体内外相关性研究中其具有明显的优势,能够便捷地改变介质的pH和组成,往复速率,在每个溶出杯中的往复时间等参数,必要时可添加适当的表面活性剂与消泡剂。
为了更好地模拟空腹和饱腹的体内状态,可根据具体品种的性能加入合适粒径的惰性玻璃珠,模拟药物颗粒在胃肠道中的运动。
往复筒法还可以方便地借鉴流通池等针对不同制剂的装置,使其具有更好的通用性。
尽管往复筒法有诸多优点,但仪器的参数较多,对试验结果的影响因素也就相对复杂,因此,为保证实验数据的可靠性,建议实验人员在使用往复筒法溶出仪前,需要仔细检查玻璃往复筒的内壁及上下塑料盖是否有残留物,是否有划痕与裂纹,所用的筛网是否有损坏等,尽可能减少仪器本身所带来的误差,进而保证数据的准确性和可靠性。
另外,不同来源或型号的仪器可能对特定制剂的溶出特性产生显著影响,因此,在方法开发过程中,应关注不同仪器装置对溶出曲线的影响,制定合理的溶出限度,避免不同实验室对同一产品的测定结果产生争议。
在仪器的开发与应用方面,随着一些复杂的新型制剂的出现,对于溶出度测定方法进行体外评估的技术要求越来越高,往复筒法还有待于进一步的补充和完善。
2012年USP取消了对于往复筒法的标准片的强制要求,由于对往复筒法溶出仪的研究比较少,因此,需要进一步探索建立适当的仪器性能评价方法。据了解,基于药物溶出/吸收仿生系统的研究,已有仪器公司开发出往复筒法溶出仪与仿生渗透系统联机的生物等效性预测装置,这为今后往复筒溶出仪的应用提供了新途径。
在实际应用时,往复筒法具有较好的体外区分力和相当的体内相关性,建议制药企业与科研院所综合考虑实验的经济成本与可操作性,结合具体品种的体外释放与体内吸收的情况,在深入全面地进行质量研究的基础上,对日常质控方法做出合理的选择。
综上所述,随着制药行业的不断发展,由于篮法、桨法等传统溶出度测定方法的固有局限性,在评估药物制剂的体外释放行为时面临更多的挑战,对于具有体外区分力和体内预测性的药物体外评估方法的研究和应用,既是药品监督机构的关注重点,也是科学进步的必然,而往复筒法的研究与开发正是顺应了这一发展趋势。
近年来,国内外越来越多的企业、高校及科研院所逐渐将往复筒法用于药物的研究中,碳酸锂缓释片、氟西汀缓释胶囊等国内批准上市的药物制剂已经采用了往复筒法进行溶出度的测定。
目前正在开展的口服固体制剂一致性评价工作中,由于品种的多样性,不同品种适用的溶出方法也不尽相同,往复筒法的引入将为相关品种的一致性评价工作发挥积极的作用。