今日头条
英矽智能QPCTL抑制剂获批临床。英矽智能1类化药ISM8207胶囊获国家药监局批准开展I期临床试验,拟用于治疗晚期恶性肿瘤患者。ISM8207是一款靶向QPCTL的潜在“First-in-class”小分子抑制剂,通过阻断“别吃我”信号来攻击肿瘤细胞,模拟CD47抗体的治疗作用;并通过抑制化学趋化因子活性,重塑肿瘤内髓系细胞组成,使其具有促炎性特征,增强免疫检查点抑制剂的抗肿瘤疗效。
国内药讯
1.东阳光安泰他韦胶囊报丙肝NDA。东阳光1类化药磷酸安泰他韦胶囊的上市申请获CDE受理。安泰他韦是一款丙肝病毒(HCV)NS5A抑制剂。该新药已在2021年6月登记启动一项与英强布韦片联合治疗成人慢性丙肝的II/III期临床试验,该项研究已于2023年5月完成。值得一提的是,东阳光开发的另一款同靶点药物依米他韦已于2020年获批上市,与索磷布韦片联用治疗成人基因1型非肝硬化慢性丙型肝炎。
2.药华创新长效干扰素Ⅱ期临床见刊。药华医药旗下药华生物长效单聚乙二醇化脯氨酸干扰素皮下注射剂ropeginterferon alfa-2b(P1101)治疗真性红细胞增多症(PV)的中国Ⅱ期临床成果发表于期刊Experimental Hematology & Oncology上。24周治疗结果显示,有60.22%的患者达到完全血液学缓解(CHR),明显高于境外PROUD/CONTI-PV研究(52周CHR为43.1%);而且药物耐受性较好。
3.维立志博GPRC5D/CD3双抗获批临床。维立志博研发的1类新药GPRC5D/CD3双抗LBL-034已分别获得NMPA和FDA的临床许可,即将在两国同步开展首次人体Ⅰ期临床,评估用于治疗复发/难治性多发性骨髓瘤的安全性、耐受性和初步疗效。LBL-034采用独特的分子设计,能特异性结合到表达GPRC5D的肿瘤细胞上,减少对T细胞的非特异性激活的风险,并增强抗肿瘤疗效。
4.浙江博锐LIV-1靶向ADC获批临床。浙江博锐生物基于其CysLink不可逆化学偶联技术平台开发的靶向LIV-1的第三代ADC药物BRY812获国家药监局临床试验默示许可,拟开发用于晚期恶性肿瘤的治疗。LIV-1又称SLC39A6或ZIP6,是一种多次跨膜蛋白,具有锌转运蛋白和金属蛋白酶活性,在多种癌症中异常表达。目前,全球尚无同靶点药物获批上市,博锐生物BRY812将成为全球第二个进入临床开发的LIV-1靶向药。
5.智康弘义CD3/EGFR双抗获批美国临床。智康弘义CD3/EGFR双抗BC3448用于治疗晚期实体瘤的I期临床试验申请获得FDA批准。BC3448采用非对称的亲和力设计,其结合EGFR的亲和力较结合CD3的亲和力高两个数量级,在保证抗肿瘤活性的同时减少CD3可能引起的CRS副作用(细胞因子释放综合征)。BC3448已在国内开展的I期临床中完成数个剂量组爬坡,并表现出良好的安全性。
6.康方生物发布2023年H1盈利预告。康方生物日前发布2023年上半年盈利预告,预期将录得利润不低于人民币23亿元,是该公司首次实现半年度盈利。转亏为盈主要原因有:康方已于去年12月将全球首创PD-1/VEGF双抗依沃西(AK112/SMT112)在美国、加拿大、欧洲和日本开发和商业化权益授予Summit公司,并于2023年第一季度收到总计约5亿美元的首付款;PD-1/CTLA-4双抗卡度尼利单抗(AK104)在2022年6月获CDE批准上市,用于治疗复发或转移性宫颈癌。
国际药讯
1.美国2024年新药申请费将突破400万美元。FDA日前公布2024财年的《处方药使用者付费法案》(PDUFA)费用计划。该《付费法案》明确,对于需要临床数据的新药申请,药企需向FDA支付超400万美元,较2023年的320万美元同比增长约25%;对于不需要临床数据的新药申请,费用也将从2023财年的160万美元涨到约200万美元。据悉,需要临床数据的新药申请费用近6年来已上涨了120万美元。
2.经颅直流电疗法抑郁症临床数据积极。Flow Neuroscience公司经颅直流电刺激疗法Flow tDCS在治疗抑郁症的关键临床获积极结果。Flow tDCS的刺激部位是大脑左额叶(控制人类某些认知技能及情绪表达的关键部位)。结果显示,Flow tDCS治疗使抑郁症状改善超过50%的患者比例达到62%,完全缓解率为56%;Flow tDCS的治疗效果是常用抗抑郁药的两倍。此外,治疗组无重大副作用报告。
3.阿斯利康向BMS支付5.1亿美元专利纠纷款。据外媒证实,阿斯利康已支付5.1亿美元用于解决与百时美施贵宝和小野制药就PD-L1抑制剂Imfinzi和CTLA-4抗体Imjudo的所有专利纠纷。去年3月,BMS向特拉华州地方法院提起诉讼,起诉阿斯利康的Imfinzi侵犯至少8项与Opdivo相关的专利权。今年1月,BMS又起诉阿斯利康的Imjudo侵犯其重磅药物Yervoy相关的专利。根据阿斯利康今年半年报,Imfinzi上半年销额达19.76亿美元,同比大涨57%。
4.默沙东2023H1总收入295亿美元。默沙东公布2023年H1业绩报告,上半年总营收295.22亿美元(-3%),其中Q2收入150.35亿美元(+3%);研发支出175.97亿美元(+227%)。上半年,默沙东制药业务收入261.79亿美元(-3%);其中中国区收入35.81亿美元(+13.7%);帕博利珠单抗(Keytruda)和HPV疫苗Gardasil/Gardasil 9共计164.95亿美元,占该部分收入63%,其中K药上半年销售额达到120.65亿美元,同比增长20%。
5.Revolution公司超10亿美元收购EQRx公司。Revolution公司与EQRx公司达成合并协议,以全股票交易的方式收购后者,交易金额超过10亿美元,预计将于今年11月完成。这项交易将增强Revolution公司在多种RAS驱动癌症中广泛使用RAS(ON)抑制剂的并行开发方法。EQRx公司专注于以大众化价格生产创新药物,主要从事发掘、开发和商业化创新药物的业务。该公司管线中的5款产品均来自于外部引进,其中舒格利单抗、nofazinlimab和LNK01001的权益已在今年Q1悉数退还。
6.BioNTech公司5亿欧元收购AI药物公司。BioNTech公司宣布完成对AI药物研发公司InstaDeep的收购。InstaDeep专有的技术平台DeepChain是一款基于语言模型的蛋白设计工具,它能够根据需求,自动生成现有蛋白上的突变,具有更好的结合能量特征(binding energy profile);针对携带不同突变的蛋白变体,这一平台也能自动进行分子动态模拟,在进行实验之前对蛋白变体的特征进行评估。2022年,BioNTech还参与了InstaDeep的B轮融资。
医药热点
1.WHO将Omicron EG.5列入变体监测名单。世卫组织近日在其最新的每周更新中指出,随着追踪COVID-19活动情况的大多数指标下降,EG.5被列入Omicron变体(VUM)监测名单。EG.5是XBB.1.9.2的后代,有一个额外的尖峰突变。自5月底以来,全球流行率在持续上升。世卫组织现有七个VUM,其中值得关注的变体数量仍为两个,包括正在稳步下降的XBB.1.5和稳定在20.7%序列中的XBB.1.16。
2.桂林医学院更名为桂林医科大学。7月31日,广西教育厅网站发布《广西壮族自治区教育厅关于拟申报设置有关高等学校的公示》,经广西壮族自治区高等学校设置评议委员会考察和评议,桂林医学院更名为桂林医科大学。桂林医学院创建于1935年,前身为广西省立桂林高级助产护士学校。1958年学校升格为桂林医学专科学校,1987年升格为桂林医学院。
3.2022年度电子病历高评级医院公示。7月31日,《国家卫生健康委医院管理研究所关于公示2022年度电子病历系统功能应用水平分级评价新增高级别医疗机构结果的通知》印发,将2022年度电子病历系统功能应用水平分级评价通过五级及以上新增医疗机构拟定名单予以公示。名单显示,2022年度五级及以上新增医疗机构共89家,其中五级机构80家、六级机构8家、八级机构1家。此次获评电子病历系统功能应用水平分级评价为八级的医疗机构是中国医学科学院阜外医院,为全国首家。
评审动态
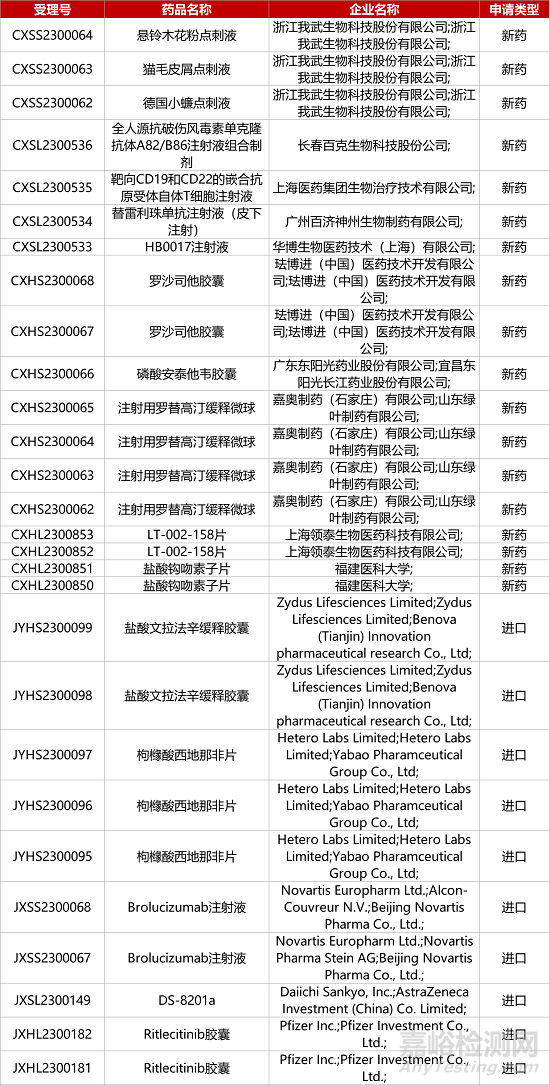
1. CDE新药受理情况(08月02日)
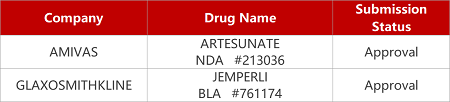
2. FDA新药获批情况(北美07月31日)