引言
在《药品共线生产质量管理指南(征求意见稿)》出台之前,制药企业常用的清洁限度的算法有最低日治疗剂量的1/1000、10ppm、半数致死量LD50, 2021年11月,中国CFDI出台了《药品共线生产质量管理指南(征求意见稿)》,提供了更具有科学性和优势的方法,即基于健康的暴露限度(ADE/PDE)。
本文就这四种清洁限度算法进行详细解析,并举例对比,为制药企业科学合理的选择清洁限度算法提供一些思考。
1、清洁限度算法详解
1.1 最低日治疗剂量的1/1000
(1)概念
最低日治疗剂量的1/1000是指:下批产品的最高日服用剂量中含有上批产品的量不应超过上批产品的最低日治疗剂量的1/1000,以此标准来确定残留物限度。
(2)计算
MTDa:清洁前产品(目标化合物)最小每日给药剂量中的活性成分含量(mg);
Bb:清洁后产品的批量(支/瓶);
Ub:清洁后产品的每支含量(mg);
MDDb:清洁后产品(目标化合物)最大每日给药剂量中的活性成分含量(mg);
(3)公式解析
①a品种专用
MTDa对特定品种a是固定值,根据生产线所有品种,选择 最小值,即为a品种专用限度。
最小值,即为a品种专用限度。
②全品种可用
根据生产线所有品种,选择MTD最小值,选择 最小值,即为该生产线全品种皆可用限度。
最小值,即为该生产线全品种皆可用限度。
1.2 残留物浓度10ppm
(1)概念
《药品生产验证指南》指出除高活性,高致敏性药品外,10ppm是足够安全的,衍生出了以10ppm为限度计算残留物浓度,即,将10ppm简化为最终淋洗水中样品残留物浓度限值为10ppm。
(2)计算
Bb:清洁后产品的批量(kg);
10ppm:10×10-6,即10mg/kg;
F:为安全因子系数,根据风险评估,一般取2-10;
(3)公式解析
①全品种可用
根据生产线所有品种,选择最小批量进行计算,即为该生产线全品种皆可用限度。
1.3 基于毒理数据半数致死量(LD50)
(1)概念
半数致死量(LD50)相较于其他毒理数据是易于得到的,基于毒理数据半数致死量(LD50)计算清洁限度是指,通过将半数致死量(LD50)合理外推为NOEL(无可见作用水平),再进一步将NOEL(无可见作用水平)外推为ADI(日允许摄入量),从而计算产品的清洁限度。
(2)计算
ADI:每日允许摄入量(mg);
Bb:清洁后产品的批量(支/瓶);
Ub:清洁后产品的每支含量(mg);
MDDb:清洁后产品(目标化合物)最大每日给药剂量中的活性成分含量(mg);
SF:由NOEL推导至ADI的安全因子,对于制剂,一般取1000;对于API,一般为100~1000;对于清洁剂的残留计算,若为外用制剂为10~100,若为固体制剂为100~1000,若为注射剂为1000~10000;
BW:服用清洁后产品的患者体重,通常使用50kg;
2000为由LD50推导至NOEL的安全因子;
(3)公式解析
①a品种专用
根据生产线所有品种,选择 最小值,即为a品种专用限度。
最小值,即为a品种专用限度。
②全品种可用
根据生产线所有品种,选择LD50最小值,选择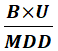 最小值,即为该生产线全品种皆可用限度。
最小值,即为该生产线全品种皆可用限度。
1.4 基于健康的暴露限度(ADE/PDE)
(1)概念
可接受日暴露剂量(ADE)或允许日接触剂量(PDE)是指患者终生每天暴露于该浓度,但对健康的不良影响仍处可接受风险水平。CFDI发布的《药品共线生产质量管理指南(征求意见稿)》中认可了活性物质残留限度标准应当基于产品毒理试验数据或毒理学文献资料的评估建立,基于健康的暴露限度(HBEL)的可接受标准(如ADE/PDE值)在评估清洁残留数据时比传统方法更具有科学性和优势。
(2)计算
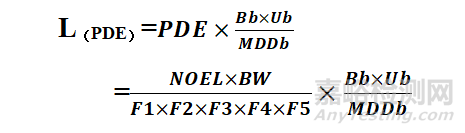


(3)公式解析
①a品种专用
根据生产线所有品种,选择 最小值,即为a品种专用限度。
最小值,即为a品种专用限度。
②全品种可用
根据生产线所有品种,选择 最小值,选择
最小值,选择 最小值,即为该生产线全品种皆可用限度。
最小值,即为该生产线全品种皆可用限度。
2、举例计算某一生产线的清洁限度
某一生产线已有在产品种3个分别为品种A、B、C,现计划增加新品种D,需计算品种D的清洁限度。
2.1 生产线产品信息汇总

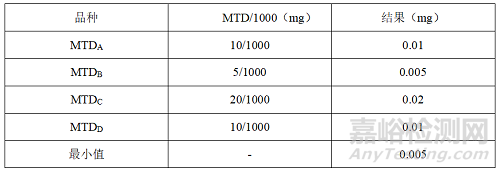
2.2 最低日治疗剂量的1/1000
(1)MTD/1000
(2) 
(3)D品种专用
(4)全品种皆可用
2.3 残留物浓度10ppm
(1)批量

(2)D品种专用

(3)全品种皆可用

2.4 基于毒理数据半数致死量(LD50)
(1)LD50
(2) 
(3)D品种专用
(4)全品种皆可用

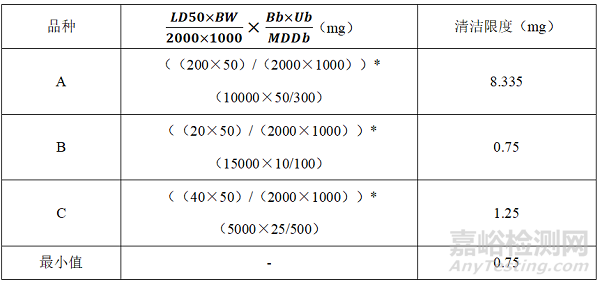
2.5 基于健康的暴露限度(ADE/PDE)
(1)PDE
(2)

(3)D品种专用

(4)全品种皆可用
3、上述计算方法的最小值
3.1 D品种专用
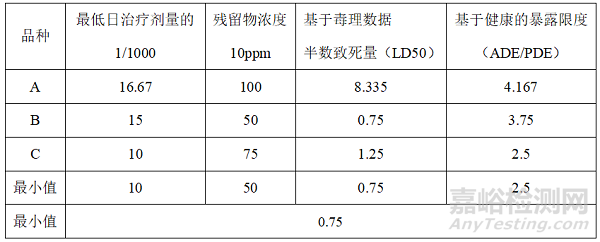
3.2 全品种皆可用
4、各国对清洁限度的要求
4.1 中国
参考《中国药品GMP指南》、《药品共线生产质量管理指南(征求意见稿)》、《GB/T36030-2018制药机械设备CIP/SIP通用技术要求》采用了四种计算方式,即最低日治疗剂量的1/1000、10ppm、半数致死量LD50、基于健康的暴露限度(ADE/PDE)。
《药品共线生产质量管理指南(征求意见稿)》虽然明确指出基于健康的暴露限度(ADE/PDE)是更具有科学性和优势的方法,但是制药企业现下还需基于上述四种计算方式,选择最低的限度作为清洁验证的控制限度。
4.2 欧盟
EMA《Guideline on Setting Health Based Exposure Limits for Use in Risk Identification in the Manufacture of Different Medicinal Products in Shared Facilities(在共用设施中生产不同药品使用风险辨识建立基于健康的暴露限度指南)》中明确指出,所有药品均应建立基于健康的暴露限度,并指出传统的最低日治疗剂量的1/1000、10ppm未考虑到目标残留物的毒理学数据,所得到的限度太严格或者控制不足,缺乏充足的科学依据。同时特别强调半数致死量LD50不能用于计算残留限度。
4.3 美国
FDA的《GUIDE TO INSPECTIONS VALIDATION OF CLEANING PROCESSES(清洁工艺指南)》也未明确建立统一的清洁残留方法,但提出了半数致死量LD50、基于健康的暴露限度(ADE/PDE)适用于高毒有害物质清洁残留的计算,毒理学阈值1.5 μg/天适用于基因毒物质清洁残留的计算,一般药品(非高毒高活、非基因毒等药品)则使用最低日治疗剂量的1/1000、10ppm、基于健康的暴露限度(ADE/PDE)计算清洁残留,选择最低值作为清洁残留限度。
5、科学合理的选择
根据对主流国家清洁限度计算方法的分析,比较认可的计算方法有最低日治疗剂量的1/1000、10ppm、基于健康的暴露限度(ADE/PDE),综合计算分析选择最低值作为清洁残留限度。
6、对国内制药企业的建议
CFDI并未摒弃半数致死量LD50,清洁残留限度需综合计算分析最低日治疗剂量的1/1000、10ppm、半数致死量LD50、基于健康的暴露限度(ADE/PDE),选择最低值作为清洁残留限度。
7、对清洁限度算法选择的思考
随着毒理数据的完备,使用更加科学合理的基于健康的暴露限度(ADE/PDE)计算清洁限度会成为主流算法。
基于综合分析,对清洁限度算法排序:基于健康的暴露限度(ADE/PDE)>最低日治疗剂量的1/1000>10ppm>半数致死量LD50
对于未查出基于健康的暴露限度(ADE/PDE)的品种可基于上述排序选择算法进行计算。
上述只是作者对怎么科学合理的选择清洁限度算法的一些思考,在CFDI未发布明确的清洁限度算法指导原则前,制药企业还需综合计算分析最低日治疗剂量的1/1000、10ppm、半数致死量LD50、基于健康的暴露限度(ADE/PDE),选择最低值作为清洁验证限度。
参考资料
1、《化学药品注射剂仿制药质量和疗效一致性评价技术要求》
2、《药品共线生产质量管理指南(征求意见稿)》
3、《中国药品GMP指南》
4、《GB/T36030-2018制药机械设备CIP/SIP通用技术要求》
5、《Guideline on Setting Health Based Exposure Limits for Use in Risk Identification in the Manufacture of Different Medicinal Products in Shared Facilities(在共用设施中生产不同药品使用风险辨识建立基于健康的暴露限度指南)》
6、《GUIDE TO INSPECTIONS VALIDATION OF CLEANING PROCESSES(清洁工艺指南)》
7、《Cross-contamination control and Health Based Exposure Limits (HBEL) Q&As交叉污染控制与基于健康的暴露限(HBEL)问答》
8、ICH Q3C:残留溶剂的指导原则
9、ICH Q3D(R2):元素杂质指导原则
10、ICH Q9 :质量风险管理
11、ICH M7:评估和控制药物中的DNA活性(致突变)杂质以限制潜在的致癌风险
12、《关于在清洁验证中引入HBEL的考量》
13、《APIC原料药工厂中清洁验证指南》


 最小值,即为a品种专用限度。
最小值,即为a品种专用限度。
 最小值,即为该生产线全品种皆可用限度。
最小值,即为该生产线全品种皆可用限度。

 最小值,即为a品种专用限度。
最小值,即为a品种专用限度。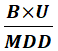 最小值,即为该生产线全品种皆可用限度。
最小值,即为该生产线全品种皆可用限度。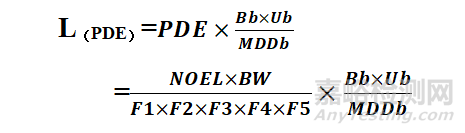


 最小值,即为a品种专用限度。
最小值,即为a品种专用限度。 最小值,选择
最小值,选择 最小值,即为该生产线全品种皆可用限度。
最小值,即为该生产线全品种皆可用限度。