许多游离药物具有溶解度低、稳定相差和安全性低在内的诸多特点而限制了其临床应用,纳米技术的进步为使用纳米颗粒进行药物递送创造了无限可能。FDA已经批准了约100种纳米药物上市,通常用作药物输送系统的纳米颗粒有包括脂质体在内的多种体系,它们的粒径范围从几纳米到几百纳米不等。它们通过装载药物使之提高稳定性,克服组织细胞的摄取阻碍,增加药物在体内靶位的富集,提高了药物的安全性与治疗效果。
图1:通常用作药物输送系统的纳米颗粒。a 脂质体b 病毒载体c 自组装蛋白d 聚合物纳米颗粒e 金属纳米颗粒f 单壁碳纳米。g树枝状聚合物h 具有核/壳结构的聚苯乙烯涂层磁性颗粒i胶束制剂
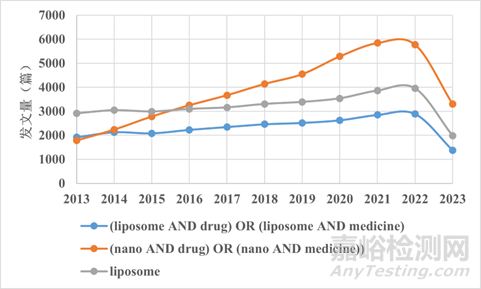
在Pubmed上以“纳米”、“脂质体”、“药物”为相关关键词来搜索相关研究,纳米相关药物的发文量在2016年后超过脂质体且较为迅速增长,脂质体相关研究中的药物研究占了很大比重,相关发文量都呈现增长模式,预计在不久后会有更多的实验室产品走到工厂或是市场,为各种疾病带来新的治疗机会。
图2:以纳米、脂质体和药物相关关键词搜索近10年出现的文章数
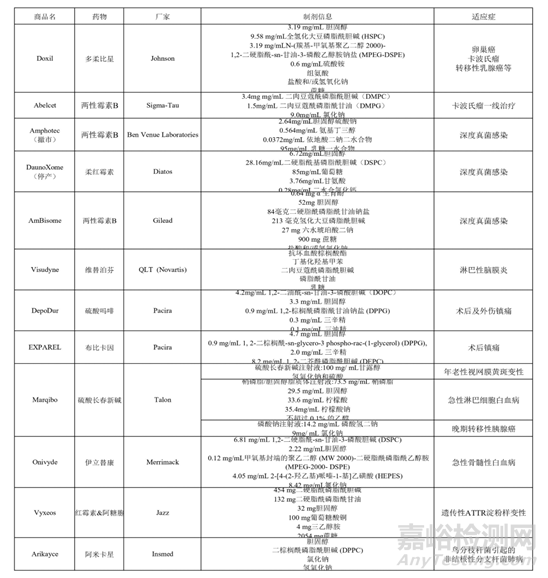
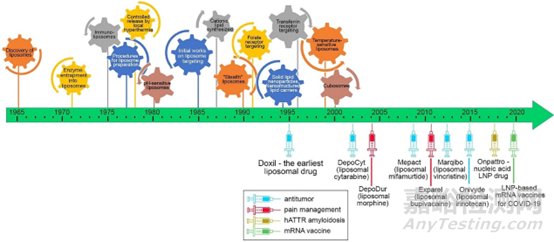
脂质体纳米平台应用包括生物医学诊断和生物化学中的信号载体、疫苗佐剂和纳米医学中的递送载体等一系列领域。1995年FDA批准Johnson的包载有盐酸阿霉素脂质体抗肿瘤药物Doxil上市,目前美国食品药品监督管理局(FDA)批准了多款脂质体药物上市,适应症也从单一的肿瘤领域拓展到了感染、炎症和镇痛一系列领域。
表1:FDA批准上市的脂质体药物
表2:新型脂质体(LNP)上市核酸药物/疫苗
图3:脂质体/脂质纳米颗粒(LNP,一种新型脂质体)发展时间轴
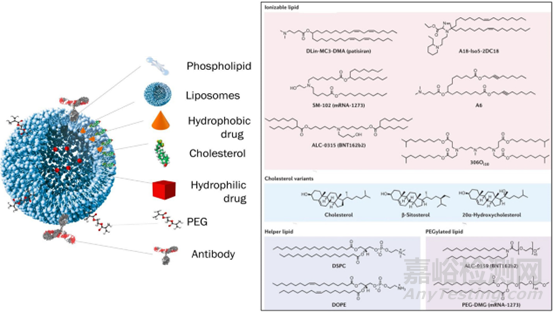
脂质体最早由Bengham在1960年代发现,后来成为最广泛的药物输送系统之一。脂质体是由磷脂和胆固醇组成的球形结构,脂类有天然与人工合成两类,磷脂结构可以带有电荷以便控制其吸收排布。脂质体表面可以带有电荷,由于电荷排斥可以起到稳定脂质体的作用,负电荷的存在(如DMPG)使得脂质体容易被巨噬细胞识别并且能够通过内吞作用进入细胞(速率比中性脂质更快),从而缩短循环时间,而带正电荷的脂质体可能与血液中的阴离子成分(如血浆蛋白)相互作用,被MPS摄取清除。事实上,带正电荷脂质体与带负电的核酸作用而有利于核酸的递送,目前两款新型脂质体技术包载的核酸疫苗(两种阳离子脂质为:SM-102/ALC-0315)便是利用了这个原理而使脂质体在抗击新冠疫情中大放异彩。胆固醇控制磷脂堆积、膜流动性和脂质体表面电荷的能力,脂质体中胆固醇的添加使脂质体在血流中的稳定时间从几分钟延长到了几小时。脂质体也可由单个或多个脂质双分子层组装而成,目前FDA批准上市产品大都为100nm左右大小的单层小囊泡。添加聚合物如聚乙二醇则有延长的其循环的特性(增加脂质体与血液中其他成分的空间位阻),保护负载药物免受灭活或代谢降解,进一步增强稳定性并改善细胞内摄入。脂质体成分中特定靶向成分的添加或进行功能化(使用多糖、糖蛋白或特定受体的配体)来达到靶向的作用(被动靶向主要应用于肿瘤的治疗,依靠于肿瘤血管特性来实现,而主动靶向主要是通过脂质表面的功能化来达到目的)。脂质体产品结构比较复杂,环境或结构的变化可能对脂质体而言是引起其安全性和有效性的挑战,脂质体药物的辅料中一般会添加一些其他成分,如pH缓冲用的柠檬酸/柠檬酸盐体系、渗透压调节用的氯化钠体系、稳定用的糖类。
图4:载药脂质体的常见结构以及组分化合物结构示意图
目前对于脂质体的制备已经有了许多的技术方法:薄膜水合法、乙醇/乙醚注射法、反相蒸发法、洗涤剂去除法、微流控法、膜挤出法、均质化、超声法、冷冻干燥方法、超临界流体方法等。对于制备完成的脂质体特征(粒径、电位、形态、相位和层状性)的评价则有许多种技术。
表3:脂质体参数评估的方法
|
特征
|
技术
|
|
粒径
|
显微镜、纳米颗粒跟踪分析(NTA)、动态光散射(DLS)、扫描/透射电镜(SEM/TEM)、原子力显微镜(AFM)、低温透射电镜(Cryo-TEM)
|
|
电位
|
电泳迁移率、DLS
|
|
形态
|
Cryo-TEM、TEM、AFM
|
|
相位特性
|
差示扫描量热法 (DSC)、X射线衍射 (XRD)、热重分析 (TGA)
|
|
层状性
|
Cryo-TEM 、核磁
|
脂质体的粒径大小影响着药物吸收与分布(体循环、清除、外渗、转运摄取等),理想的粒径在50-200nm范围之内。脂质体所带的净电荷为Zeta电位,电位的大小的绝对值影响着脂质体的稳定性。脂质体电位收到外部环境和离子强度的影响,绝对值较小的脂质体之间排斥力较弱,随时间的推移聚集的可能性较大。显微镜检测是对于脂质体形态检测最直接的方式,其中Cryo-TEM技术检测可以较好的保留脂质体的原始结构,最大限度减小脂质体形态的扭曲变化;AFM技术是一种快速、强大和非侵入性的技术,在脂质体原生条件下提供到高分辨率三维图像。脂质体相行为影响着脂质体的稳定性,DSC是脂质体相行为检测最常见方法。脂质体的层状性影响着药物的释放,Cryo-TEM是最常用的方法,它提供了关于脂质体层状双层厚度和双层的距离等信息。当然,每种技术有自己的优缺点,多种方法联合使用才能从多角度将脂质体的性质进行更加全面的表征。
脂质体的疏水外壳包裹着亲水内核,亲水性药物一般包裹在亲水内核中,而疏水药物则包裹在疏水外壳中,目前已经开发出了脂质体的主动载药法(一般发生在脂质体制备完成后阶段)(如Doxil、Marqibo、DaunoXome和Onivyde)和被动载药法(一般发生在脂质体制备过程阶段)(如AmBisome、Visudyne、Arikayce、DepoCyte、DepoDur和Expel)。Vyxeos则采用了组合方式载药(阿糖胞苷和柔红霉素)。目前还有第三种脂质体载药技术---化学偶联技术,具有合适的化学官能团将药物与脂质体连接来控制药物的负载与释放。
图5:脂质体的药物装载
我们在临床试验资料库(https://clinicaltrials.gov/)上以“脂质体”(liposome)为关键词进行所搜来汇总目前脂质体相关研究的临床情况,2019年后的疫情几年完成的临床数呈下降趋势。我们发现2020年后(近3年)有35项实验已经完成,其中有4项附有研究结果。
图6:以“脂质体”(liposome)关键词搜索近10年临床情况
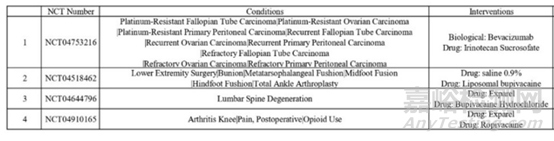
表4:临床研究部分信息
脂质体的临床研究主要方向是装载药物来对各种疾病进行治疗,研究1的试验调查了伊立替康脂质体和贝伐珠单抗在治疗对铂类治疗(铂类耐药)、复发(复发)或对治疗无反应(难治性)的卵巢癌、输卵管癌或原发性腹膜癌患者中的作用。研究2的目的是确定脂质体布比卡因与盐水在腰椎手术中减少阿片类药物使用的功效,并确定患者报告的结果和住院时间是否存在差异。研究3评估 Exparel、Exparel与盐酸布比卡因混合与盐酸布比卡因联合治疗下肢手术受试者术后镇痛的疗效、安全性和药代动力学。研究4探索Exparel(脂质体布比卡因)在内收肌管阻滞中的有效性(用于全膝关节置换术手术疼痛控制)。通过脂质体改善靶向部位的递送、提高疗效和降低的全身毒性,这是大多数进入临床试验脂质体新药的典型目标。
脂质体的出现,以其独特的性质而是许多药物为治疗疾病成为了可能,但是脂质体的组成(成分/纯度)、理化性质、稳定性、表征技术和一系列的临床药学研究(药代/药动/利用度等)仍有许多问题待解决,相信不久的将来在新方法的研究以及新技术的引入会刺激脂质体研究的进一步发展。
REFERENCE
1. Beltrán-Gracia E et al., Cancer Nano. 2019
2. Almeida B et al., Molecules. 2020
3. Gote V et al., Int J Mol Sci. 2023
4. Tenchov R et al., ACS Nano. 2021