摘要
方法:从项目全生命周期视角出发,分析创新药临床试验所属的复杂项目体系,探讨美国促进创新药临床试验开展的政策措施及监管经验,并提出对我国相关工作的建议。
结果与结论:创新药临床试验项目流程复杂且各主体利益诉求不尽相同,存在一定的监管难点。美国通过适时地颁布各类现代化监管计划及临床试验指导文件,促进了创新药临床试验在方案设计、审评审批、研究启动、伦理审查及数据共享等全生命周期流程的严谨性和高效性,为我国优化创新药临床试验的管理路径提出建议,探索“主方案”试验设计模式为新疗法临床试验提供进一步保障,通过优化的试验启动运作程序、独立审查与专科化伦理审查并行的机制及多样化数据共享模式,确保临床试验高效性,不断完善审评信息公开和利益相关者沟通机制,加强创新药临床试验立项引导。
药物临床试验是评价药物安全性和有效性最重要的依据,也是新药研发的关键环节。随着大量未被满足的临床需求的涌现以及我国对创新药研发政策支持力度的不断加大,大批自主创新药物步入临床研究阶段。从国家药品监督管理局药品审评中心(Center for Drug Evaluation,CDE)发布的年度药品审评报告来看,2019,2020及2021年完成的新药临床试验(investigational new drug,IND)审评申请分别为1021,1548及2412件[1],年均增长率高于50%,递增趋势显著。在全球同步研发方面,我国制药企业开展的国际多中心临床试验(multi⁃regional clinical trial,MRCT)数量上从2016年的66项增加至2020年的147项,覆盖地区从2016年的25个国家增加至2020年的51个国家[2]。可见,我国药物创新生态系统升级促进了新药研发成果在临床阶段的跨越式产出。
然而药物临床试验是一个成功率偏低且开展周期长的复杂项目活动。相关研究统计,进入临床试验的药物最终获得批准的可能性仅达到11.83%[3]。在试验周期上,单个临床试验从前期准备到完成所需时间一般为5~6年,且可能因为各类因素(如申报周期长、合同和预算问题、伦理审查差异等)而延期[4]。因此,积极探索临床试验的高效管理经验,构建满足中国与全球研发同步进行的创新药临床试验运行体系则是当前我国生物医药行业国际化发展的关键路径。美国拥有发展迅速、创新效应高的生物医药产业,在创新药临床试验的管理上也积累了丰富的经验。本文主要基于创新药临床试验项目不同生命周期阶段的管理内容及监管要点,探索美国在创新药临床试验管理过程中具有代表性和创新性的做法,以期为我国的创新药临床试验管理工作提供参考。
一、创新药临床试验项目全生命周期管理的理论分析
1.1 创新药临床试验项目全生命周期管理的主要内容
根据美国项目管理协会(Project Management Institute,PMI)发布的《项目管理知识体系指南》,项目是指在一定时间、资源和费用预算条件下,为特定目标分阶段完成的一次性任务、产品或服务[5]。项目的全生命周期管理可以将研究对象按照生命过程划分为不同阶段,针对各阶段的主要任务及风险特征,采取科学精准的管理措施,将项目总体成果的不可控性转换为分阶段的重点可控,减少过程中的反复和失误,使项目顺利进行的同时提高项目管理效率。
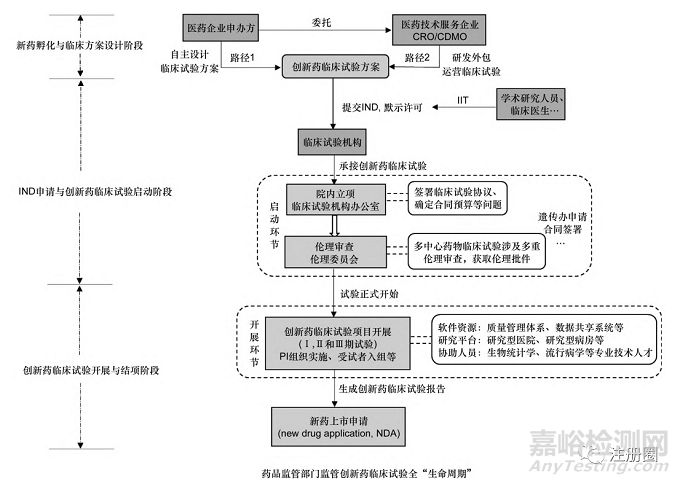
创新药临床试验项目的全生命周期管理是一项复杂的系统工程。项目大多由医药企业发起,以新药的注册上市为目的,少部分由学术机构或临床医生发起,即研究者发起的临床试验(investigator⁃initiated clinical trial,IIT),其主要任务流程及管理阶段见图1,其中任何一个环节出现问题都可能导致项目的延误甚至失败。而且项目主体之间的利益关系错综复杂,药品监管部门、伦理委员会(in⁃stitutional review board,IRB)属于监管方,医药企业申办方、合同研究组织(contract research organization,CRO)、合同研发生产组织(contract development manufacture organization,CDMO)以及研究者(principal investigator,PI)等属于被监管方。被监管方希望能在尽早通过审查的基础上,减少试验时间和成本消耗,保证创新药上市后利润最大化[6]。而监管方则要平衡不同主体间的利益诉求,确保药物临床试验具有科学价值、临床资源能够高效利用、受试者权益免受侵害等,通过顶层政策制度的规制与协调形成促进试验开展的良好支持体系。
▲图1-创新药临床试验项目的“全生命周期”
1.2 创新药临床试验项目全生命周期管理的监管要点
市场在发挥积极作用的同时还会自发地产生一些消极的作用,例如:投机行为、重复性试验、试验开展效率低下及信息不对称等,从而使临床资源无法实现最优化配置,出现市场自发调节的失灵,则需要政府部门对创新药临床试验进行监管。而且创新药临床试验项目[特别是首次人体试验(first⁃in⁃human clinical trial,FIH),FIH也称作0期临床试验,研究者使用微剂量在少量健康受试者(通常6~15人)进行的单剂量或不超过7d的多剂量给药研究,用于确定药物是否达到预期目标的首次人体早期试验]的风险偏高,不确定性大,政府干预需要贯穿试验设计、执行到新药上市的全过程。
由于市场存在趋利属性,医药企业临床研究的规划与设计倾向于以注册上市为目的,那么为了缩短新药上市商业化进程,很可能聚焦重复靶点或简化临床试验过程等,导致新药研发进入无序竞争状态,甚至给社会公共安全带来不利的影响,所以政府部门首先需要引导试验项目优先考虑未满足需求的有价值的临床研究问题,并且对临床试验的质量进行严格监管。在临床试验执行方面,机构立项、伦理审批、合同签订及预算谈判等方面均是影响创新药临床试验运行体系效率的关键节点,比如:申办方与CRO同临床试验机构对接不畅、机构间伦理审查未充分平行等情况会阻碍研究启动效率的优化。最后,创新药临床试验数据透明化也是一项非常重要的工作,然而试验数据的公开存在侵犯商业秘密与受试者隐私、违背药品试验数据保护及数据滥用等争议,如何平衡医药企业、学术机构及公共部门等各方主体在商业层面与社会层面的不同利益则是监管难点。
二、美国创新药临床试验的监管历程
美国临床试验相关立法和监管制度始于1938年,美国国会颁布的《美国食品、药品和化妆品法案》(The federal Food Drug and Cosmetic Act,FD&C)首次对新药上市前的安全性评估提出了要求。受“反应停”事件的影响,美国于1962年通过了《科夫⁃沃哈里斯修正案》,对FD&C进行了修改,规定制药公司在新药上市前必须向美国FDA提供证明药品安全性和有效性的临床试验资料,并明确药物临床试验申请和新药上市申请的相关程序[7]。
美国也是最早建立伦理委员会的国家,1974年美国国会设立了“保护生物医学与行为学研究中的受试者委员会”。1981年卫生与公众服务部(Department of Health and Human Services,DHHS)和美国FDA修订和扩大了关于保护人类受试者的规定,并纳入了《联邦法规》(第45章第46节),即后来的“共同规则”部分[8]。
在临床试验指导方针方面,美国FDA主要采用人用药品注册技术要求国际协调会(International Council for Harmonization of Technical Reguirements for Registration of Pharmaceuticals for Human Use,ICH)制定的临床试验管理规范(Good Clinical Practice guidelines,GCPs)指导临床试验。该指南由ICH专家工作组编写,涵盖了临床试验设计、实施和分析方法等详细内容,并于1996年获得ICH指导委员会批准[9]。
目前,美国FDA是美国药物临床试验的主要监管主体。自1962年美国FDA获得监管药物临床试验的广泛权力以来,其对临床试验监管的主题主要围绕4个方面:①评估临床研究的科学价值。②通过充分的临床前安全性研究及伦理审查保障受试者权益。③保证临床试验质量,强化申办方及PI管理。④确保临床试验数据的完整性。另外,美国国立卫生研究院(The National Institutes of Health,NIH)是美国最大的临床试验联邦资助者,每年投资超过30亿美元,负责支持与管理医学院、大学和研究机构等开展转化研究、临床研究等,也在促进高优先级研究问题的临床试验开展。
三、美国创新药临床试验管理的改革内容
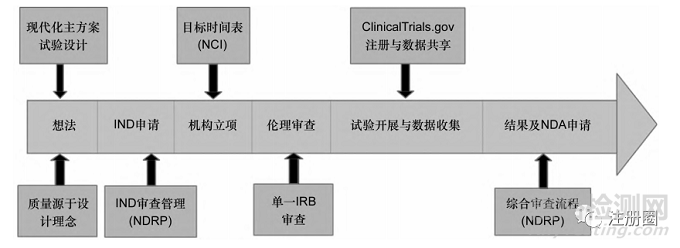
美国已经建立了相对完善的临床研究网络,但是由于高昂的研究成本、日益复杂的研究方法,加之临床试验与社会临床需求存在分歧、临床试验信息系统不完善和监管伦理审批存在延迟等,美国的创新药临床试验领域面临着各种新的困难与挑战。因此,从2007年开始,美国FDA与NIH启动了多项改革举措来促进创新药临床试验高质量发展,包括新药监管计划(new drugs regulatory program,NDRP)[10]、临床试验转型计划(clinical trials transformation initiative,CTTI)[11]及临床试验启动改革计划等,其全生命周期改革举措见图2。这些政策旨在解决创新药临床试验在设计、质量、效率、监管流程和数据共享等方面的挑战和不足,以最大化地促进研究成果转化为能够改善人类健康的医疗实践。
▲图2-美国创新药临床试验项目“全生命周期”的改革措施
3.1 新药孵化与临床方案设计阶段
3.1.1 创建“主方案”试验设计模式,优化临床试验的弹性与效率
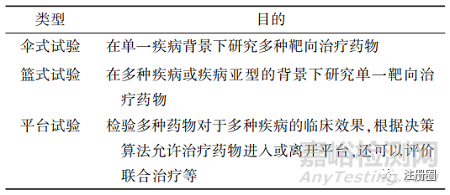
传统的创新药临床试验一般需要从零开始建立一个独立的申报和执行体系,且仅能够评估面向同一种疾病的一种或几种固定药物,导致资源重复、利用率低下。美国FDA所提倡的现代化主方案试验设计允许在总试验框架下同时评估一种以上的研究药物或生物制剂、一种以上的疾病类型或一种以上的患者群体(见表1),以此提高肿瘤药的研发效率。美国FDA于2018年9月发布了2个与主方案相关的行业指南草案[12],以规范和引导肿瘤及其他领域中主方案的设计和执行。
▲表1-主方案试验设计的类型
主方案在多个方面、针对不同利益相关方有着明显的优势。从促进创新角度来看,多种子方案设计的同步进行可以便利更多的创新主体,使创新药尽快投入临床。从监管试验角度看,覆盖面更广且更精密的数据为监管机构审评审批提供了更全面的证据,帮助其在市场竞争者的新药物之间进行最佳的判断[13],而且多种子方案也为患者提供了更多且3更有针对性选择,保障受试者的安全。
3.1.2 基于“质量源于设计”(quality by design,QbD)方法,提升创新药临床试验设计质量
CTTI计划的QbD建议的核心是将质量纳入临床试验的科学设计和实施中[14],提高受试者的安全性及结果的可信度。
QbD理念如下:①让研究者、研究协调员、监管方及患者等利益相关主体参与临床方案的设计开发,并围绕研究质量进行讨论,以提供基于多重角度有价值的见解。②集中精力关注对生成可靠试验数据及受试者保护至关重要的活动,对于不必要的事项和数据收集,可以简化试验设计。③借助QbD原则文档和工具包前瞻性地确定并定期审查影响试验质量的关键因素等。对此,CTTI已经建立了一套应用QbD原则的资源,包括文档工具、度量框架、成熟度模型、实施指南等,以此来帮助试验团队设计开发和进行更好的临床试验。
2019年,美国麦迪逊医药公司(The Medicines Company,于2020年1月被诺华公司收购)与牛津大学临床试验服务部[Clinical Trial Service Unit(CTSU),Oxford University]合作借助QbD建议开发了灵活的研究方案以扩展一项全球心血管药物临床试验。根据CTTI的建议,识别影响该试验的关键质量因素,包括受试者招募与维持干预(见表2),确保对试验目标的针对性关注。另外,促进整个研究团队在内的多方利益相关者的合作交流,包括负责试验设计(医学、药学及监管)以及数据管理、安全管理、药物供应等主体均需要理解特定监管背景下影响试验质量的关键因素,使试验尽可能精简与集中。随着试验的执行,研究团队在受试者招募方面相较于预期实现了显著的提速,QbD原则也成为麦迪逊医药公司和牛津大学CTSU试验设计和执行的实践准则[15]。
▲表2-影响试验的关键质量因素
3.2 IND申请与创新药临床试验启动阶段
3.2.1 探索IND审查管理新工作流程,促进跨职能部门的协作审查
NDRP计划的其中一项工作是简化审查机构内部对于IND的科学审查和流程,以解决不一致的审查文件以及冗长的审查时间表等问题。IND审查新流程和模板体现在两方面:①信息传入,开发一种基于风险的方法对来自申办者的信息进行科学分类,促进更高效率的知识管理以实现快速审查。②信息传出,建立跨职能部门审查模板,将多个学科的关键数据和评估进行汇总,将审查重点放在关键问题上,并向申办者传达初始IND的总体决策,实现高质量反馈[16]。新的标准化IND审查模板记录了对申办者提交信息的内部讨论和外部评论,以促进将审查数据与信息用于未来活动。
3.2.2 实施试验启动的目标时间表,缩短创新药临床试验激活周期
美国NIH的国家癌症研究所(National Cancer Institute,NCI)长期以来一直赞助肿瘤药物开发工作,为应对创新药临床试验启动延迟的难题,NCI的运营效率工作组于2010年出台了一项关于临床试验启动改革的计划,以压缩癌症临床试验激活的时间线。该项计划包括人员增加、流程改进和信息技术创新[17],详细内容见表3。
▲表3-促进试验启动的全面变革措施
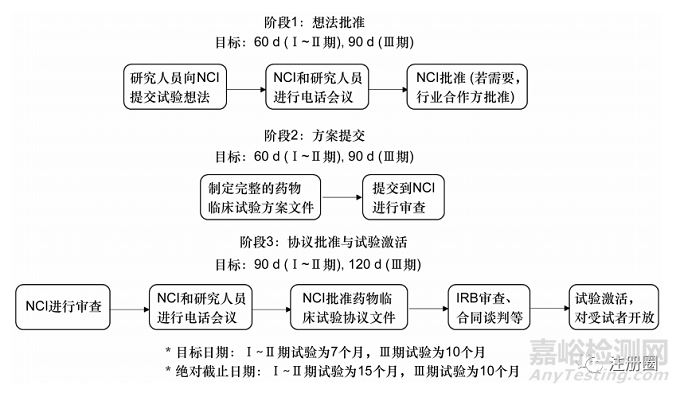
目标时间表、协议跟踪网站、联合电话会议等举措提高了临床试验从构思阶段到对患者登记开放阶段的速度。其中,目标时间表通过任务阶段的划分并提供中间目标、规定期限等来监控整个过程的顺利进行(见图3)。第一阶段是试验想法的初步审查及共识审查文件的生成阶段。在获得初步批准后,研究人员在第二阶段制定并提交完整的试验方案。在第三阶段,NCI审查完整方案,并处理伦理与合同问题,所有事项完毕则激活创新药临床试验。值得注意的是,在绝对截止日期之前未激活的创新药临床试验将自动被拒绝。
▲图3-NCI创新药临床试验审查的目标时间表
3.2.3 使用单一机构进行集中伦理审查,提高伦理审查效率
为提高多中心临床试验的伦理审查效率及跨站点的一致性,美国卫生与公共服务部(Health and Human Services,HHS)在其2017年新修订的“共同规则”中提出:“要求使用单一机构的伦理审查委员会审查基于美国的、多地点、非豁免、联邦进行或支持的人类受试者临床研究”[18]。在美国,中心伦理委员会(central institutional review board,CIRB)代表着多中心试验中所有临床试验中心的单一IRB记录,一系列的实体机构(一个机构的IRB、一个联邦的IRB、一个独立的IRB等)可以作为一个CIRB[19]。在实践中,美国国家癌症研究所IRB和美国家庭医生学会国家研究网络IRB等均可以作为多中心临床试验的唯一IRB。为规范机构责任与CIRB的伦理审查责任,CTTI制定了一份关于职责矩阵的指南(见图4),以协助集中伦理审查过程。
▲图4-机构和中心伦理委员会在多中心临床试验中的责任划分
美国国家癌症研究所的CIRB则是具有代表性的中心伦理委员会,共设有成人癌症早期试验、成人癌症晚期试验、儿童癌症试验及癌症防控4种类型的CIRB。NCI精心开发的流程和审查模式保证了创新药临床试验审查的高质量和透明度[20]。①NCI CIRB通过机构和研究人员提交的标准化工作表评估当地情况,包括州和地方法律、利益冲突政策、管理计划等,提高审查管理效率。②创建在线系统网站IRB Manager,为机构提供与CIRB相关信息的无缝访问,并与其他NCI临床试验系统集成,为机构、研究者提供一个高效的在线沟通平台。③建立内部与外部质量控制流程,包括成员的持续培训、维持美国人体研究保护项目认证协会(AAHRPP)认证等[2]3.3创新。
3.3 创新药临床试验开展与结项阶段
3.3.1 鼓励临床试验注册与数据共享,充分发挥试验数据的内在价值
在美国,主要通过2种有效方式来传播创新药临床试验结果:①发布在临床试验注册网站上。②通过数据共享访问临床试验结果。
根据《食品药品监督管理局修正案》(FDAAA801)第801条和《临床试验注册和结果信息提交最终规则》(42CFR第11部分)[21],美国FDA要求临床试验的“责任方”在招募第1个受试者后不迟于21d在临床试验网站(ClinicalTrials. gov,CTG)注册有关试验的具体信息,随后每年更新正在进行的试验状态,在试验完成后12个月内向CTG提交试验结果信息,包括研究计划、结果数据和统计分析、不良事件信息等。美国FDA的注册要求是一项法定义务[30],可以帮助研究人员避免重复试验,关注需要研究的领域,同时为患者识别相关临床试验提供参考。
除了注册要求之外,该法规还建立了试验结果信息上报的约束系统。美国FDA通过生物研究监测计划(bioresearch monitoring,BIMO)项目的调查以及第三方投诉来监督违反FDAAA的行为,若发现责任方未能及时提交试验注册或结果信息,或者向数据库提交虚假或误导性信息,美国FDA有权对责任方寻求民事罚款、扣留HHS机构的资助拨款甚至刑事诉讼等。
美国也有广泛的数据共享平台。耶鲁大学在2011年开发了数据访问项目,并与强生联合制定了关于外部研究人员的临床试验数据申请审查流程及数据使用协议等[22]。另外,葛兰素史克公司在2013年也启动了一项临床试验数据共享计划,旨在为研究者共享高质量的患者级数据。近年来,此项计划开始与技术合作伙伴(包括SAS软件公司)合作,使研究者可以使用便捷的分析工具在单个分析平台上分析临床试验数据集,打破临床试验数据访问、聚合和分析的障碍,加速创新药临床研究[22]。
3.3.2 开发新药上市申请的综合审评流程,提高监管决策透明度
NDRP计划的另一项关键工作是开发综合审评流程和文件模板,这是评估新药上市申请(new drug applications,NDA)和生物制品许可申请(biologics license applications,BLA)的更新流程。新流程中,美国FDA的科学审查人员组成一个跨学科团队,共同讨论拟上市药品的安全性、有效性等一系列关键问题,同时围绕关键问题和潜在的收益⁃风险撰写一篇评论,在新药或生物制剂批准后,公开发布包含概要、跨学科评估和附录的综合审评文件[23](见表4)。
▲表4-综合审评文件的组成部分及其内容
更新后的模板是一份协作文件,包含来自临床药理学、生物统计学、毒理学等相关学科审查员的决策意见。新的审查模板旨在促进更加综合和跨学科的评估,提高美国FDA对于新药收益和风险评估的证据清晰度,同时行业人员可以获取其认为最有价值的审评问题。
四、对我国创新药临床试验管理的启示
4.1 我国创新药临床试验管理现状
为适应医药行业创新发展的需要,我国也出台了一系列促进创新药临床试验发展的法规文件及相关指南,涵盖临床试验设计、伦理审查、审评审批及信息公开等方面。2015年国家发布的《国际多中心药物临床试验指南(试行)》[24]对伦理协作审查模式进行了初步引导。2019年8月国家发布的《药品管理法》[25]将临床试验默示许可制度在法律层面固化下来,提高了药品审评审批效率。2020年3月国家发布的《药品注册管理办法》[26]进一步改革药品注册程序、优化药品上市许可路径,帮助创新药企业更早上市创新药。2021年发布的《药审中心技术审评报告公开工作规范(试行)》[27]对临床试验注册登记及技术审评信息公开等工作作出了明确要求。在新药研发价值引导上,CDE在2021年11月15日正式发布了《以临床价值为导向的抗肿瘤药物临床研发指导原则》[28],促进抗肿瘤药科学有序地开发。
可以看出,我国在创新药临床试验的监管理念和监管能力上实现了较大程度的突破,各监管部门通力配合,优化了监管环节的引导性、科学性与透明度。但在创新药全球同步研发、注册与审评的发展背景下,与世界领先国家相比,我国尚未充分加入全球同步研发。分析显示,在2018年开展的国际多中心临床试验中,我国占比9.4%,同年在美国、日本的占比分别是77.5%和19.7%[2]。可见,我国参与国际多中心临床试验的经验还略有不足,在未来与国际创新体系充分接轨的过程中,我国在临床试验水平与临床试验效能方面还有一定的提升空间。美国在创新药临床试验的管理理念、方案执行流程、伦理审查制度等方面进行了率先探索,对科学开展我国创新药临床试验管理工作有一定的启示意义。
4.2 完善我国创新药临床试验运行体系的建议
4.2.1 探索创新药临床试验“主方案设计”模式,提高新药研发效率
对于临床需求未被满足领域的突破性创新来说,主方案这一创新性药物研发模式在我国有较大的发展空间。CDE在2021年1月29日颁布的《药物临床试验适应性设计指导原则(征求意见稿)》中也首次提到了主方案的试验思路。英国探索了主方案在加速2019新型冠状病毒炎(Corona Virus Disease2019,COVID⁃19)药物研发的实践应用[29],由政府牵头,医院、医药企业、临床研究组织等共同合作开展临床试验。通过建立适应性和开放性的主方案,主方案下的试验网络为子试验提供适当的基础平台、数据管理等资源,子方案间实现资源共享与风险共担,减轻研究者用于体系建立、维护和监管的负担,为新疗法临床试验部署提供最大范围的保障。该方式为英国国家医疗服务体系减轻了一定的负担,效果显著。基于COVID⁃19疫情背景下,未来还需大量临床试验支持疫苗及新药研发,加上我国对创新药临床试验的支持,主方案在未来药物研发中拥有较多的实施机会。
4.2.2 优化机构内试验启动的运作程序,促进创新药临床试验项目启动加速
临床研究的启动是创新药临床试验成功的关键因素[30],试验的准备和启动阶段若占很长时间的话,会阻碍项目入组进度以及项目整体进度,也会影响创新药临床试验的成本。美国NCI就曾面临创新药临床试验启动延迟的难题,并作出了一系列流程改进以提高试验启动效率。为确保临床试验高效性,我国临床试验机构也需要不断优化试验启动的运作程序,包括配备专职人员协助方案审查、合同拟定的全过程;高效管理临床试验协议,建立协议跟踪网站,使申办方、CRO及研究者等明确协议开发进度及当前任务;定期举行联合电话会议讨论试验方案审查的关键问题等。
4.2.3 逐步确立独立伦理审查模式,设置基于专科病种的CIRB
我国出台的相关法规均提倡采用协作审查模式审查多中心临床试验项目[31],并且近几年浙江省、山东省、北京市、上海市等地区陆续成立了临床试验伦理审查互认联盟,不断推进多中心临床试验伦理审查的一致性[32]。在这种客观条件下,我国应该一方面发挥现有各地区伦理审查互认联盟的示范引领作用,逐步推动更大范围跨区域伦理审查的单一化、规范化发展;另一方面梳理我国的临床重点专科(如心血管外科、内分泌代谢、血液等),探索建立基于不同病种的专科化伦理审查协作联盟,突破地域的限制实现审查的协调联动。这种独立审查与专科化伦理审查并行的伦理审查模式更加切合我国实际,可以充分发挥现有资源的优势。另外,应通过多种机制提升伦理委员会能力[33],比如建立伦理评审专家的职业认证机制及培训机制等。
4.2.4 完善创新药临床试验数据顶层设计,探索建立多样化数据共享模式
新的药品安全形势下公众对创新药临床试验数据公开的诉求越来越强烈,考虑到研究人员与公众需要的数据粒度级别存在差异性,在完善立法保障的基础上,我国可以探索建立多样化创新药临床试验数据共享模式:①依托我国现有的数据公开平台,逐步建立起高效智能的“信息化临床试验科研平台”,扩大临床试验数据的公开范围,包括研究计划、结果摘要及统计信息等。②促进学术界与医药行业的合作,依托严格的数据共享协议与监督机制确保程序符合伦理要求,尝试通过开发新的工具为研究人员对共享数据集的二次分析提供便利。③对于国家资助的学术性临床研究课题,可以采取一定的激励措施或将注册临床试验作为学术期刊的论文发表条件,鼓励数据公开。
4.2.5 加强监管主体同利益相关者的互动沟通,提高监管效率
从美国FDA审评程序的改革过程中可以看到,药物上市审评程序和审评报告公开是一个反复迭代的过程,以不断地解决现行审评存在的问题。处于新的创新浪潮下,当前我国大幅递增的创新药临床试验申请数量增加了监管工作量,同时国家鼓励罕见病用药、儿童用药等临床急需药品的研制创新,则对监管方的审查能力提出了更高的要求[34]。根据治理理论的系统性思想,创新体系的治理应该将分散的、多元的力量进行整合,那么在药品审评流程和创新研发引导上需要注重与医药领域各方利益相关者的交互式沟通交流,不断完善信息公开机制,帮助研发企业和公众了解监管机构的观点和决策依据,引导新药研发主体在立项时理性分析创新药的临床价值和市场需求,并且及时更新监管工具和监管方法,使监管主体逐步掌握多领域的专业知识以及新的分析方法和技术,实现对新药基于价值的综合评估。