寡核苷酸(Oligonucleotide)是一类由碱基组成的短链核苷酸化合物的总称,它是继小分子药物和蛋白质药物之后出现的一类新模式药物,是近年药物开发的热点之一。绝大多数寡核苷酸药物(Oligonucleotidedrugs, OND)通过沃森克里克碱基配对原理,识别并结合到目的核苷酸序列上,干扰致病基因的转录翻译,从而矫正致病蛋白质的表达量,最终达到治疗疾病的效果。根据药物结构和作用机理的不同,OND可以大体分为反义寡核苷酸(Antisenseoligonucleotide, ASO),小干扰RNA (smallinterferingRNA, siRNA),微小RNA(micro-RNA, miRNA)和核酸适配体(Aptamer)等。
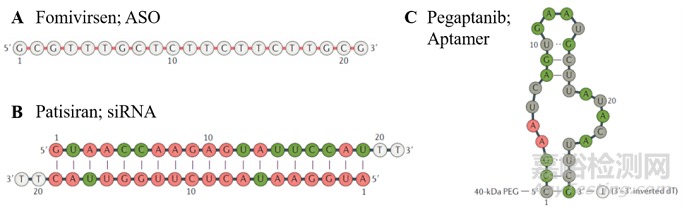
图 1. 寡核苷酸药物示意图
三个FDA审批上市的OND药物分别为 (A) Fomivirsen, (B) Patisiran和 (C) Pegaptanib [1].
ASO是一类可识别RNA的单链DNA(图1A),当ASO结合到目的RNA序列之后,会导致目的基因被RNAse H降解,或通过空间位阻来阻断致病基因的翻译。siRNA通常是20-25个碱基长度的双链RNA(图1B),其中反义链RNA会识别其序列完全互补的信使RNA (messenger RNA, mRNA),进而形成RNA沉默复合物(RNA-inducedsilencingcomplex, RISC),导致mRNA降解。miRNA是广泛存在于细胞内的内源性单链非编码核苷酸,和siRNA作用机理相似,miRNA通过和目的RNA部分互补,形成RISC复合物并沉默基因表达。Aptamer和以上三种OND作用机理大不相同,它由单链DNA组成,并折叠产生明确的三维二级空间结构(图1C),和目的蛋白结合后,干扰此蛋白质和其他分子间的相互作用。
OND分子量通常介于4~15 kDa之间,具有强亲水性和多负电性的特性。当OND进入人体后,需要防止核酸酶的水解,躲避血清中蛋白质的螯合作用,穿越毛细血管到达靶点细胞,横跨细胞膜,抵抗溶酶体的降解,才能最终到达细胞内的作用位点。因此OND所面临的药物稳定性和药物递送的挑战,比小分子药物和蛋白质药物更加艰巨。绝大多数现有的OND分子(包括临床前,临床中和上市的OND),都需要对核苷酸进行广泛的化学修饰 ,来达到高稳定性和高效递送性的目标。
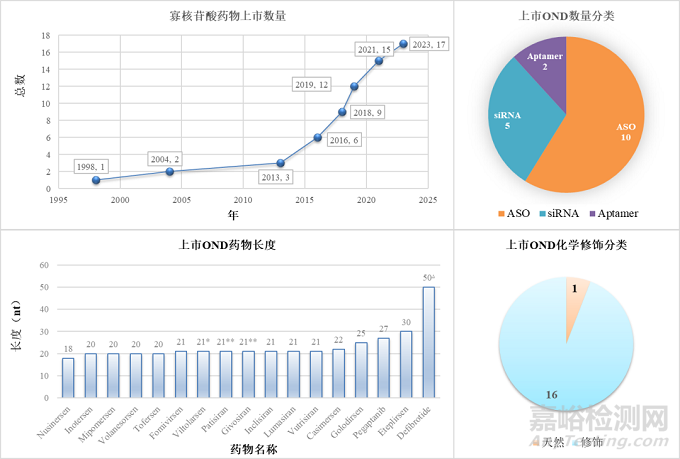
自1998年第一款OND上市以来,截至2023年7月为止,共有17款OND通过美国FDA或欧洲EMA审批,其中14款的上市,是在过去10年内完成的(图2)。根据作用机理分类,已上市OND有10款属于ASO,5款siRNA,另外两款为Aptamer;根据药物长度分类,绝大多数OND的长度均在20-25mer的范围里,而最长的一款Defibrotide,是天然DNA降解后的混合产物,平均核苷酸链长度在50 nt 左右;根据化学修饰分类,除了Defibrotide外,其余16款寡核苷酸药物,均包含化学修饰。
图2. 上市OND药物统计
(A) 上市OND药物总数 (B) 上市OND药物分类 (C) 上市OND药物分子长度 (D) 上市OND药物化学修饰分类数量. *: 双链siRNA长度为21/21 nt. **: 双链siRNA长度为21/23 nt. ∆: 平均长度约为 50 nt [2].
为支持寡核苷酸药物的研发和临床试验,我们同样需要对OND在生物基质中进行定量分析并研究其相关药理特性。由于上文提到的OND分子特性,例如强亲水性、多负电性和人工化学修饰等,现有的传统分析技术,已经无法完全满足临床前和临床中对寡核苷酸药物在人体内的安全性、稳定性等监测需求,而相关政府药监机构,对工业界OND的生物分析方法,也并未制定明确的法规或是清晰的指导原则,因此我们要根据学术界已有的科研成果来建立新的技术平台,并对已有的分析方法进行方法开发和改进,同时摸索建立客户、业界和药物审批机构均可接受的检测标准,从而应对OND新模式药物给生物分析带来的全新挑战。现有的针对寡核苷酸分子的分析方法大致分为两类:基于色谱的方法(chromatographic assay)和基于分子杂交的方法(hybridization-based assay) [3]。
基于色谱的方法,是将分析物经过液相层析分离后,用UV、荧光或质谱仪等方式检测药物分子,其中LC-MS/MS (Massspectrometry)和LC-HRAM (High-resolutionaccurate-MS)在近年里越来越多的被应用于OND的定量分析。LC-MS/MS方法具有超强的特异性,优越的精准度,宽泛的定量范围和高度自动化的优势,LLOQ可以达到1.0-25 ng/ml(血浆中; [3]),除此以外,LC-MS可以检测到N-1的药物代谢产物,对核苷酸的化学修饰也具有良好的耐受性。但是随着OND分子长度的增加,基于色谱的分析方法灵敏度会随之下降,即便是较短的药物分子(8-13 nt),其LLOQ也无法达到像ELISA或是qPCR技术pg/ml级别 甚至更低的检测水平。
基于分子杂交的方法,是通过探针来识别、捕获和检测OND分子,主要技术平台包括杂交-ELISA,杂交-ECL,LC-荧光和qPCR等。分子杂交方法的主要优势在于较高的灵敏度,LLOQ通常在0.1 ng/ml以下([4]);高特异性、优异的精准度以及不受核苷酸化学修饰影响,使杂交的方法成为一个可靠的生物分析平台。常规的杂交方法例如杂交-ELISA,可用于分析14-30个核苷酸长度的寡核苷酸分子,因此大多数OND (20-25 nt)是适合用分子杂交的方法来定量分析的。但此分析方法无法检测N-1的药物代谢产物,对每一个药物分子也都需要进行单独的探针设计和生产。
qPCR虽然是一类基于分子杂交的检测手段,但其检测原理明显有别于其它常规的杂交方法。qPCR通过引物对目的核苷酸片段的扩增,结合荧光染料或探针进行染色发光,最后由仪器对荧光信号定量检测。即使是极低浓度的核苷酸片段,通过40个循环的PCR扩增后,其浓度可以达到一个很高的检测水平,因此qPCR是一个较为灵敏的检测方法,LLOQ可以达到1 pg/ml(血浆中; [3])至50拷贝(每1 ug 基因组DNA; [5])之间。但qPCR也有其明显的局限性,例如无法检测药物N-1代谢产物。对于OND生物分析,qPCR技术面临两个主要挑战,一是绝大多数OND分子长度在20-25 nt之间,不能满足常规引物和探针所需的最佳长度,需要对引物及探针的设计进行改进;二是绝大多数OND分子都存在化学修饰,即便优化引物及探针的设计,也无法完全抵消化学修饰对PCR扩增效率带来的影响。
以上几类技术平台各有利弊,对于OND的生物分析,我们需要根据药物分子的特性来选择合适的分析方法(表1)。从检测方法的灵敏度和准确度来看,qPCR拥有较高的灵敏度,但精准度则相对偏低;而LC-MS则相反,虽然很难在生物基质中检测到浓度极低的药物分子,但可以准确稳定的测量药物浓度。从OND分子长度来看,qPCR适合分析较长的药物,而LC-MS的优势则在于分析小于20 nt 的OND,并且灵敏度随着药物分子长度的缩短而上升。从OND分子的化学修饰来看,分子杂交的方法无法检测到任何药物修饰,其中qPCR的扩增循环更是受化学修饰影响;另一方面,LC-MS/MS不仅可以检测到药物分子的化学修饰,还可以观测到药物的代谢产物。
寡核苷酸药物是继小分子和蛋白质药物之后的一类新模式药物,其分子特性和作用机理在很大程度上可以弥补后两者的局限性,但也面临着稳定性和药物传递的挑战。在已经上市的17款OND中,15款为针对罕见病药物(Inclisiran和Pegaptanib除外; [6-7]),足见OND在治疗罕见病方面的巨大潜力;而处于临床测试阶段的OND,绝大多数都是针对癌症治疗的,也反应了OND在常见病方面的广泛应用前景。对于寡核苷酸药物的生物分析,我们面临着巨大的技术挑战,原因包括OND相对复杂的分子结构、尚未成熟的技术平台和有待完善的行业标准,需要我们在已有的传统药物分子分析经验的基础上,不断学习并建立和开发新的分析方法,来面对即将到来的OND药物涌现的新时代。药明康德测试事业部生物分析部,已建立基于色谱和分子杂交的OND分析平台,包括LC-MS、Hybridization-ELISA和qPCR/RT-qPCR等;同时我们拥有丰富的方法开发、方法验证及样品分析经验,可以为客户提供定制化一体化服务,覆盖OND的药代动力学、药效动力学及免疫原性的检测需求。
References:
[1] Thomas Roberts, Robert Langer and Matthew Wood. Advances in oligonucleotide drug delivery. Nature Reviews Drug Discovery (2020), 19: 673-694.
[2] R. Pescador, L. Capuzzi, M. Mantovani, A. Fulgenzi, M.E. Ferrero. Defibrotide: Properties and clinical use of an old/new drug. Vascular Pharmacology (2013). 59: 1-3.
[3] Laixin Wang and Chengjie Ji. Advances in quantitative bioanalysis of oligonucleotide biomarkers and therapeutics. Bioanalysis (2016), 8(2): 143-155.
[4] Daniel Norris, Noah Post, Rosie Yu, Sarah Greenlee and Yanfeng Wang. Bioanalysis considerations on the pharmacokinetic evaluation of antisense therapeutics. Bioanalysis (2019), 11(21): 1909-1912.
[5] FDA Department of Health and Human Services (2020). Long term follow-up after administration of human gene therapy products: guidance for industry. https://www.fda.gov/media/113768/download.
[6] US FDA genetic and rare diseases list.https://rarediseases.info.nih.gov/diseases.
[7] US FDA Orphan drug designations and approval database.https://www.accessdata.fda.gov/scripts/opdlisting/oopd/index.cfm.