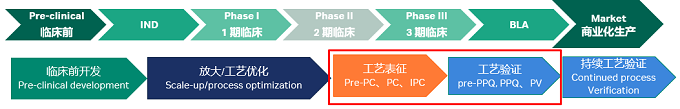
工艺表征和工艺验证是药物开发临床实验后期需要进行的重要工作,所处节点如图1。
图1:工艺表征和工艺验证在药物研发流程中所处环节
FDA工艺指南将工艺验证 (Process Validation, PV) 定义为:“从工艺设计阶段到商业化生产阶段的数据收集和评估,建立科学证据表明工艺能够始终如一地提供优质产品。”FDA将工艺验证定义为一个连续的生命周期的过程。
工艺表征 (Process Characterization, PC) 的目标是确保有效和成功的工艺验证和保证一致的工艺性能。工艺表征工作一般在临床Ⅱ期结束后,工艺性能确认 (Process Performance Qualification, PPQ) 开始前进行。
工艺表征的目的是系统性地研究工艺参数和原材料属性对工艺表现的影响,同时获得工艺参数和工艺性能/质量属性的可接受范围,从而制定工艺控制策略。工艺表征实验数据是在药品上市前,除临床实验数据外,可向监管部门提供的具备长期稳定生产质量的证据。不充分的工艺表征可能会导致昂贵的批生产失败和事故,失败的验证运行和困难的检查。
该如何正确地准备和完成工艺表征研究呢?
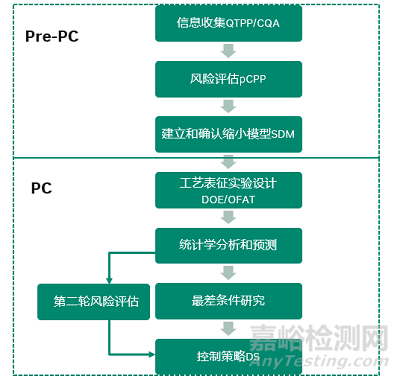
基于法规解读、行业实践及生物工艺的可操作性,一个完整和成功的工艺表征研究主要包括工艺表征前的准备工作Pre-PC和工艺表征研究PC两个阶段,共7个主要步骤组成,详见图2。
图2:工艺表征过程的关键步骤
1、信息收集
生产工艺是在工艺开发过程中定义的,在工艺开发前需要使用工艺流程图或鱼骨图等,对生产工艺包括单元操作、工艺输入和工艺输出进行详细描述。通常需要收集的数据包括:
收集临床生产批次数据,确定生产工艺;
收集工艺开发和优化数据;
收集产品关键质量属性CQA相关信息。
2、风险评估
FDA的工艺验证指南指出,因为不可能对所有参数进行实验性研究,因此需要使用一定的工具来筛选出高风险的工艺参数,即对工艺性能和产品质量属性影响风险比较高的工艺参数。常使用的风险评估工具有:因果效应矩阵 (C&E) 、失败模式与效应分析 (FMEA) 以及风险排序与过滤 (RRF) 等。
2.1风险评估所处阶段
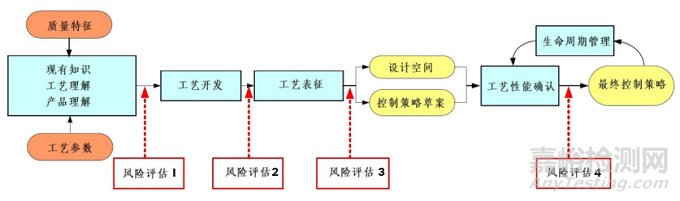
工艺表征研究需要进行两次风险评估,即风险评估-2和风险评估-3,如图3 A-Mab中总结了生物制药工艺生命周期内的质量风险管理的应用。风险评估-2主要用于工艺表征之前,利用工具筛选出那些高风险性的工艺参数,这个过程需要考虑工艺平台知识、文献知识以及工艺开发过程中积累的知识。该阶段的目的是指导工艺表征工作,包括确定工艺步骤的优先级,以及筛选需要进行工艺表征的工艺参数。风险评估-3是在工艺表征之后,即已经完成了工艺表征工作,该风险评估用来定义设计空间和形成控制策略草案。因此,寻找工艺中的潜在失败模式并且制定缓解措施是该过程的主要工作。
图3:生物制药工艺生命周期内的风险评估
2.2风险评估工具
工艺表征后的风险评估目的是寻找工艺失败模式和制定缓解策略,失败模式和效应分析 (FMEA) 则是常用到的工具。FMEA是通过对识别的失败模式进行其严重度S、发生频率O和可探测度D三个维度的评估。根据评分数表对每一种失败模式进行打分,最终失败模式的风险程度是三个维度的乘积,即风险顺序数 (RPN) =严重度S×发生频率O×可探测度D。
风险分析通常先要对改进措施进行定义,明确现有的预防措施和探测措施后,可以对照FMEA评估表对S、O、D的值进行独立评估,根据不同的S、O、D组合,查表确定风险控制的优先级 (AP) ,进而用于评估产品的可能 CQA,以及可能影响产品质量的CPP。
2.3CQAs评估和pCPP、CMA评估
关键质量属性 (Critical Quality Attributes, CQA) ,ICH Q8 (R2) 法规指南中定义CQA指在适宜限度、范围和分布内以保证药品质量的物理、化学、生物或微生物属性或特性。通过风险评估,结合对产品的理解,以及相关历史数据,评估出产品CQA,这是表征活动的出发点。CQA主要由产品的QTPP概况引申而来,分别由其安全性和有效性决定。CQA的评估主要基于产品对患者的影响,而不是工艺的能力或历史数据,如图4基于QbD风险评估蛋白药物的质量属性。
图4:基于QbD风险评估蛋白药物的质量属性
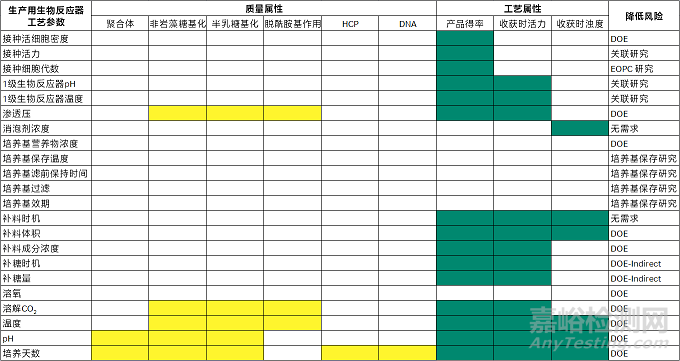
关键工艺参数 (Critical Process Parameter, CPP) 根据ICH Q8指对关键质量属性 (CQA) 有影响的工艺变量,应予以监控或控制以确保药品获得所需的质量。根据评估得到的CQA,进一步采用风险评估的方法(如FMEA、因果矩阵、流程图、鱼骨图)从大量的工艺参数中剔除出非关键的工艺参数,筛选出潜在的CPP (pCPP) ,如图5A-mab中生产生物反应器中工艺参数的第一轮风险评估结果。通过后续实验中研究,进而获得稳健的控制策略。
图5:A-mab中生产生物反应器中工艺参数的第一轮风险评估结果。CPP=影响质量属性的参数 - 必需严格控制,稳定性有限;WC-CPP=影响质量属性的参数 - 良好控制,运行稳定;KPP=影响工艺属性的参数;Non-KPP=不影响QA或PA的参数
3、建立和确认缩小模型
在生产规模上对工艺参数进行研究型工作是不现实的,因此需要设计实验室规模的模型来代表生产规模是非常必要的,即缩小模型。
3.1细胞培养缩小模型的建立原则
在细胞培养缩小模型的建立过程中与细胞放大原则一致,一般来说非体积依赖性参数保持一致(如pH值、温度、补料策略等);对于体积依赖参数,通常采用等P/V或等叶尖速度,从而保证搅拌效果一致;或者保持O2、CO2的Kla与商业化生产保持一致,以保证氧气传质和CO2移除效率一致。
3.2缩小模型的多变量分析和等效性确认
法规指南对缩小模型的唯一要求是,缩小模型需要能够代表商业化生产工艺。即需要对缩小模型进行确认,缩小模型的确认可以在大规模生产使用的操作范围的中心点上来运行,需要确认缩小模型与大规模生产运行的性能一致,并且需要一个缩小模型确认的可接受标准。缩小模型的验证,通常采用统计学相关的验证方法,比如T检验、双单侧检验TOST、主成分分析PCA和多变量分析PLS等。
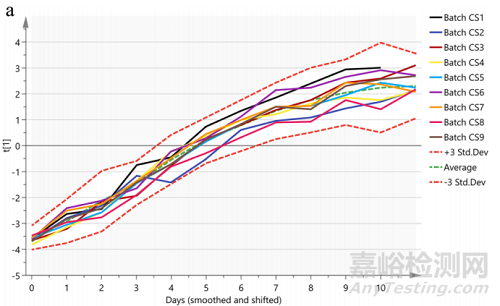
对建立的缩小模型,需要与生产批数据进行过程代谢,产品质量等方面进行可比性研究,确认缩小模型可代替商业化生产规模。上游案例是通过9批商业化生产规模数据(图6虚线),经SIMCA软件(PLS分析模型)处理,建立±3SD或者95%置信区间,细胞培养过程代谢参数,产品质量数据和过程数据均处于该区间内,则证明缩小模型可比(图7)。即该缩小模型可代替商业化规模,用于PC研究。
图6:上-不同天数细胞代谢曲线得分图 (SIMCA) ;下-预测六批次的缩小模型数据 (SIMAC)
4、工艺表征研究
工艺表征研究,从根本上是要解决两个问题:
工艺参数的分类,即哪些是关键工艺参数 (CPPs) ,哪些是非关键工艺参数 (Non-CPPs) ;
关键工艺参数的设计空间范围,也就是关键工艺参数必须要控制在什么范围内,才能保证关键质量属性的可接受范围;
除此之外,工艺表征研究还需要考虑到杂质清除的研究(包括挑战性实验),关键原材料的研究以及单元操作之间的链接研究。
对不同的实验阶段,如细胞复苏、传代、扩增、N-1和生产阶段,通常在缩小模型上设计实验以研究高风险的工艺参数对工艺性能和产品质量的影响,常用的实验类型包括单因素 (OFAT) 、实验设计 (DoE) 、最差条件研究 (Worst case) 或N-1连接 (Linkage) 等的研究。
4.1单因素实验OFAT
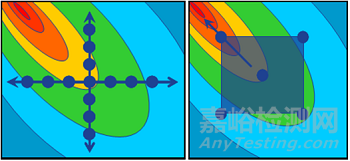
单因素实验,也称为一次一个因子 (OFAT) 实验(图8),即每一次实验只改变一个工艺参数的水平,而其他的工艺参数保持某一水平不变。单因素实验是比较简单的实验方法,可以采用方差分析或回归分析来分析实验结果,得出工艺参数的关键性和可接受范围。单因素实验的缺点是无法研究工艺参数之间的交互效应,而这在生物制药工艺中常常是存在的。
4.2实验设计DoE
实验设计 (DoE) 是一种结构化、有组织的方法,是监管机构鼓励采用的方法,用于确定特定工艺过程中影响因素和输入结果之间的关系(图8)。在工艺表征过程中,需要进行科学合理的DoE实验设计对CPP进一步表征,从而确定出CPP的操作范围。这部分工作的主要目的是为了给商业化生产制定工艺操作范围的边界,最终确定控制策略。在工艺表征中,原材料可变性如培养基的研究,也可以将原材料的批次作为一个因子纳入实验设计 (DoE) 中从而在工艺表征的实验性研究中。
图8:单因素实验 (OFAT) 和实验设计 (DoE)
5、统计学分析和最差条件研究
5.1CPP和KPP的确认
实验结束后,需对数据进行分析,通过采用蒙特卡洛Monte Carlo模拟,并结合等高线刻画的方式确定参数的设定范围及最佳操作点(如图10)。同时可采用蒙特卡洛模拟对最差条件进行预测,即分别对某关键质量属性CQAs中达到最差情况时,对重要工艺参数KPP和关键工艺参数CPP进行预测,然后在缩小模型上进行Worst case的实验验证。
在统计学数据分析中,当某工艺参数的变化对CQA影响的p值<0.05时,就认为这一参数具有统计显著性(如图9),这些工艺参数被人们定义为关键工艺参数CPP,但是可能会导致一些对于CQA有影响但变异性不大的参数被识别为CPP,不合理地增加了CPP的数量,加大了后续工艺控制的难度。很多国际大厂如Roche/Genentech等可采用实际显著差异的理念对CPP进行识别,通过实际显著性的理念结合DoE数据分析及CQA实际情况两个维度对关键工艺参数进行评估,从而更加合理地进行CPP的识别工作。
图9:CPP评估流程。注:P<0.05 只能说是统计学显著性,同时可采用Roche/Genentech等实际显著差异的理念对CPP进行识别,这里不过多介绍。
5.2定义设计空间
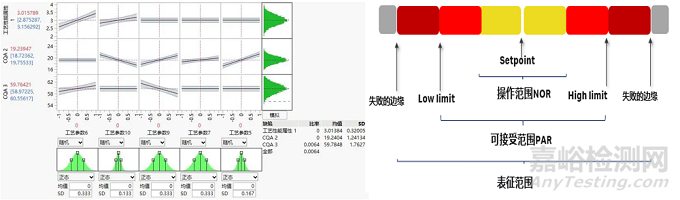
根据DoE实验结果或单因素/失败边缘考察,确定设计空间。针对设计空间的边界可确定单因素的参数经验证的可接受范围 (PAR) ,当保持其他参数恒定时,此参数范围内操作将生成符合相关质量标准的物料。
在参数设定中点上,结合设备和工艺的波动范围,在PAR范围内可确定正常操作范围 (NOR) 。在商业化生产中工艺参数一旦超过PAR/NOR就表示该批次失败,而任何在设计空间范围内的变化都不视为变更,无需向监管部门提交补充申请并获得批准(图10)。
图10:蒙特卡洛模拟结合等高线图确认设计空间
6、第二轮风险评估更新
在完成表征工作后,返回重复风险评估FMEA评估可能是有价值的。此时,每个操作参数的严重程度因子已知,在某些情况下,这可能会极大地改变风险优先级数字的结果。如图11生产生物反应器中工艺参数的最终风险评估结果和对比图5的第一轮风险评估结果相对比,我们不难发现一些之前被认为是影响关键质量属性CQA的CPP参数可能是良好控制,运行稳定的WC-CPP,一些第一轮我们认为会影响工艺性能KPA的重要工艺参数KPP,可能是Non-KPP。通过两轮的风险评估,工厂工程师可以将他们的时间更好地投入到那些需要最大控制和检测的操作单元和操作参数上。
图11:A-mab中生产生物反应器中工艺参数的最终风险评估结果。WC-CPP=影响质量属性的参数-良好控制,运行稳定;KPP=影响工艺属性的参数;Non-KPP=不影响QA或PA的参数
7、建立控制策略
通过工艺表征研究需要确定关键质量属性和关键工艺参数的列表,以及关键质量属性的可接受范围与关键工艺参数的设计空间,以确保对药物的安全性和有效性。
关键质量属性CQA上通常需要各种分析检测来控制,比如工艺中控、放行检测、稳定性检测、表征和可比性检测等;
关键工艺参数CPP的控制则是通过工艺程序和操作规程控制,保证其在设计空间内;
关键物料参数CMA如培养基是通过良好的可扩展性、准确的可预测性以及较小批次之间差异。
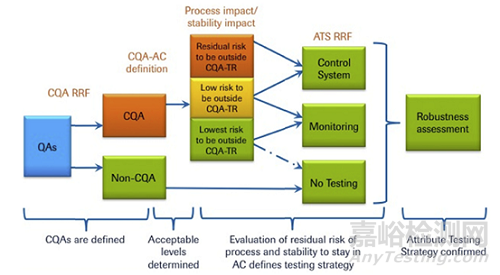
Genentech公司曾介绍了一个基于风险评估的属性检测策略 (ATS) 的控制策略,如图12所示。
图12:Genentech属性检测策略 (ATS) 的控制策略流程图案例
总 结
工艺表征的目的是系统性地研究工艺参数和原材料属性对工艺表现的影响,通过第一阶段工艺表征前Pre-PC的信息收集、风险评估、缩小模型建立,第二阶段工艺表征PC阶段的实验设计、统计学预测、最差条件研究、结合第二轮风险评估筛选出关键工艺参数CPPs、关键物料属性CMAs和KPPs并确定其可接受范围PAR和可操作空间NOR,最终建立工艺控制策略,为后续工艺验证PV、采用PAT过程监控控制策略CS、产品整个生命周期管理打下基础。