膜是器官芯片(OOC)平台的基本元素,因为它们为贴壁细胞提供支持,允许营养物质(和其他相关分子)通过膜孔渗透/交换,并实现机械或化学刺激的传递。通过OOC平台,生理过程可以在体外研究,而OOC膜拓宽了机械和化学线索如何影响细胞和器官的知识。带膜的OOC是体外微流控模型,用于各种应用如药物研发和疾病建模,或用于替代动物试验。
来自墨西哥蒙特雷理工学院的Sergio O. Martínez-Chapa、Mohammad Mahdi Aeinehvand综述了OOCs与膜的相关性,以及它们在不同器官模型中的支架和驱动作用、性质(物理和材料)和制造方法。相关论文“Polymeric and biological membranes for organ-on-a-chip devices”于2023年8月29日发表于杂志《Microsystems & Nanoengineering》上。
首先描述了液体流动和循环应变的机械刺激,以及它们对细胞产生的生理相关性(IPR)的影响;
其次,还包括合成和ECM(细胞外基质)蛋白膜的制备方法、它们的特性(例如,厚度和孔隙率可以根据应用进行调整),以及用于其涂层的生物材料;
最后,讨论并描述了膜在不同研究目的中的作用及其优势和挑战。
1. 提高细胞生理相关性的相关力学条件
剪切力以及化学和机械信号不仅对细胞存活至关重要,而且还影响细胞活动,如细胞迁移、通过离子通道的质量传输和蛋白质构象变化。如图1所示,OOCs中生理流动和机械应力的实现和组合对于阐明细胞相互作用及其对微环境的反应至关重要,这与病理学研究越来越相关,因为更现实的生理环境(例如,全血灌流)能够实现更多的生理反应(例如,患者来源的细胞培养)。在以上方面,OOC上的膜作为支撑物、屏障或减震器间接调节细胞暴露于外力(剪切力、流体流动、机械刺激)。这一部分综述了聚合物膜对OOCs的研究,其中讨论了流体切应力和机械驱动在不同组织培养中的影响。
图1 膜介导细胞在流体剪切应力和机械驱动下的机械感应
(1)OOCs中的流体剪切应力
流体剪切应力(FSS)通过血液流动直接存在于体内,在代谢物去除和触发表型变化中发挥关键作用。在许多OOC中,连续的流体流动会去除代谢物,限制了与细胞的相互作用和摄取。尽管不利于药物暴露研究,但这一特征导致抑制因子的去除,从而有助于细胞的生理相关性(IPR)、基因表达和细胞性能的提高。反过来,细胞IPR(例如,通过屏障功能所需的紧密连接)有助于限制成熟细胞中的物质通透性。多孔膜会影响OOC内的液体流动。Chung等人的研究基于膜的厚度和孔隙度计算了渗透率和流速分布。结果表明,从溶质扩散、流体流动和电流方面表征组织屏障的渗透性可以指导组织屏障和共培养模型的设计和评估。溶质通透性是组织屏障紧密性和主动运输速率的指标,可以通过示踪分子的通透性来估计。另一方面,流体渗透性表明屏障形成成熟,组织屏障的一般漏性可以通过经上皮/经内皮电阻(TEER)快速评估。因此,FSS在OOC内创造了一个动态的微环境,与多孔膜等元素相互作用,使细胞更接近于器官水平的结构和功能。
(2)创造一个动态的环境来促进细胞的特化
剪应力的相关性可以追溯到它对细胞机制的影响,细胞机制感知并响应外部变化。例如,脑微血管内皮细胞对FSS(例如,毛细血管样剪应力~6dynes/cm2)的反应是通过增加细胞骨架蛋白的产生以及紧密连接和转运蛋白来实现的。在肾脏,FSS(0.2-5dynes/cm2)有助于F-肌动蛋白的聚合和解聚,从而影响肾小管的形态和极化。FSS(0.002-0.03dynes/cm2)影响肠上皮细胞(如Caco-2细胞)的微绒毛形成和机械转导。
剪切力通过刺激机械感应蛋白F-肌动蛋白和绒毛蛋白,导致上皮刷状边界重组,这是肠道功能的基础。如图2a所示,Caco-2细胞的紧密连接在中等FSS(0.02dyn/cm2)时形成,但在低FSS(0.002 dyn/cm2)和高FSS(0.03dyn/cm2)时减少。高水平的FSS增加了空泡化(一种细胞应激指标),保护性粘液的产生,以及线粒体的活性,这是由于对ATP屏障完整性的依赖。FSS与细胞内和细胞外刺激一起影响细胞特化,最终使FSS感应产生反馈循环。
(3)应用FSS技术研究细胞体外分化机制
当使用OOC时,细胞暴露在FSS中,通常使用膜来提供支持,并通过毛孔实现营养扩散。Shin等人进行了一项研究,以阐明基底液和顶部液剪切力对培养在芯片上的肠道上皮细胞的影响。研究人员收集了在静态Transwell中培养三天的Caco-2细胞的培养液,并将样本流过芯片上肠管的底腔,同时保持顶腔上持续的液体流动,导致培养在芯片上的肠道中的Caco-2细胞的3D形态发生停止。此外,作者将一个三周的Caco-2单层膜转移到由有机硅创建的混合流体设备中(图2b,c),仅对底部腔施加液体流动,在48小时内观察到三维形态发生。
图2 微流控装置中流体流动的相关性
(4)利用FSS更接近地模拟器官水平的功能
在这些研究中,模拟了多层器官,并通过同时接触流体或FSS使膜两侧的细胞层分化。在OOCs中,细胞暴露于外部机械信号,如FSS和应力/应变,可以被调节以产生不同的特化特征,而膜可以使小室和细胞层之间的通信并提供支持,进一步培育动态的封闭微环境。
2. 膜机械驱动
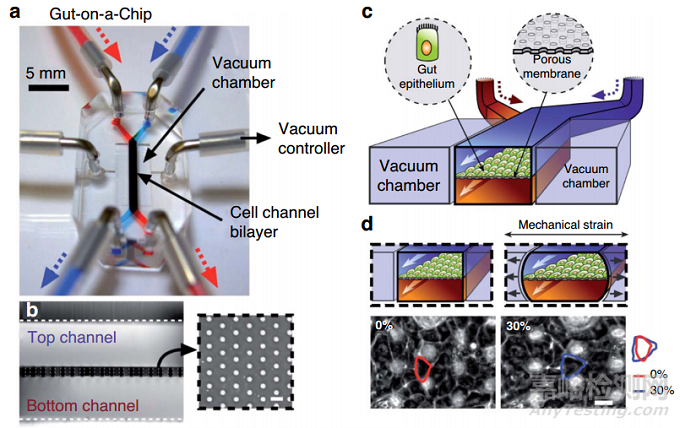
通过循环运动对膜的机械刺激在生理上与经历呼吸的肺细胞、经历蠕动运动的肠细胞或跳动的心脏细胞有关。机械刺激通常是通过膜两侧的一对侧室的真空吸(图3)或通过电产生的负压来实现的。
图3 OOC机械驱动
机械驱动也被证明影响细胞排列,这可能是由应变避免机制或存在或不存在约束边界条件(拉伸或约束)驱动的。在内皮细胞、成纤维细胞、间充质干细胞和成骨细胞中均存在应变避免或垂直于施加的循环拉伸的方向。最后,除了支持和驱动外,OOC中的膜还可以保护组织免受非生理性剪切力的不利影响。例如,当使用离心将hiPSC(人类诱导多能干细胞)衍生的心肌细胞装入芯片时,膜限制了介质模块中的对流运输,而位于组织腔室的细胞保持活力和功能。
OOC中的FSS和机械驱动
复杂的机械条件,如FSS和机械刺激的结合,导致器官水平的结构和功能的产生,更接近于在体内观察到的结构和功能,从而允许重述复杂的机制。另一个例子是血管,由于跨壁压力和血液流动摩擦产生的壁切应力,血管在体内经历周期性应变。跨壁压力导致血管壁扩张(向各个方向变形)并改变剪应力,而剪应力在血流方向上起作用,这两种力量都能诱导内皮细胞发芽并增加屏障功能。
3. 膜特性
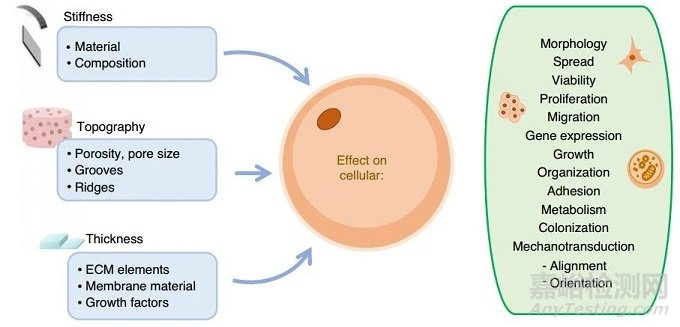
细胞可以感知环境的变化,包括影响其黏附、形态、生长、交流和迁移过程的机械和化学变化/线索。要实现这种灵敏度,必须精确控制膜的特性,如硬度。硬度可以通过成分变化、表面形貌和厚度来调整,这可以通过微米和纳米软化来实现。用于开发用作细胞培养支架的膜的主要参数如图4所示。
图4 膜的特性可以调整来模拟体内表面和促进细胞特化
(1)硬度
基底硬度产生与ECM和粘附蛋白相关的不同基因表达模式,从而影响细胞活性。例如,当在坚硬的表面上培养时,人间充质干细胞(hMSCs)更容易扩散,表现出更稳定的局灶粘附,并表现出更快的迁移和更高的增殖率。模拟大脑的软基质是神经源性的,而更硬的、类似肌肉的支架是肌源性的,而坚硬的胶原基质是成骨性的。
(2)形貌
膜的形貌特征包括多孔,孔状结构可以促进组织的粘附和聚集。例如,孔隙度使细胞迁移并增加表面积。膜的表面结构可以是凸起或凹陷的,并根据几何形状或纤维影响接触引导细胞。可以通过纳米球、微柱或提供锚点的纳米颗粒对表面进行修饰,暴露于FSS的细胞对具有凹槽形貌的膜表面具有更高的粘附性,因为它们与天然ECM相似。
(3)厚度
膜厚度影响细胞通讯、接触,甚至影响组织结构。商用膜和许多复制品模制的PDMS膜的厚度约为10μm,这阻碍了所需的凸起和通过孔的细胞类型之间的并置。体内肺泡膜厚度为2.2 μm,胎盘厚度为4.53 μm,血管基膜厚度小于100 nm。
4. 合成聚合物膜的制造
(1)PDMS膜的制备方法
PDMS除了具有高弹性、光学透明性和生物相容性外,还具有高机械稳定性、低化学反应性和低导热性,是一种弹性体和标准材料。然而,PDMS的组成和固有刚度与天然ECM有很大不同,影响了细胞的生长和粘附。此外,PDMS的疏水性阻碍了生物分子的附着和蛋白质的吸附。
PDMS膜是一种多功能且有前途的OOCs元件,膜制造技术的最新发展为人体生理和疾病的体外研究创造了新的途径。然而,传统的PDMS微流控器件制造技术,包括软光刻技术,可能存在诸如高成本和有限的可扩展性等缺点。因此,为了克服这些限制,正在开发新的制造技术,包括静电纺丝、表面改性、增材制造和模板。
软光刻技术
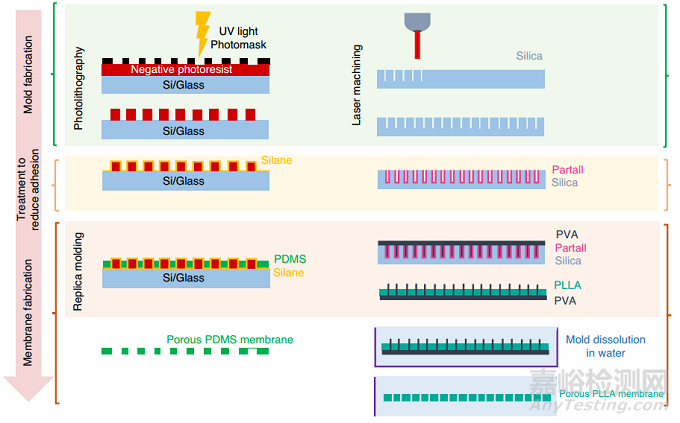
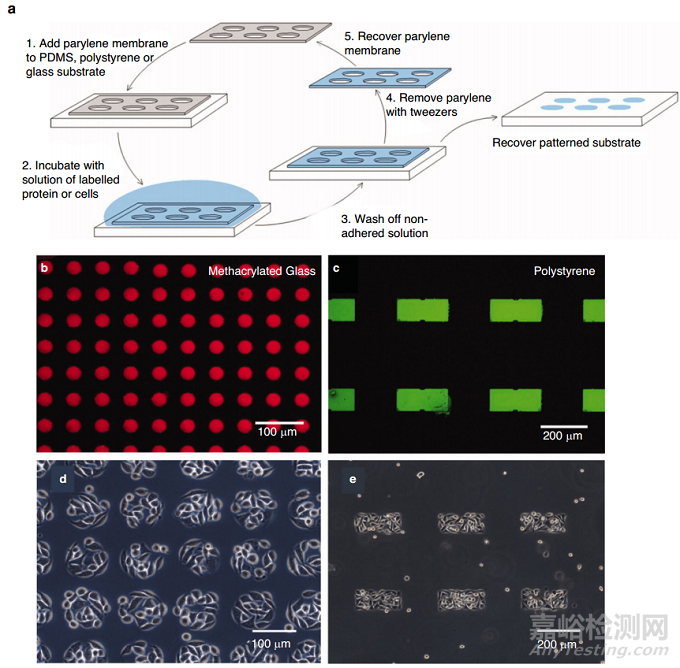
亚微米特征是细胞培养的关键,因为它们允许细胞间交流和物理接触,而薄膜提高生物分子运输和营养物质转移率。由于传统光刻的衍射限制(图5,左),很难生产孔径和厚度小于5 μm的PDMS膜。用于制造硅模具的高分辨率光掩模(<2 μm)是可用的,但价格昂贵。无掩模激光直写技术提供了克服这一限制的替代解决方案,并提供了关于微米级图案设计和3D几何的灵活性。聚乙烯醇(PVA)被用作PDMS结构的牺牲层。Pensabene及其合作者提出了一种制造牺牲PVA纳米针的方法,以制造用于人脐静脉内皮细胞(HUVEC)培养的聚L -乳酸(PLLA)膜。该方法使用飞秒激光加工形成具有1 μm直径孔的硅晶片,然后涂上称为Partall®Film #10的水/醇基PVA脱模剂(图5,右)。
图5 多孔膜的制作过程可分为以下几个主要步骤:模具制作、减少附着的处理和膜制作
高压饱和蒸汽形成孔隙
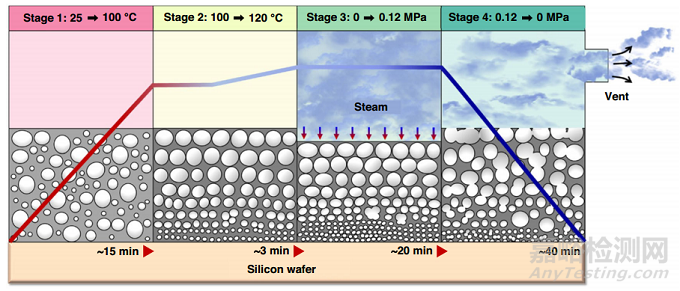
Jang和他的合作者通过高压灭菌循环探索了高压饱和蒸汽的孔隙形成。该方法结合温度、压力和湿度,产生微米级气泡,一旦PDMS固化,这些气泡就会变成孔隙(图6)。该工艺减少了膜的厚度,从而增强了膜的物理性能,增加了杨氏模量、粗糙度和透气性。
图6 Jang等(2019)提出的高压饱和蒸汽法制备多孔PDMS膜
替代方法:3D打印、静电纺丝等
替代技术包括PDMS 3D打印和使用多孔素(如盐和糖等可溶解颗粒)和用于微图案的颗粒(玻璃微球)。Ozbolat及其合作者进行的一项研究发现,与铸造样品相比,PDMS 3D打印改善了其机械性能(图7)。
图7 PDMS 3D打印改善了由于表面不均匀而导致的细胞粘附和扩散
(2)蛋白质和水凝胶膜涂层
本节介绍用于增强合成膜生物相容性或促进细胞与底物相互作用的主要生物材料。重点放在普遍实施和良好表征的生物材料,如胶原蛋白,纤维连接蛋白和水凝胶。
OOC膜涂层中的蛋白质
胶原蛋白和纤维连接蛋白是体外模拟细胞外基质的两种主要蛋白质。Matrigel®是一种基于细胞外基质的鼠源性水凝胶,由于其类似于上皮基底膜,因此是一种广泛使用的基质。蛋白质可以作为单层或局部以特定形状或图案被覆在膜上。选择性转移通过微接触打印(μCP)或微流体实现,并提供细胞(例如,心脏组织或肌肉纤维)通过改变方向和排列对其作出反应的几何线索。μCP蛋白质图案的大小可以低至0.5μm;然而,图案的完整性取决于膜的特征大小和化学性质,因为更大的特征和疏水表面呈现更强大的结合。Wright和他的合作者进行的一项研究使用可重复使用的10 μm厚的对二甲苯-C模板在PDMS和聚苯乙烯上实现了纤维连接蛋白图案(图8)。
图8 蛋白质与细胞构型
OOC膜涂层用水凝胶
水凝胶有效地模拟了ECM的化学成分和机械性能127,因此可以生物物理地刺激细胞分化和排列。水凝胶可以通过光刻和微图像化、立体光刻、微成型、微流体粘指法和生物打印等方法进行微制造。刺激响应水凝胶可以通过pH值、温度、离子强度和电场或磁场来驱动或定型。如聚(N-异丙基丙烯酰胺)(PIPAAm)是一种热响应性水凝胶,由于其较低的临界溶液温度(LCST),它可以开关其溶解度和聚集性;海藻酸、壳聚糖和透明质酸(HA)等天然水凝胶具有生物相容性,例如,HA 具有CD44受体,当与细胞结合时可产生细胞粘附力;半合成水凝胶,如甲基丙烯酰化明胶(GelMA),含有天然和合成成分。明胶是胶原蛋白水解的产物,含有细胞粘附序列,如 RGD 和基质金属蛋白酶,细胞可通过这些序列粘附、增殖和扩增。
5. 生物ECM蛋白膜
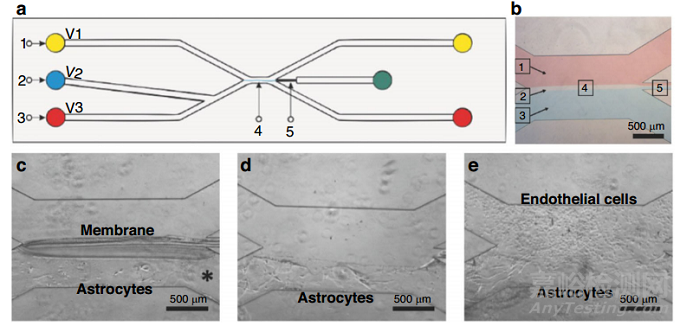
细胞外基质在结构上可分为两部分,一部分是致密多孔的基底膜,由胶原蛋白 IV、纤连蛋白和层粘连蛋白等蛋白质组成;另一部分是致密的亲水性间质,由蛋白聚糖和纤维状(I 型)胶原组成。整合素是一种跨膜蛋白,可传递外部信号并经历构象变化。整合素与ECM蛋白(胶原蛋白、纤维连接蛋白、层粘连蛋白)相互作用,并通过与细胞骨架的连接影响细胞形状。一种实现原位制造的血脑屏障(BBB)芯片利用微流体实现了临时壳聚糖膜,膜作为星形胶质细胞的支撑,一旦星形胶质细胞培养建立,去除膜,与星形胶质细胞直接接触的内皮细胞共培养(图9e)。利用壳聚糖的pH响应性,通过界面聚合制备膜。碳酸盐(中性,pH 7.0)和磷酸盐(碱性,pH 9.6)缓冲液在微流控装置上共流动(图9b)。壳聚糖膜在缓冲液之间的界面之间形成,注入碳酸盐与壳聚糖接触,碳酸盐使壳聚糖质子化并使其可溶。然后,壳聚糖接触碱性磷酸盐缓冲液时,通过去质子化发生聚合。在膜的一侧植入星形胶质细胞后,通过醋酸溶液(pH 5.0)通过质子化去除壳聚糖(图9c, d)。
图9 Tibbe等人(2018)原位壳聚糖膜制备
综上,OOC中的膜有助于提供与细胞在体内所经历的环境非常相似的环境,这些环境涉及机械因素,特别是剪切应力和机械拉伸,或固有的材料特性,如刚度和形貌。本文综述了不同膜的主要特性、作用和材料。PDMS是拉伸应用和基因表达研究的首选材料,但通常需要蛋白质涂层,含有蛋白质的ECM膜可以长时间支持细胞生长并诱导更多的生理反应。最佳的膜应该由足够薄的天然蛋白质组成,以使细胞通信和/或接触,而不牺牲机械刺激所需的灵活性。
文章来源:https://doi.org/10.1038/s41378-023-00579-z