作为一种重要的药物模态,寡核苷酸的开发领域在未来几年将持续加强拓展。寡核苷酸药物是一类由短核苷酸序列(DNA和RNA的组成部分)组成的治疗药物,它的进步引导了基因表达控制的新机制,通过药物控制对基因表达水平,抑制致病蛋白的生成。
寡核苷酸药物开发流程:
1、靶标识别
寡核苷酸药物靶向那些参与疾病过程的特定基因、信使RNA(mRNA)或非编码 RNA(例如microRNA)。靶标识别是开发这些药物的关键步骤。
2、序列设计
寡核苷酸药物,从本质上来说是依照靶标RNA来设计的,它的核苷酸序列与靶标RNA互补。这赋予了它们高度的结合特异性。
3、与靶标RNA结合
寡核苷酸药物一旦进入体内,就会在血液中循环,通过互补碱基配对选择性地与目标RNA分子结合。这种亲和作用可以通过多种机制发生:
mRNA降解:一些寡核苷酸药物能够触发靶标mRNA的降解。当这种寡核苷酸药物与mRNA结合时,它可以招募细胞酶来降解RNA分子,阻止其翻译成蛋白质。
阻断翻译:某些寡核苷酸药物可以物理阻碍核糖体的结合位点,或者干扰其他翻译过程,阻断mRNA翻译成蛋白质。
剪接调节:如果寡核苷酸药物的靶标是前信使RNA(Precursor mRNA),这些药物可以影响选择性剪接。通过与特定的剪接位点结合,它们可以促进特定外显子的包含或排除,从而导致蛋白质亚型的改变。
RNA干扰(RNAi):一些寡核苷酸药物可以通过RNA干扰机制发挥药效。它们被整合到RNA诱导沉默复合物(RISC,RNA-induced silencing complex)中,并引导RISC寻找目标mRNA,导致其降解或翻译抑制。
4、对蛋白质产生影响
通过调节靶标RNA,寡核苷酸药物可以降低致病蛋白的产生水平。通常用于治疗由蛋白质生产过剩或者功能障碍引起的各种遗传性疾病和罕见疾病。
值得注意的是,寡核苷酸药物在治疗各种疾病方面显示出光明的前景,包括:遗传性疾病、神经退行性疾病和某些类型的癌症,尤其是在很多传统上被认作“不可成药”的靶标上,可以发挥关键的作用。然而,它们的开发可能很复杂,并且可能有局限性和潜在的副作用,在临床使用中需要仔细考虑。
1、反义寡核苷酸
反义寡核苷酸(ASO,Antisense oligonucleotides)是经过化学修饰的单链DNA或RNA分子片段,长度通常为15-30个核苷酸,通过Watson-Crick碱基配对规则与内源性mRNA靶标特异性结合。ASO包括反义RNA(asRNA)和反义DNA(asDNA)。
从类药性角度考虑,通常需要对反义寡核苷酸进行化学修饰,以保证生理条件下的稳定性,增加抑制mRNA靶标的效力。
ASO的作用机制包括:翻译抑制、mRNA降解、剪接调节。它可以应用在基因沉默,治疗某些遗传性疾病、癌症和神经退行性疾病之中。ASO在治疗脊髓性肌萎缩症(SMA)、杜氏肌营养不良症(DMD)、肌萎缩侧索硬化症(ALS)和某些癌症方面,显示出良好的前景。例如,nusinersen(Spinraza)就是一种被批准用于治疗SMA的ASO。
1.1硫代磷酸酯寡核苷酸
硫代磷酸酯(Phosphorothioates)是寡核苷酸药物最初的主链修饰方式。Fomivirsen(商品名Vitravene,图1)是第一个被批准用于人类治疗的反义寡核苷酸药物。它是一种硫代磷酸酯寡核苷酸衍生物的抗病毒药物,治疗巨细胞病毒引起的视网膜炎,这种疾病出现在一些艾滋病患者中,如果不进行干预治疗会导致患者失明。
硫代磷酸酯的主链修饰,延长了寡核苷酸在血清中的半衰期,促进其与血清蛋白的结合,增加细胞摄取,指导核糖核酸酶H降解靶标mRNA。
图1. Fomivirsen化学结构(红色部分为一个硫代磷酸酯结构),来源:Wikipedia
1.2Aptamer(适配体)
适配体既可以是单链DNA、RNA分子,也可以是多肽分子,它们具有独特的三维结构,能够选择性地结合特定的靶分子,例如蛋白质、核酸、小分子,甚至细胞。适配体有时被称为“化学抗体”,因为它们能够以高特异性和亲和力识别并结合其靶标。适配体与抗体相比具有多种优势,包括尺寸更小、易于合成以及修饰潜力。当在体内使用时,它们通常也不会引起免疫反应。
就寡核苷酸来说,适配体是无毒且非免疫原性的单链DNA或RNA寡核苷酸,长度在 20至80个核苷酸之间。这些aptamer分子可能具有与抗体相似的结合亲和力,并且可以大规模合成、修饰,以实现优化药代动力学特性。
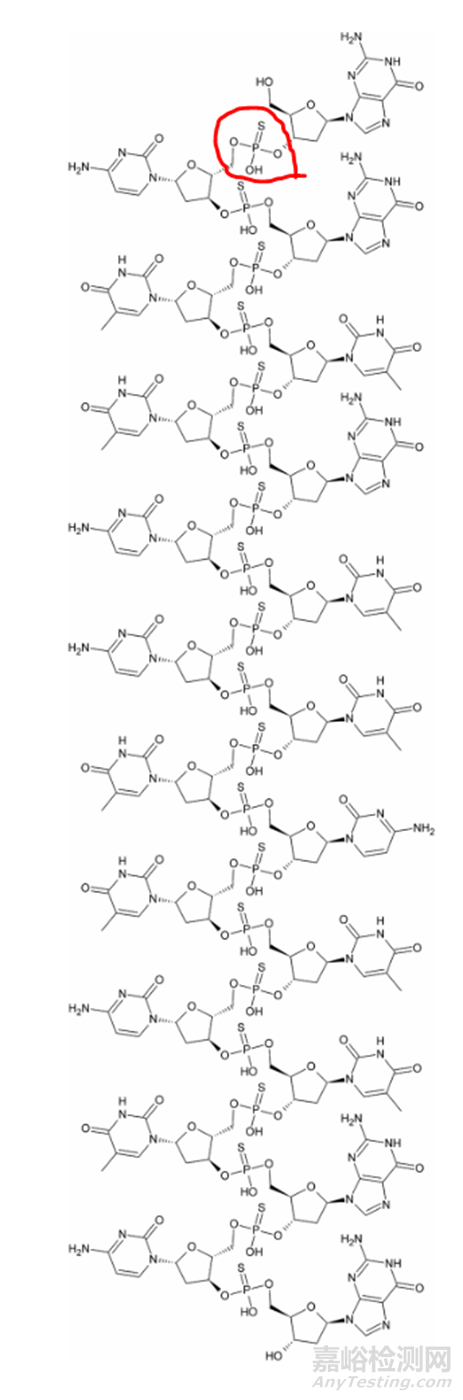
Pegaptanib(商品名 Macugen)是目前唯一被批准用于人类治疗的aptamer(有几种aptamer正在进行临床试验)。Pegaptanib分子中的寡核苷酸与聚乙二醇(PEG) 化学连接(图2),用于治疗新生血管(湿性)年龄相关性黄斑变性(AMD),2004年12月获得FDA批准。
图2. Pegaptanib化学结构
Pegaptanib与血管内皮生长因子(VEGF)具有高亲和力。Pegaptanib特异性结合 VEGF的165亚型,后者是一种在血管生成和渗透性增加(血管渗漏)中,发挥关键作用的蛋白质,这是两个AMD的主要病理过程。Pegaptanib是VEGF的拮抗剂,注射到眼睛后会阻断VEGF的作用,减少眼内血管的生长,有助于控制渗漏和肿胀。
1.3Gapmer
Gapmer技术代表了第二代寡核苷酸药物。Gapmer是短DNA或RNA反义寡核苷酸,向寡核苷酸分子中,引入2'-O-烷基(以及其它修饰)结构。这种修饰增加了反义寡核苷酸对核酸酶的稳定性,不过这些衍生物不被核糖核酸酶H(RNAse-H酶)识别。这个问题可以被Gapmer技术化解:Gapmer分子的中央部分并未进行2'-O-烷基(或其他修饰基团)修饰,因此该部分可以保留与RNAse-H酶的高亲和力,而它们的突出端可以通过2'-O-烷基修饰进行改性。
Gapmer与目标RNA片段杂交,通过招募RNAse-H酶,通过其裂解作用来沉默该目标基因。由于遭修饰的RNA侧翼区域提高了它对核酸酶降解的抵抗力,因此,gapmer与靶标的结合具有更高的亲和力和生物活性(图3)。Gapmer目前正在被开发用于治疗多种癌症、病毒和其他慢性遗传性疾病。
图3. Gapmer作用机制,来源:Wikipedia by Biomolenguofu
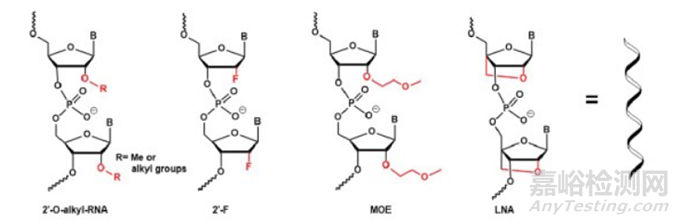
Gapmer化学修饰增加它对核酸酶降解的稳定性。经过LNA、2'-OMe或2'-F修饰的碱基(图4),衍生出天然RNA的化学类似物。这些修饰可以增强核酸的酶抗性、降低免疫原性并降低毒性。Gapmers还可以产生对目标mRNA更高的亲和力,这种高亲和力减少了脱靶效应、非特异性结合和不需要的基因沉默。
图4. 涉及2'-位置的寡核苷酸化学修饰,来源:Chemistry Today
Mipomersen(商品名Kynamro)是一种20个碱基的gapmer,抑制载脂蛋白B,于 2013年获批通过。Mipomersen通过降低低密度脂蛋白来治疗高脂血症。Mipomersen分子中,核苷酸以硫代磷酸酯键连接,而不是传统的磷酸二酯键;糖部分进行了2'-O-甲氧基乙基修饰(图5)。这些修饰使药物能够抵抗核酸酶的降解,从而实现每周给药一次的频率。
图5. Mipomersen化学结构(修饰的核苷酸处于分子两翼),来源:Wikipedia
其他Gapmer包括:2018年获批治疗运甲状腺素蛋白介导的淀粉样变性的Inotersen(Tegsedi),以及2019年批准用于治疗家族性乳糜微粒血症综合征的 Volanesorsen (Waylivra)。
1.4外显子跳跃的RNA剪接调节剂寡核苷酸
反义寡核苷酸也可以设计为与剪接区域互补的序列,用来治疗遗传性疾病。这个策略可以治疗剪接缺陷的疾病,允许诱导外显子排除或外显子包含。
在分子生物学中,外显子跳跃是RNA剪接的一种形式,用于“跳过”遗传密码的错误外显子部位。尽管外显子跳跃导致了基因改变,但变化后的基因仍能形成截短的蛋白质,而这个截短的蛋白质仍然可以发挥生物学功能。
基因由内含子和外显子组成。外显子是DNA的一部分,包含生成蛋白质的指令集。它们的片段周围散布着内含子非编码区域。在蛋白质制造之前去除内含子,仅留下编码外显子区域。
对于那些产生基因突变的外显子,可以用ASO与前信使RNA中的突变位点结合,以诱导外显子跳跃。ASO与突变的外显子结合,因此当该基因从成熟的mRNA翻译时,它会被“跳过”,从而恢复被破坏的基因阅读框。这个过程产生了内部缺失但主要功能仍然保留的蛋白质。这种机制被用于治疗杜氏肌营养不良症中。
这个领域内的寡核苷酸药物包括Eteplirsen(Exondys 51),Nusinersen (Spinraza),Golodirsen (Vyondys 53),Vitolarsen (Viltepso),Casimersen(Amondys 45)。这些寡核苷酸经过硫代磷酸酯键和2'-O-烷基-RNA(尤其是甲氧基乙基,MOE)的化学修饰。
PMO(Phosphorodiamidate morpholino oligomers,磷酸二酰胺吗啉低聚物)是一种重要的ASO修饰物。PMO是合成DNA类似物,能够抑制基因表达。PMO的主链是吗啉环,通过磷酸二酰胺键连接(图6)。作为不带电荷的核酸类似物,PMO通过 Watson-Crick碱基配对与目标mRNA的互补序列结合,通过空间封锁来阻止蛋白质翻译。PMO对生物体液中存在的多种酶具有抵抗力。值得注意的是,基于PMO的杜氏肌营养不良症(DMD)疗法Eteplirsen(图7),已获得FDA批准,成为基于 PMO的反义疗法的里程碑事件。
图6. DNA(单链)与PMO化学结构比较,图片来源:Front. Microbiol.
图7. Eteplirsen化学结构示意图,图片来源:Wikipedia
2、RNA干扰和治疗性siRNA
RNA干扰(RNAi,RNA interference)
RNA干扰途径是一种自然调节过程,通过小尺寸双链RNA(dsRNA)下调基因表达。通常分为三个类型:
小干扰 RNA (siRNA,small interfering RNA)
微小 RNA (miRNA,microRNA)
Piwi 相互作用 RNA (piRNA)
基于RNAi的疗法,涉及将合成的小RNA双链体(例如siRNA、人工miRNA和小发夹 RNA (shRNA))递送到确定的靶细胞中,产生基因沉默效果。
这些小RNA分子连接并激活蛋白质复合物,尤其是RNA诱导的沉默复合物 (RISC)。一旦结合,它们就可以与目标mRNA 结合,并在物理上阻止核糖体继续合成相关蛋白质,标记该mRNA以进行破坏。RNA干扰可以在mRNA自然降解之前将其破坏,终止致病路线。
RNA干扰还可以在细胞合成机器制造病毒蛋白之前,攻击细胞的mRNA,有时甚至攻击基因组,从而保护细胞免受病毒侵害。
3、寡核苷酸药物递送
同很多大分子药物一样,寡核苷酸疗法面临的一个重要挑战在于药物递送,特别是基于RNA的药物递送,因为它们的细胞摄取通常效率差,而且在生理条件下的稳定性低。
使用脂质制剂可以解决这一问题,或者制备含有识别分子的缀合物。例如Patisiran (Onpattro),针对遗传性运甲状腺素蛋白介导的淀粉样变性引起的多发性神经病。Patisiran是第一个被批准此适应症的siRNA药物,通过利用脂质纳米颗粒 (LNP) 将药物直接输送到肝脏。
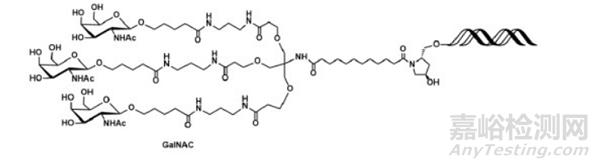
Givosiran(Givlaari)的获批用于治疗人肝卟啉症,这是一个具有里程碑意义的事件,因为这是首次使用N-乙酰半乳糖胺三聚体(GalNAc,图 8)主动转运siRNA药物至肝脏,siRNA分子抑制氨基乙酰丙酸合酶。该制剂通过皮下注射,使siRNA在靶肝细胞中积累。它的成功催生了其他几种siRNA的药渡递送路径,例如Inclisiran (Leqvio),Lumasiran(Oxlumo),以及Vutrisiran或Amvuttra。
图8. GalNAc三聚体化学结构,来源:Chemistry Today
展望
寡核苷酸代表的新疗法正在大步向前,前进道路上的目标主要涉及寻找和开发新的靶点和作用机制。
孕育新药的领域之一,在于使用寡核苷酸作为microRNA的调节剂。miRNA的失调与许多人类疾病有关,包括癌症、神经退行性疾病和自身免疫性疾病。合成miRNA在调节内源miRNA表达的领域中大有可为。miRNA疗法可分为两大策略:
1)miRNA模拟物(激动剂,dsRNA):用于恢复受抑制的miRNA水平;
2)内源性miRNA抑制剂(拮抗剂,ssRNA),称为antimiRNA或antagomir,下调过度活跃的miRNA表达。
在三聚体的GalNAc作为递送物质,成功将寡核苷酸药物靶向肝细胞后,这个领域的研发热情已经被带动起来,其中的一个热点是制备用于肝外递送的新型寡核苷酸偶联物,尤其是多肽-寡核苷酸和脂质-寡核苷酸缀合物的开发。由小分子和寡核苷酸组合形成的偶联物新实体也很重要,这些小分子可以通过受体介导的机制促进药物的细胞摄取,也可以通过protac(蛋白降解靶向嵌合体)降解途径诱导蛋白水解。适配体(Aptamer)也代表着寡核苷酸药物开发的一种重要方向。
DNA纳米技术将是另一个锦上添花的领域,它可以为治疗和诊断提供精细的纳米结构,从而改善寡核苷酸药物的药代动力学和药效学特性。
最后,寡核苷酸行业将面临一个重要挑战,它来自CMC领域,即以更少的试剂和溶剂消耗生产寡核苷酸药物。在更环保的条件下优化生产,将是寡核苷酸工业界CMC未来几年的主要方向。
参考资料:
1. Lee, J. Antisense PMO cocktails effectively skip dystrophin exons 45-55 in myotubes transdifferentiated from DMD patient fibroblasts. PLoS One. 2018; 13(5): e0197084.
2. Extance, A. Oligonucleotide drugs step up. Chemistry World. 23. 09. 2015.
3. Nan, Y. et al. Antisense Phosphorodiamidate Morpholino Oligomers as Novel Antiviral Compounds. Front. Microbiol. 2018, 9. https://doi.org/10.3389/fmicb.2018.00750
4. Oligonucleotide Therapeutics. A Long And Windy Road Towards Future Medicines. 2023. 41. 12-15.