所有 1 型糖尿病(T1D)和晚期 2 型糖尿病患者都需要胰岛素治疗来控制血糖水平(BGL)。目前,血糖控制的改善依赖于混合闭环胰岛素输送系统,该系统将连续血糖监测设备与胰岛素泵连接起来,在高血糖水平(高血糖)时输送胰岛素。然而,患者需要每天 24 小时佩戴此类设备,并使用系留泵和管道,这就带来了风险,如插管引起的皮肤感染、设备故障和胰岛素不稳定问题。此外,设备和配件的高昂成本也让许多患者难以承受,而患者需要进行干预和繁琐的维护工作,这通常会因不可预测的饮食和运动模式而变得复杂,并伴有低血糖风险。在各种系统中,葡萄糖反应型聚合物微针(MN)贴片因其使用方便、易于去除以及在高血糖时可释放足量胰岛素而受到特别关注。理想的胰岛素给药聚合物 MN 贴片需要保留较高的胰岛素有效载荷,保持原生胰岛素的结构/生物活性,并能按需在较长的周期内快速释放胰岛素,水凝胶基 MN 贴片在这方面显示出巨大的潜力。除了可定制的聚合物成分外,水凝胶基 MN 贴片在干燥状态下还能物理穿透角质层,进入表皮间质,实现大分子的透皮给药。然而,大多数已报道的水凝胶基 MN 贴片都需要热、光或化学交联,这可能会导致胰岛素变性。一种能在高血糖浓度下输送胰岛素的透皮贴片具有极大的优势,可以减轻糖尿病患者对安全性的担忧,提高他们的生活质量。
来自加拿大多伦多大学的Xiao Yu Wu团队:
①设计了一种新型自交联葡萄糖响应聚合物微针贴片(MN),用于在高血糖状态下输送胰岛素。
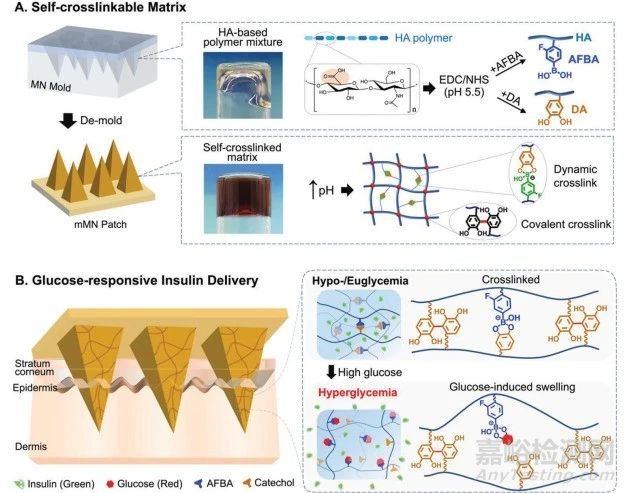
②微针贴片由多巴胺和 4-氨基-3-氟苯硼酸(AFBA)官能化的透明质酸聚合物制成,在没有任何化学交联剂或有机溶剂的情况下,聚合物溶液混合后即可快速交联。多巴胺(DA)单元中的儿茶酚基团之间通过自动氧化形成共价交联,并通过络合作用与苯硼酸(PBA)形成动态交联。儿茶酚和硼酸之间的可逆交联会随着葡萄糖浓度的增加而减少,从而导致高血糖时的膨胀率比优血糖时更高,胰岛素释放更快。
③体外分析和体内疗效研究都证明了这种卓越的葡萄糖响应特性。实验和分子动力学模拟显示,水凝胶聚合物还能保持胰岛素的原生结构和生物活性,这归功于透明质酸(HA)与胰岛素分子的相互作用。
基质微针(mMN)贴片的设计和制造过程简单,而且在输送胰岛素时具有葡萄糖反应性,因此具有很大的临床应用潜力。相关工作以题为“‘Smart’ Matrix Microneedle Patch Made of Self-Crosslinkable and Multifunctional Polymers for Delivering Insulin On-Demand”的文章发表在2023年9月18日的国际顶级期刊《Advanced Science》。
1. 创新型研究内容
本研究利用受贻贝启发化学的优势,设计了一种新型自交联聚合物基质 MN(mMN)贴片,该贴片能够封装高浓度胰岛素,具有超强溶胀能力,并能在高血糖时快速输送胰岛素。mMN 阵列由透明质酸(HA)聚合物骨架与含儿茶酚的多巴胺(DA)和 4-氨基-3-氟苯硼酸(AFBA)功能化而成,聚合物水溶液在微碱性 pH 值下混合后可快速交联。mMN 的交联是通过 i)儿茶酚-儿茶酚(DA-DA)共价连接和 ii)儿茶酚与 AFBA 之间的动态/可逆络合形成的,无需额外的交联剂和/或加热或紫外线照射(图 1A)。在生理和高血糖条件下,AFBA 通过与儿茶酚基团解离而优先与葡萄糖结合,导致二次交联网络断裂,增强水凝胶的膨胀并促进胰岛素释放(图 1B)。相反,在低血糖/无血糖条件下,AFBA 可逆地与邻苯二酚形成复合物,重新形成二次交联网络,促进水凝胶致密化,从而延缓胰岛素释放,降低低血糖风险。这种新型 mMN 贴片具有充分的皮肤渗透性、快速和超高膨胀能力、高胰岛素负荷能力以及有效的低血糖/高血糖预防功能。由于其在高血糖状态下的出色胰岛素输送特性以及保留胰岛素生物活性的能力,经体内实验证实,这种新型 MN 贴片在微创胰岛素给药方面具有巨大潜力。
图1 mMN 的制造及其葡萄糖反应性胰岛素输送
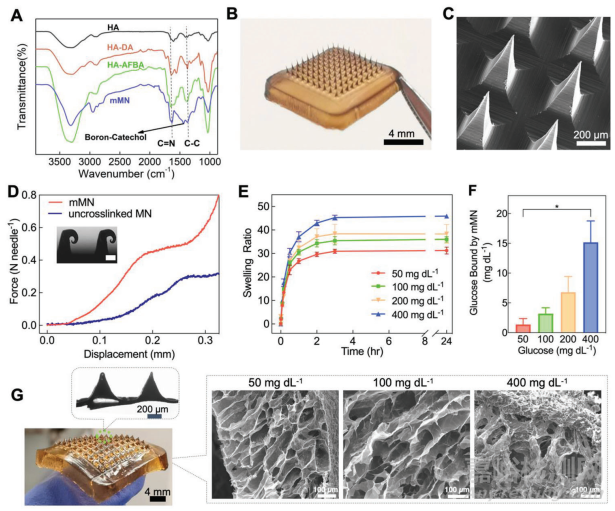
傅立叶变换红外光谱(FTIR)用于确认 mMN 贴片交联成功(图 2A)。与 HA 相比,HA-DA 和 HA-AFBA 在 1591 和 1285 cm-1 处出现两个峰值,分别归因于 C═N 伸展振动和芳香族 C─C 伸展振动,表明 DA 和 AFBA 功能基团已成功共轭到 HA 主干上。交联后聚合物的红外光谱在 1480cm-1 处出现了一个新的峰值,这是由于形成了邻苯二酚-硼酸酯复合物。此外,在 ≈3300-3400 cm-1 处邻苯二酚羟基的宽带显著降低,表明形成了 DA-DA 共价连接。本研究还关注了不同重量比的 HA-DA 和 HA-AFBA 混合物的流变学,以确定适合贴片制造的理想凝胶化动力学,同时实现葡萄糖反应性。在测试的比例中,HA-DA 和 HA-AFBA 的比例为 2:1,由于凝胶化阶段相对较慢,水凝胶更容易转移到模具中,而且形成的 MN 具有更锋利的尖端,完整性更好,因此被选中用于制造 mMN 补丁。如图 2B、C 所示,mMN 补丁由 10×10 的微针阵列组成,长度为 800 微米,呈金字塔形。补片呈现独特的棕色是由于 DA-DA 共价交联过程中儿茶酚基团发生氧化所致。交联的 mMN 贴片每针的断裂力超过 0.45 牛顿,而未交联的 MN 贴片每针的断裂力为 0.27 牛顿(图 2D),这表明在接下来的动物实验中,交联为皮肤穿透提供了足够的机械强度。本研究将 mMN 贴片浸入不同葡萄糖浓度(50、100、200 或 400 毫克 dL-1)的磷酸盐缓冲盐水(PBS,pH 7.4)中,代表低血糖、优血糖和高血糖条件,从而检测 mMN 阵列的溶胀能力。200 mg dL-1 的葡萄糖浓度是与糖尿病患者临床相关的高血糖水平,而 400 mg dL-1 通常在 T1D 大鼠模型中观察到。如图 2E 所示,mMN 在高血糖时变得极度肿胀,在 400 mg dL-1 葡萄糖介质中浸泡 3 小时后,肿胀程度达到其干重的 45 倍以上。值得注意的是,在最大膨胀状态下,可膨胀 mMN 的针头仍保持完整(图 2G)。
图2 体外表征和葡萄糖依赖性肿胀研究
由于在 mMN 形成过程中直接添加了胰岛素,mMN 系统显示出 100% 的胰岛素负载效率和高负载能力(18.2 wt.%),这为多周期胰岛素递送提供了优势。将 mMN 贴片浸入含有不同葡萄糖浓度(50、100、200 和 400 mg dL-1)的 PBS 中,对 mMN 贴片的体外胰岛素释放进行了检测。如图 3B 所示,高血糖状态(200 和 400 mg dL-1)下 mMN 贴片释放胰岛素的速率和程度大于优血糖(100 mg dL-1)和低血糖(50 mg dL-1)水平下的速率和程度,这表明 mMN 贴片以与葡萄糖反应的方式释放胰岛素。随着葡萄糖浓度的增加,更多的葡萄糖分子取代儿茶酚-AFBA 复合物中的儿茶酚基团,形成更多的葡萄糖-AFBA 复合物,导致更多的 mMN 肿胀和胰岛素释放。相反,当培养基中的葡萄糖浓度降低时,儿茶酚-AFBA 复合物的驱动力增加,从而再生二级交联网络,同时在反馈控制回路中降低胰岛素释放速度。因此,每隔 30 分钟将贴片交替浸入优糖溶液和高糖溶液中几个周期后,就能观察到胰岛素的脉冲式释放曲线(图 3C)。这种响应葡萄糖浓度的周期性高低胰岛素释放率有助于应用 mMN 进行日常血糖管理。相比之下,无葡萄糖反应的 MN 贴片(由 HA-DA 制成,不含葡萄糖反应单元 AFBA)能快速释放胰岛素,不受葡萄糖浓度的影响。虽然观察到了胰岛素的初始爆发释放,但这种效应在体内并不显著,因为只有微针的尖端插入皮肤,其膨胀会受到限制。
图3 体外葡萄糖反应性胰岛素释放
除实验研究外,本研究还利用分子建模和计算生物学方法研究了水凝胶聚合物对胰岛素分子的稳定作用的分子机制。利用全原子分子动力学(MD)模拟研究了胰岛素与功能化聚合物之间的相互作用模式,其中聚合物链与胰岛素的摩尔比是根据实验中使用的比例确定的。图 4A 显示了在 HA-DA 和 HA-AFBA 聚合物存在时,胰岛素在 t = 0(起点)、100、200、300、400 和 500 ns 的快照。如图 4A 所示,聚合物链包围了胰岛素分子,随着时间的推移,它们完全包裹了胰岛素分子。为了解聚合物对蛋白质结构和稳定性的影响,本研究分析了胰岛素在没有聚合物或有聚合物的情况下的均方根偏差(RMSD)值(图 4B)。在这项研究中,多肽α碳原子(Cα)的 RMSD 值是在模拟过程中参照其初始结构计算得出的。在模拟开始时(t = 0 到 t < 150 ns),存在聚合物的胰岛素的 RMSD 值高于其自由状态。肽的较高流动性可归因于分子与聚合物残基相互作用的初始运动。然而,在 150 ns 时,RMSD 值下降,这是因为胰岛素与聚合物的相互作用趋于稳定(图 4B)。本研究还监测了胰岛素分子中每个残基的均方根波动(RMSF),以确定聚合物对多肽残基动态行为的影响(图 4C)。胰岛素中 Cα 原子的计算 RMSF 值与从 X 射线晶体学实验中提取的多肽原子的 B 因子(热因子)进行了比较。如图4C所示,所有胰岛素残基对聚合物的存在都很敏感,这表现在它们在复合状态下的 RMSF 值较低。这一特征可归因于胰岛素与功能化-HA 聚合物之间的有利相互作用。图 4D 展示了胰岛素在聚合物不存在和存在的情况下回转半径(Rg)的典型结果。可以看出,与游离胰岛素相比,存在聚合物的胰岛素在 300 ns 及以后几乎没有变化,这表明聚合物对胰岛素的 Rg没有显著影响。
图4 不同时间胰岛素/聚合物系统的示意图
在体内研究中,首先通过向大鼠皮肤输送胰蓝染料,然后进行苏木精和伊红(H&E)染色组织学研究(图 5A、B),证实了 mMN 贴片具有出色的皮肤渗透能力。由于其微创性和高生物相容性,mMN 的痕迹在贴敷后逐渐消失。为了研究 mMN 贴片对高血糖的体内疗效,本研究将链佐菌素(STZ)诱导的 T1D 雄性 Sprague-Dawley 大鼠随机分组,分别使用胰岛素负载 mMN 贴片(58 U)、假贴片(作为对照)或皮下注射胰岛素(0.5 U kg-1)进行治疗。研究开始前,所有 T1D 糖尿病大鼠均禁食 5 小时。如图 5C 所示,在整个研究过程中,使用假贴片的对照组大鼠的血糖值一直处于高血糖状态。然而,接受 mMN 贴片和胰岛素注射治疗的大鼠的血糖浓度迅速下降,并在 1 小时内降至 165 mg dL-1 以下。相反,mMN 贴片成功地将大鼠的 BGL 调节在严格的血糖目标范围内(<190 mg dL-1 和 >70 mg dL-1)达 7 小时以上,这比其他研究小组报告的基质 MN 贴片的时间更长。与葡萄糖反应型 mMN 贴片不同,非葡萄糖反应型 MN 贴片装载了相同量的胰岛素(58 U),但没有 AFBA 单位,可快速释放胰岛素且不受葡萄糖浓度的影响。因此,它们不能长时间维持正常血糖,处理后的大鼠血糖在 3 小时后迅速升高。
为了研究 mMN 贴片的血糖调节能力,在应用 mMN 或注射胰岛素 2 小时后,通过注射 2 g kg-1 葡萄糖进行腹腔内葡萄糖耐量试验(IPGTT),以将初始血浆葡萄糖水平降至类似正常血糖水平。如图 5D 所示,经 mMN 治疗的 T1D 大鼠在血糖水平达到峰值后,其血糖浓度恢复到与健康大鼠相似的正常血糖水平。相反,皮下注射(s.c.)胰岛素 2 小时后的 T1D 大鼠在葡萄糖挑战后出现了持续的高血糖。经 s.c. 胰岛素处理的大鼠的葡萄糖曲线下面积(AUC)是经 mMN 贴片处理的大鼠 120 分钟持续葡萄糖暴露量的五倍(图 5E)。mMN 贴片的葡萄糖调节作用可归因于其葡萄糖依赖性胰岛素释放。如图 5F 所示,在 t = 0 时(即 mMN 贴敷 2 小时后),当血糖水平恢复到优格血症时,mMN 贴片处理大鼠的血浆胰岛素与假贴片处理组一样处于低水平,表明此时胰岛素 mMN 贴片释放的胰岛素检测不到。在 t = 0 时进行葡萄糖挑战后,血浆胰岛素水平在 30 分钟和 60 分钟时急剧升高达 9.8 倍,然后在 120 分钟时再次降至基础水平,而假贴片处理大鼠的血浆胰岛素水平没有变化(图 5F)。这些结果表明,mMN贴片能够根据血糖水平调节胰岛素释放速率,从而长时间维持正常血糖,而不引起低血糖,并迅速抑制高血糖。由于 T1D 大鼠的禁食时间和持续研究中每只大鼠的血样数量有限,胰岛素 mMN 贴片的长期疗效将通过大型动物模型进行评估,本研究小组正在进行后续的研究。
图5 STZ 诱导的 1 型糖尿病大鼠模型中 mMN 贴片的体内评估
2. 总结与展望
总之,本研究开发了一种可自交联的聚合物 mMN 贴片,它能够在高血糖状态下封装和输送胰岛素,并通过使用生物兼容的 HA 和蛋白质友好型交联条件保留了多肽的原生结构/生物活性。用于制造 MN 的交联机制无需使用加热或辐照等传统的苛刻交联方法。在制造交联 mMN 时,只需简单调节聚合物溶液的 pH 值,就能省去多步制造过程,为扩大 MN 贴片的制造规模带来了机遇。MD 模拟结果表明,通过胰岛素、功能化-HA 聚合物和水分子之间的相互作用,可以保留原生胰岛素结构。mMN 的血糖响应特性在体外得到了证实,并在 T1D 大鼠模型上得到了进一步验证,血糖目标至少维持了 8 小时。虽然持续皮下注射胰岛素比注射胰岛素能更好地控制血糖,但该系统的成本和不便妨碍了它的广泛应用。相比之下,使用 “智能”mMN 贴片的给药策略可以为糖尿病患者提供方便、无痛、经济的血糖控制,从而改善他们的生活质量。mMN 系统的设计和制造过程非常简单,因此具有推广和临床应用的巨大潜力。本研究中开发的 mMN 贴片已成功证明了其作为葡萄糖响应型一次性透皮给药平台的应用,该平台可优化后供日常使用。所述系统还可用于输送其他治疗激素,如胰岛素类似物和胰高血糖素,以实现长期血糖管理。要充分发挥 mMN 贴片的转化潜力,还需要优化贴片的设计和制造工艺。最后,胰岛素与聚合物结合的计算建模结果表明,MD 模拟有助于阐明选定聚合物材料稳定蛋白质的内在机制。
文章来源:https://onlinelibrary.wiley.com/doi/10.1002/advs.202303665