通过探讨《组合产品上市前路径指导原则》的相关要求,分析美国食品药品管理局(Food and DrugAdministration, FDA)对含药医疗器械5种典型情况的申报路径、参比器械选择的审评关注点,以期对我国以医疗器械作用为主的药械组合产品的申报注册提供参考借鉴。
本研究通过探讨美国食品药品管理局(Foodand Drug Administration, FDA)《组合产品上市前路径指导原则》(Principles of Premarket Pathwaysfor Combination Products Guidance for Industry andFDA Staff)[1]中对以医疗器械作用为主的组合产品(device-led combination product,以下简称“含药医疗器械”)上市前申报路径及参比器械选择的审评关注点,结合我国该类产品的审评情况,分析其借鉴意义,供我国药械组合产品相关监管部门和从业人员参考和借鉴。
1、 FDA《组合产品上市前路径指导原则》 内容概要
2019年2月,美国FDA发布了《组合产品上市前路径指导原则》草案稿,历时近3年,于2022年1月发布了该指导原则的正式稿。该指导原则阐明了FDA对组合产品上市前申报路径选择原则的考量,包括申请人与FDA各审评机构、组合产品办公室之间的沟通和协调,组合产品的上市前监管基础,以医疗器械作用为主的组合产品(deviceledcombination product)、以药品作用为主的组合产品(drug-led combination product)、以生物制品作用为主的组合产品(biologic-led combinationproduct)各自的上市前申请路径类型以及选择恰当的申请路径所需考虑的关键因素等内容。
该指导原则在第Ⅲ部分“组合产品的上市前监管基础”中明确指出,FDA认为药品、器械和生物制品在作为组合产品的组成部分时,保留各自独立的监管身份,即在其作为组合产品的组成部分时,仍适用于药品、医疗器械和生物制品的法规和监管要求。因此,对组合产品上市前的整体安全性和有效性要求,源自组合产品各组成部分相对应的、适用的法规和监管要求。FDA另行制定组合产品的专项监管要求,通常是为了解决组合产品的药品、器械和生物制品不同组成部分的法规和监管要求之间的重叠问题和不同监管领域的差别问题。
同时,FDA在该指导原则的附录部分指出,由于申请人对组合产品申请途径选择存在疑问的情况最集中出现在含药医疗器械,因此在附录部分以含药医疗器械的5种典型情况为实例进行说明,介绍了在产品注册申报时,含药医疗器械如何选择合适的上市前申报路径及如何选择恰当的参比器械等内容。
2、 含药医疗器械5种典型情况如何选择产品的申报路径及参比器械
在FDA,含药医疗器械按其风险程度、新型程度等不同情况,上市前申请路径主要分为上市前批准(premarket approval application, PMA)、新型医疗器械申请(De Novo)以及上市前通知[510(k)submission]这3种类型。《组合产品上市前路径指导原则》附录部分以含抗菌剂的腹腔引流管为例,给出了抗菌涂层首次添加到已明确管理类别的医疗器械、组合产品的药品部分增加新适应证、组合产品上的药物涂层方法发生改变、组合产品药品部分的浓度降低、组合产品的药品部分发生改变(用其他抗菌剂替代其组合产品原有的药品部分)等5种典型情况的具体说明。
2.1 典型情况1
典型情况1为抗菌涂层首次添加到已明确管理类别的医疗器械。假设参比产品(predicateproduct)为不含药品或生物制品、已被界定为Ⅱ类医疗器械、归属510(k)管理的产品(如腹腔引流管);假设组合产品所含的抗菌涂层(抗菌剂A),是与已获批用于静脉给药的新药申请(newdrug application, NDA)药物具有相同的活性成分,该成分用于治疗急性细菌性皮肤病和皮肤感染的疗效和风险已被确认;申请人已向FDA提供引用NDA授权的文件[根据美国联邦法案第503(g)(5)节,在满足503(g)(5)(A)&(C)所有要求的前提下,可沿用FDA先前对抗菌剂A的NDA安全性和有效性的审查结果]。
申请人拟将抗菌涂层(抗菌剂A)添加到上述参比产品中,制成单一实体的组合产品(以下简称“产品A”),在器械上添加抗菌涂层的目的是防止与外科手术及器械使用相关的感染,并且该抗菌成分以往未与该类器械进行组合。
对于这种典型情况,FDA认为虽然参比产品和组合产品的使用目的相同,但组合产品上添加抗菌涂层,产生了新的预期用途,且二者技术特征存在差异,引起了影响产品安全有效性的新问题,因此二者不具有实质等同性(not substantiallyequivalent, NSE)。在这种情况下,FDA不允许组合产品中药品部分单独申请采用510(k)实质等同途径的方式。组合产品与参比产品的比较不能充分证明组合产品的药品部分在其新使用条件下的安全有效性(包括新的药品适应证、给药途径以及药品与器械的组合使用)。
若组合产品符合美国联邦法案第513(a)(1)(A)或(B)和513(f)(2)节的要求,则该组合产品可能适合申请De Novo途径。在确定是否获准De Novo申请时,若申请人已被授权可引用药品NDA申请中的数据,FDA在审查该组合产品的De Novo申请时,会考虑将相关的药品NDA申请数据作为支持资料。若该组合产品不符合De Novo途径申报的要求,则需要按PMA途径申报。
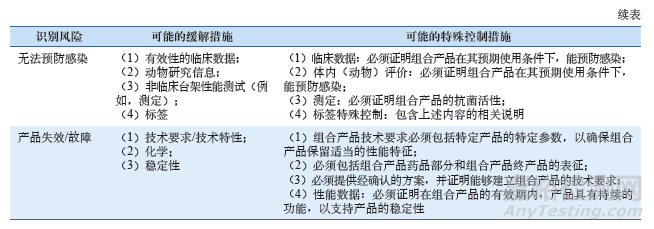
若该组合产品符合De Novo途径申报的要求,FDA在其风险识别和缓解、控制措施部分主要关注的问题,如表1所示。
2.2 典型情况2
典型情况2为组合产品的药品部分增加新适应证。假设参比产品为已上市的产品A;新组合产品的药品部分与产品A的药品部分相同;申请人已向FDA提供引用NDA授权的文件。基于药品部分的药理学性质,除抗菌特性用途之外,申请人提出产品A还具有新的抗感染适应证,通过减轻植入后宿主环境中的感染来提高产品的整体性能。
对于这种典型情况,FDA认为虽然二者的使用目的相同,新组合产品增加抗感染适应证及减轻感染的用途,引起了安全有效性的新问题,不利于与参比产品进行对比,二者不具有实质等同性。在这种情况下,不允许510(k)途径实质等同的方式应用于组合产品中药品部分的单独申请。新产品与参比产品(产品A)的比较不能充分证明组合产品药品部分新适应证的安全有效性。
2.3 典型情况3
典型情况3为组合产品上的药物涂层方法发生改变。假设参比产品为已上市的产品A;新组合产品与产品A的药品部分相同;申请人已向FDA提供引用NDA授权的文件。申请人拟改变药物涂层方式以改进产品A(减少药物从器械上的释放),目的是防止潜在的不良事件和毒性,同时保持药物的有效性,组合产品的预期用途或标签不变。
对于这种典型情况,FDA认为该组合产品的材料、其他特征与参比产品相比发生变化,具有不同的涂层、不同的药物配方,二者产品技术特征不同,但参比器械审查时已考虑了药物释放、安全性和有效性、感染率、生物相容性等问题,因此该技术特征差异未产生需考虑的安全有效性新问题,且有方法可用于评估该技术特征是否对产品的安全有效性产生影响。FDA通过审评(例如台架、动物和/或临床试验)来确定差异是否给新组合产品带来重大的安全性或有效性问题。这些内容对于证明新组合产品与产品A的实质等同和/或符合适用的特殊控制都是必要的,如果未能证明二者的实质等同性,或者不符合适用的特殊控制,则二者不具有实质等同性。在这种情况下,允许510(k)途径实质等同的方式应用于组合产品中药品部分的单独申请,证明实质等同性和遵守特殊控制足以证明组合产品药品部分涂层方法变化的安全性和有效性。
2.4 典型情况4
典型情况4为组合产品药品部分的浓度降低。假设参比产品为已上市的产品A;新组合产品与产品A的药品部分相同,唯一变化是浸渍到组合产品表面的药品部分具有较低的浓度(如从500 μg/cm2降低至400 μg/cm2),降低组合产品药品部分浓度的目的是保持组合产品的有效性的同时,通过减少组合产品的药物释放量,降低药物所致不良反应的可能性,但组合产品的预期用途或标签不变;此外,申请人已向FDA提供引用组合产品药品部分的NDA授权的文件。
研讨班丨2023药品委托生产管理与供应商审计策略
对于这种典型情况,FDA认为该组合产品的材料和其他特征与参比产品相比发生了变化,该组合产品具有较低的药物浓度,与参比产品的技术特征不同,但参比产品审查时已考虑了药物浓度及感染率相关的安全有效性问题,因此该技术特征差异未产生需评价的安全有效性新问题,且有相应的方法可评估该技术特征变化是否对产品的安全有效性产生影响。FDA通过审评(必要时包括临床数据)来确定差异性是否给新组合产品带来重大的安全性或有效性问题,允许发生这种改变的组合产品采用510(k)途径进行申报。
2.5 典型情况5
典型情况5为组合产品的药品部分发生改变(用其他抗菌剂替代其组合产品原有的药品部分)。假设参比产品为已上市的产品A;申请人将产品A中的抗菌剂A替换为NDA已获批准的抗菌剂B(适用于治疗急性细菌性皮肤病和皮肤感染),组合产品的适应证或使用说明不变;申请人已向FDA提供引用NDA授权的抗菌剂B的文件。
对于这种典型情况,FDA认为二者活性成分不同,且新组合产品与参比产品在设计、材料等特征方面也存在很大差异,引起了组合产品安全有效性的新问题,新组合产品与参比产品不具有实质等同性。在这种情况下,FDA不允许组合产品中药品部分的单独申请采用510(k)实质等同途径的方式。组合产品与参比产品的比较,不能充分证明药品部分在其新使用条件下的安全有效性(包括新的药品适应证以及药品与器械的组合使用)。该组合产品在上市之前需要按PMA途径申请或者可能适合采用De Novo途径申请。
3、 借鉴意义分析
3.1 中美含药医疗器械上市前申报路径异同
在FDA,含药医疗器械上市前申报路径分为PMA、De Novo、510(k)3种,必要时根据《组合产品上市前路径指导原则》第Ⅲ部分的要求,FDA对于产品申报路径选择原则,主要是基于产品的风险程度、新型程度的不同以及组合产品所含药物成分是否已获得NDA相应适应证的批准等因素进行考量。
在我国,《关于药械组合产品注册有关事宜的通告》[2](2021年第52号)第二条规定,以医疗器械作用为主的药械组合产品,应当按照医疗器械有关要求申报注册;同时,《医疗器械分类规则》[3](国家食品药品监督管理总局令第15号)第六条(四)规定,以医疗器械作用为主的药械组合产品,按照第三类医疗器械管理。根据上述规定,明确了我国的含药医疗器械是按照第三类医疗器械注册申报,由国家药品监督管理局(以下简称为“国家药监局”)医疗器械技术审评中心负责具体的产品技术审评工作,需要联合审评的项目,注册申报资料转国家药监局药品审评中心进行同步审评。
3.2 中美含药医疗器械注册申报要求
在我国,对于含药医疗器械的注册申报基本要求,除应按照《医疗器械注册申报资料要求及说明》等相关要求准备产品注册申报资料外,建议参考国家药监局发布的通用型指导原则《以医疗器械作用为主的药械组合产品注册审查指导原则》(2022年第3号)[4]等相关文件的要求,例如在注册申请表中注明“药械组合产品”,在CH3.8(其他资料)提交药物相关产品描述、药物和/或医疗器械与药物相互作用、药物含量/剂量选择资料,以及相关研究总结,在CH4临床评价资料部分根据产品临床疗效和潜在风险开展临床评价等,详细内容见该指导原则。该指导原则系对以医疗器械作用为主的药械组合产品注册审查的一般指导文件,阐述了对该类产品申报资料的基本要求,但由于该类产品品种多样,申请人还需依据具体产品的特性对申报资料进行充实和细化,具体的产品审评要求分布于各类产品的专用型指导原则中,如《冠状动脉药物洗脱支架临床前研究指导原则》《冠状动脉药物洗脱支架临床试验指导原则》《人工关节置换术用丙烯酸树脂骨水泥注册技术审查指导原则》等。
含药医疗器械各种类型的产品复杂多样,产品自身的风险存在差异,例如冠状动脉药物洗脱支架和含药腹腔引流管的风险存在差异;同类型产品的注册申报或变更注册的不同情形亦存在较大差异,例如组合产品与同类已上市产品相比药物种类、涂层等可能存在差异,或变更产品与自身原上市产品相比药物的含量等可能存在差异。不同类型的产品风险不同,不同变化情形的差异程度和导致的风险亦不同,因此其对应的评价思路和审评关注点必然存在差异。
针对各个产品不同的具体情况,如何选择合适的评价路径以及如何提交充分的支持资料,是目前该类产品申报的难点问题。FDA的《组合产品上市前路径指导原则》归纳总结了含药医疗器械5种最典型情况,分别介绍了不同的变化情形如何选择合适的申报路径及如何选择参比器械,为相关企业研发和准备产品注册申报资料提供了较好的细化分解思路和借鉴方案。同时,该指导原则中分析了不同情形下,需要考虑差异或变化内容给产品安全有效性可能带来的新增风险,以及需提交哪些支持资料证明产品的安全有效性。
但该指导原则亦存在一定的局限性,指导原则目前给出的5种典型情况举例说明,主要是基于该含药医疗器械符合510(k)或De Novo申报途径时,对于上市前申报路径、参比器械选择、风险识别及风险控制措施等方面审评关注点的建议,而对于判定需归属Ⅲ类PMA管理的含药医疗器械或需按指导原则第三部分要求申报的组合产品,该指导原则并未对相关的审评关注点进行详细阐述;此外,举例中提及的药品部分都是已获得NDA批准的药物成分,且申请人可取得引用相应药品部分NDA文件的授权,而对于全新的药品成分或不能取得授权等情况,审评的关注点也未进行具体的阐述。
3.3 建议
建议我国相关审评部门可参考《组合产品上市前路径指导原则》,选取典型情况进行举例说明的阐述方式,结合各种类型和变化情形的组合产品审评实例,进一步根据含药医疗器械的风险情况、变化情况等,梳理归纳总结更多的具体产品、具体变化情形的审评要求,特别是梳理不同情形下对于产品安全有效性支持资料的审评关注点,形成相应的审评框架、审评要点或共性问题答疑,并及时公开发布,用于指导相关企业的组合产品申报注册工作。同时,药械组合产品涉及多学科交叉,产品类型复杂多样,现有的药品或医疗器械的样品制备方法、检验方法学、剂量筛选、安全阈值等研究方法和评价方式可能不一定完全适用于创新型药械组合产品,需进一步完善药械组合产品方法学研究,以逐步形成药械组合产品方法学研究和评价框架体系,为该类产品的安全有效评价提供技术支持。
4、 展望
药械组合产品由于其独特的效果,具有多元的临床应用前景,创新产品不断涌现,但在药械组合产品的研发、生产、非临床研究、临床研究、上市临床路径选择、上市后监管等诸多环节需考虑的影响因素复杂多样,使其监管和注册申报更具挑战性,监管部门对于药械组合产品的监管理念和技术审评要求将不断完善。