HIV-1 以两种形式存在于精液和其他感染性体液(如血液、阴道分泌物和母乳)中:无细胞病毒和受感染细胞(即所谓的细胞相关病毒)。这两种形式都在病毒传播和扩散中发挥作用,但在评估 HIV-1 传播和相关预防措施的研究中,后者一直被忽视。猕猴体内研究表明,细胞相关病毒是 SIV 经阴道和大肠传播的主要途径,而人类新感染的 HIV-1 至少有一部分是由受感染细胞引发的。要有效控制病毒传播,针对这两种传播机制的预防策略都是可取的。然而,细胞相关传播是抗击 HIV-1 的一大挑战,因为它被认为是病毒在受感染细胞的保护下逃避抗体介导的中和作用的一种机制。由于缺乏预防性疫苗,临床研究使用广泛中和抗体(bNAbs)进行被动免疫,以抑制 HIV-1 感染。然而,bNAbs 对高度传染性的细胞相关病毒传播的疗效一直被忽视。存在于体液中的受感染细胞介导的 HIV-1 传播很可能主导感染,并帮助病毒逃避基于抗体的免疫。
来自法国巴黎萨克雷大学的Mariangela Cavarelli团队开发了抗 N-糖/V3 环 HIV-1 bNAb 10-1074 在杀微生物凝胶中的阴道局部应用配方,可显著保护非人灵长类免受细胞相关的阴道传染 SHIV162P3问题。治疗组的感染率明显低于对照组,6 只动物中有 5 只完全避免了感染。研究结果表明,粘膜输送强效 bnAbs 可能是预防感染细胞介导的传播的一种很有前景的方法,并支持在人类临床试验中使用基于抗艾滋病毒抗体的策略作为潜在的杀微生物剂。相关工作以题为“Mucosal application of the broadly neutralizing antibody 10-1074 protects macaques from cell-associated SHIV vaginal exposure”的文章发表在2023年10月6日的国际顶级期刊《Nature Communications》。
1. 创新型研究内容
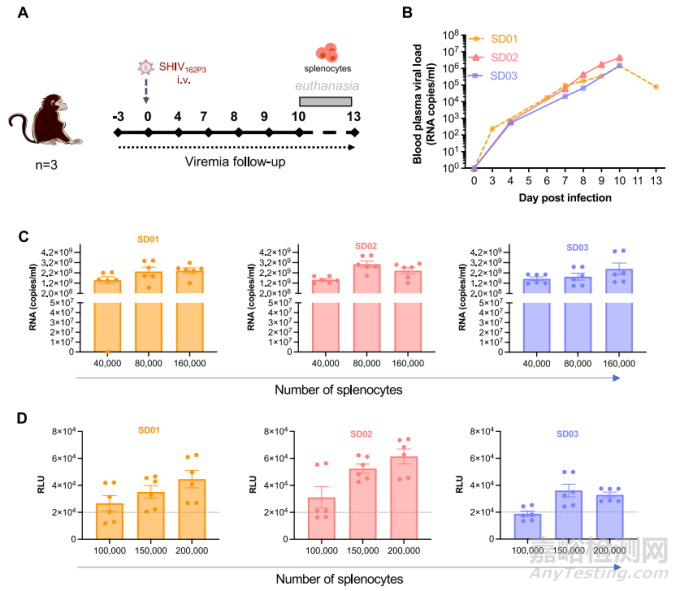
本研究首先建立了一批有活力的脾脏单核细胞,作为疗效研究中的挑战接种体。3只猕猴(CMs;SD01、SD02和SD03)经静脉暴露于R5-tropic病毒SHIV162P3,并在暴露后第10天(n = 2)和第13天(n = 1)之间被处死以收集脾脏(图1A)。安乐死时的血液病毒 RNA(vRNA)载量分别为 7.9 × 104、4.3×106 和 1.5×106 副本/毫升(图 1B),脾细胞中检测到的前病毒 DNA 载量也与之相同。本研究以 PBMCs(图 1C)和 TZM-bl(图 1D)为靶细胞,在体外滴定脾细胞的感染性,观察到 SHIV162P3 的细胞间转移呈剂量依赖性。这与本研究团队之前的报告的结果一致,来自三位供体的 40,000 个脾脏细胞足以让病毒传播到 PBMCs,而感染 TZM-bl 细胞则需要 100,000 到 150,000 个脾脏细胞(图 1C 和 D)。
图1 建立受 SHIV162P3 感染的脾细胞储库并对细胞介导的感染进行体外评估
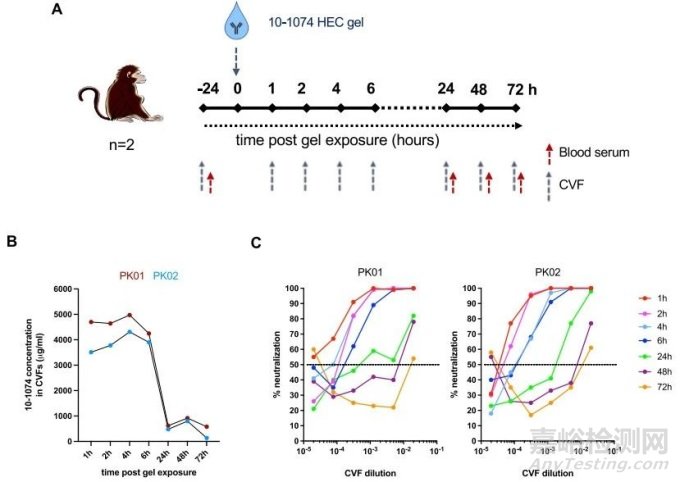
在药代动力学研究中,用 2 毫升浓度为 5 毫克/克的 10-1074 HEC 凝胶处理两只去势前列腺素预处理的雌性 CM。在不同的时间点(基线、1、2、4、6、24、48 和 72 小时)收集宫颈阴道液(CVF)和血液(图 2A),并通过 ELISA 法检测 YU-2 gp120wt 蛋白的 Ab 浓度(图 2B)。计算CVF中残留的活性10-1074的量与时间的函数关系。处理后 1 小时至 6 小时收集的 CVF 中的平均抗体浓度高于 4000 µg/mL(即对无细胞 HIV-1YU2 和细胞相关的 SHIV162P3 的 IC50 > 10.000 倍),在 24 小时后,两种动物的 CVF 中的抗体浓度均降至 600 µg/mL以下(图 2B)。同一时间点血清中的 10-1074 浓度水平仍低于检测限(40 纳克/毫升)。最后,本研究在基于 TZM-bl 的中和试验中评估了 CVF 对游离细胞 SHIV162P3 的抑制效力(图 2C)。
图2 宫颈阴道液中 10-1074 HEC 凝胶治疗的药效学研究
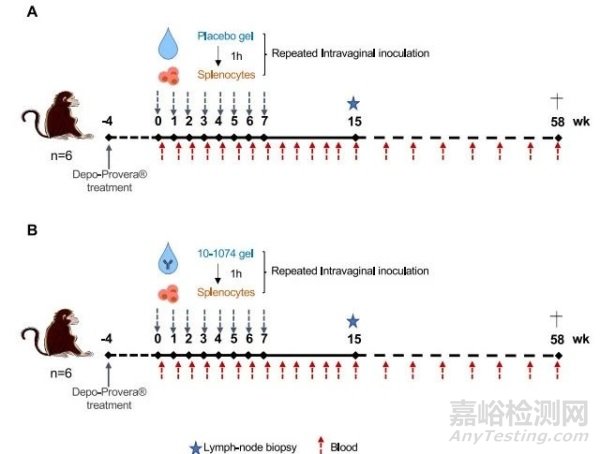
在阴道研究中,本研究对去羟孕酮预处理的雌性中胚层细胞每周阴道涂抹 2 mL 不含抗体的 HEC 凝胶(安慰剂凝胶,n = 6)或 5 mg/g 的 10-1074 bNAb(10-1074-凝胶,n = 6)。本研究能够确保阴道穹隆完全吸收 HEC 凝胶,因为本研究在以前的保护研究中成功使用过 HEC 凝胶,因此不存在安全问题。一小时后,动物阴道内暴露于 107 个受 SHIV162P3 感染的脾脏细胞。实验设计如图 3 所示。每次测试均使用来自两个供体的混合脾脏细胞(比例为 1:1)。
图3 保护性研究的实验设计
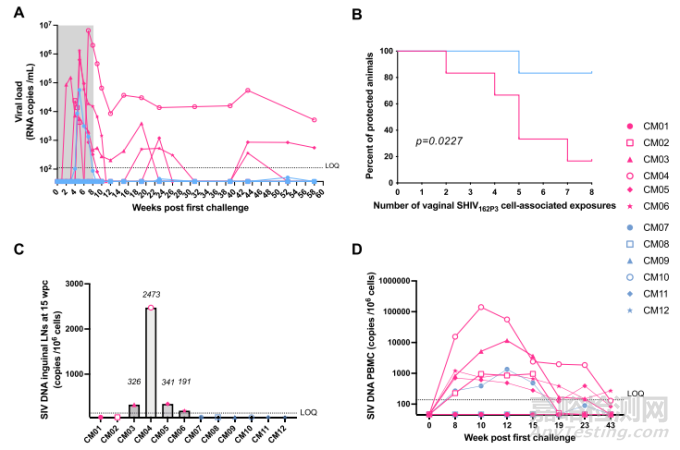
在接受安慰剂凝胶治疗的六只动物中,除一只(CM01)外,其他动物在接受两到七次挑战后都显示出较高的病毒滴度,而在接受 10-1074 凝胶治疗的六只动物中,有五只在接受八次挑战后完全受到保护(图 4)。Kaplan-Meier 分析显示,10-1074 治疗组与对照组相比有显著差异(80% 的保护率,p = 0.0227,图 4B)。在抗体处理组中,五只受保护的动物在整个研究过程中均未检测到病毒血症。猕猴 CM07 是在五次挑战后感染的,考虑到 vRNA 峰值和第 1-15 周之间的病毒血症曲线下面积(AUC),它的病毒血症低于感染的对照组动物。该动物的病毒载量在第 10 周检测不到,此后一直低于定量下限(LOQ,111 拷贝/毫升),直到研究结束。然而,在 CM02 对照组动物中也观察到了类似的 AUC。此外,本研究还证实,在第一次挑战后第 15 周采集的淋巴结中(图 4C)和随访研究期间采集的 PBMC 中(图 4D),没有一只受保护动物检测到 SIV Gag DNA。在猕猴 CM04 的淋巴结和 PBMC 中检测到的 SIV DNA 整合量较高,其血液中的病毒血症峰值也最高(图 4C 和 D)。
图4 10-1074 HEC凝胶在反复阴道SHIV162P3细胞相关挑战中的保护作用
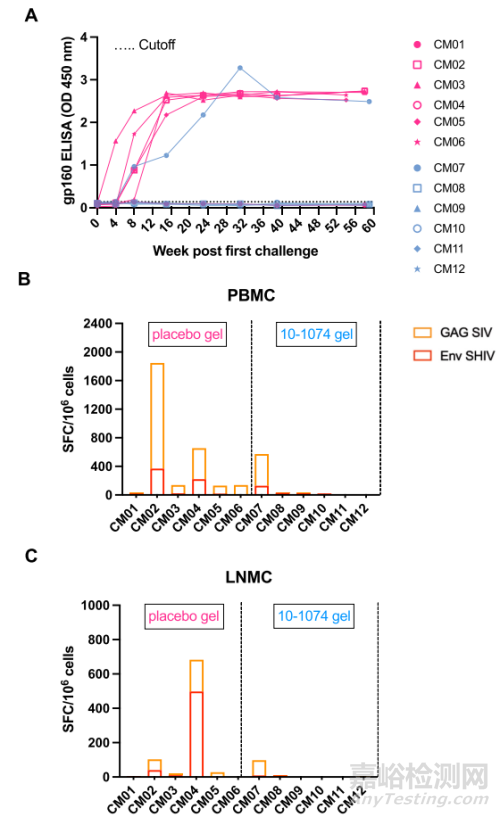
为了评估治疗动物和对照组动物适应性免疫的发展情况,本研究在随访期间测定了血清中的Env结合IgG滴度,并在动物安乐死时测定了T细胞对Env和Gag的反应。用 10-1074 HEC 凝胶治疗的五只受保护动物以及 CM01 对照组动物在整个研究期间血清仍为阴性,而所有可检测到病毒血症的动物在第一次挑战后 4 到 8 周内都产生了抗 Env 特异性抗体(图 5A)。T细胞反应很弱,但只有在病毒血症动物中才能检测到,包括用安慰剂凝胶治疗的5只动物和用10-1074凝胶治疗的动物CM07(图5B和C)。这些数据表明,在该模型中,SHIV162P3 细胞相关感染可促进 B 细胞和 T 细胞反应。
图5 10-1074 抗体治疗不能调节获得性免疫
2. 总结与展望
对 VRC01 预防 HIV-1 感染能力的 AMP 研究表明,体内 bNAbs 的浓度可能需要比体外敏感性研究显示的更高。有理由认为,体外研究无法完全预测对人体的疗效,至少部分原因可能是细胞相关传播被忽视了,而体外研究和临床前模型并没有对细胞相关传播进行系统评估。据观察,与通过无细胞病毒感染相比,在 HIV-1 通过细胞间接触传播时,抗体的有效性通常会降低。这种现象可能是由于包膜蛋白在病毒和细胞表面的构象或可及性不同造成的。bNAb 免疫疗法的一个主要障碍是细胞相关病毒逃避抗体中和的能力。本研究为 10-1074 在非人灵长类动物中控制细胞相关 HIV-1 传播的有效性提供了强有力的证据,并支持正在进行的 bNAbs 开发和评估,可将其作为治疗 HIV 感染者的一种选择。此外,本研究结果还强调了评估针对细胞相关病毒的被动免疫方法疗效的重要性,这也是开发 HIV-1 预防性疫苗的一个重要考虑因素。
文章来源:https://doi.org/10.1038/s41467-023-41966-4