您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-10-25 09:12
搭建药品研发质量管理体系,各企业可以根据各自的业务范围、业务类型、产品类型、产品研究阶段等建立适宜的研发质量管理体系;另外,关于研发质量体系的管理范围,各企业也是各不相同,有的企业只涉及立项到技术转移至车间这个阶段,即立项到试生产,有的企业研发还有符合GMP条件的中试车间,就涉及立项、产品开发、技术转移、中试车间管理、临床样品生产等;本人就第二种情况在搭建研发质量管理体系的思路、原则、过程等概述一二,以供大家参考。
|
分类 |
内容 |
非GMP阶段 |
GMP-like阶段 |
GMP阶段 |
|
|
前期开发、小试 |
临床Ⅰ、临床Ⅱ |
临床Ⅲ、工艺验证 |
|||
|
质量管理 |
文件管理 |
实验记录和辅助记录受控发放,一般为记录本 |
Ⅰ期推荐使用批记录;Ⅱ期使用经批准的文件和记录,受控发放 |
批准的文件和记录,受控发放 |
|
|
供应商管理 |
资质 |
基本信息确认,收集各种票证 |
文件审计,高风险的现场审计 |
合格供应商管理,合格供应商才可使用 |
|
|
质量协议 |
非必须 |
关键物料质量协议 |
必须 |
||
|
变更管理 |
分级 |
不需要 |
按GMP要求(关键、主要、微小) |
||
|
控制 |
记录 |
工艺、质量标准、检验方法及影响IND变化的发起变更,其他的记录 |
发起变更,变更评估应有对患者安全和IND申报的影响 |
||
|
偏差 |
分级 |
不需要 |
按GMP要求分级,评估影响 |
||
|
调查 |
记录 |
影响产品质量和患者安全的偏差详细调查,其他的适当调查 |
|||
|
内审 |
不需要 |
不强制 |
进行内审,频率可比商业化低 |
||
|
物料管理 |
物料管理 |
物料放行 |
无需质量放行 |
鉴别+关键属性 |
原材料、辅料及内包材应全检,完成鉴别+关键属性后可条件放行 |
|
物料存储 |
独立仓库或分区域存储,受控的标识 |
||||
|
确认与验证 |
无菌验证 |
毒理批非人体使用,不做无菌要求 |
人员更衣、过滤器、灭菌柜、隧道烘箱等按商业化要求 |
按商业化生产阶段要求 |
|
|
库房或储存冰箱等的验证 |
适当的监控 |
冰箱温度分布验证,24小时温湿度监测,并有报警装置 |
温度分布验证,24小时温湿度监测,并有报警装置 |
||
|
运输验证 |
进行温度监测和记录 |
进行温度监测和记录 |
执行运输验证 |
||
|
清洁验证 |
清洁程序开发和初步确认 |
实施清洁确认,不用清洁验证 |
清洁验证(连续3批) |
||
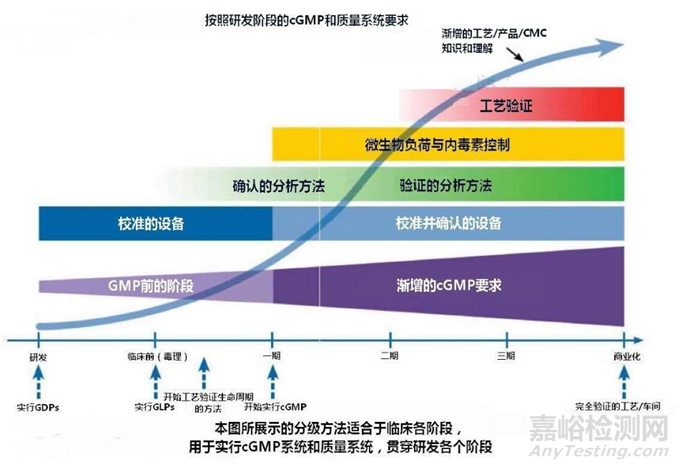
知道了药品研发质量管理体系的“是什么”,明白了“为什么”,并理解了药品研发质量管理体系重要关注点、与GMP的区别和联系,就要进行 “怎么做”的工作。可基于企业的业务范围、产品类型、产品研发阶段、组织架构,把研发质量体系模块化,结合ICHQ10、FDA六大系统等建立。
|
阶段 |
内容 |
|
Step 1:策划 |
准备:资源配置、熟悉法规要求、统一内部认识等
设计:了解企业业务范围、产品类型,明确组织架构和职责权限,制定质量方针、质量目标、质量计划,确定质量体系类型和结构等 |
|
Step 2:实施 |
确定文件体系的编写计划,组织落实,按计划起草、审批、培训、发布、运行体系文件 |
|
Step 3:检查 |
监控、检查考核(自检、管理评审等) |
|
Step 4:改进 |
问题分析、持续改进 |
一、策划阶段
|
输入 |
过程 |
输出 |
|
企业特点 |
确定企业业务范围和类型:研发型、生产型、综合型、CRO、CDMO等 |
企业情况 |
|
产品特点 |
确定研究产品的类型、研究阶段 |
产品情况 |
|
组织架构 |
确定设立的部门、岗位 |
组织架构文件 |
|
职责 |
确定各部门、各岗位职责,定岗定责 |
职责文件 |
|
管理层承诺 |
高层管理者、各级管理层的作用、职责和职权 |
职责文件 |
|
质量方针 |
高级管理者主持、制定,质量承诺,必要时调整 |
方针文件 |
|
质量目标、计划 |
明确的目标、具体的行动计划、明确的考察内容和衡量标准 |
目标文件 |
|
资源配置 |
必要的厂房、设 施、设备、技术和人员、培训 |
资源情况 |
|
体系架构 |
质量体系的架构、框架 |
架构文件 |
|
信息沟通机制 |
有效的内部信息流通机制,及时、准确无误传递信息 |
各管理文件中规定 |
|
管理评审 |
方式、内容、时间和频率,产品、体系的现状、问题和趋势 |
评审文件 |
二、实施阶段
|
分类 |
文件类别 |
文件级别 |
备注 |
|
标准类 |
质量手册 |
一级 |
纲领性文件、管理活动的框架、最基本的原则 |
|
管理标准 |
二级 |
产品全生命周期涉及的所有管理规程 |
|
|
技术标准 |
二级 |
质量标准、工艺规程等 |
|
|
操作标准 |
三级 |
设备、仪器、检验等工作的标准操作规程及岗位职责 |
|
|
记录类 |
记录 |
四级 |
实验记录、台帐、卡、单、标识、凭证等 |
|
模块 |
名称 |
|
质量手册 |
|
|
机构人员 |
组织机构管理规定 |
|
培训、考核管理规定 |
|
|
人员健康防护管理规定 |
|
|
质量管理 |
文件系统管理规定 |
|
偏差管理规定 |
|
|
变更管理规定 |
|
|
CAPA管理规定 |
|
|
质量风险管理规定 |
|
|
中试管理规定 |
|
|
自检管理规定 |
|
|
外部检查应对管理规定 |
|
|
文件管理规程 |
|
|
试验记录管理规程 |
|
|
实验室管理 |
分析方法开发管理规程 |
|
检验和报告管理规程 |
|
|
OOS、OOT管理规程 |
|
|
试剂试药管理规程 |
|
|
分析方法确认、验证管理规程 |
|
|
生产管理 |
生产计划管理规程 |
|
生产指令管理规程 |
|
|
生产区工作服、进出管理规程 |
|
|
设施设备管理 |
厂房设施管理规程 |
|
公用设施设备管理规程 |
|
|
物料管理 |
物料采购管理规定 |
|
物料接收、入库、储存和发放管理规程 |
|
|
注册管理 |
申报资料编写、检查、确认及整理操作规程 |
三、检查阶段
四、改进阶段

来源:注册圈


