一、研究背景
天然细胞外基质由多种蛋白质组成,具有相互连接的分层结构,是引导组织组装的理想材料。然而,这些基质的体外使用受到批次间变异性和免疫原性问题的影响。因此,发现合成替代品仍然是细胞生物学家和组织工程师的主要目标。为了实现这一目标,由自组装合成肽组成的水凝胶因起始材料的一致性、合成的简易性、生物可降解性和低细胞毒性而受到广泛关注。这些合成水凝胶的设计目的是形成肽纳米纤维的纠缠网络,模拟天然基质的结构特征,包括网眼尺寸、孔径和纳米纤维结构。
新的肽水凝胶支架通常是通过对超短疏水肽(2-5 个残基)进行官能化而设计的,这些肽具有大的 N-末端封端基团,可通过活塞堆积相互作用促进自组装。肽两亲性化合物是另一类凝胶剂,依靠疏水和亲水结构域的排列来驱动自组装。自互补离子凝胶剂通常由较长的多肽(8-16 个残基)组成,其带电氨基酸交替排列,通过静电作用进行自组装。另一种方法是合理设计肽序列,模仿天然存在的二级蛋白质结构,如α螺旋或β薄片。尽管对超分子肽组装进行了广泛的研究,但发现新的水凝胶剂的动力往往来自偶然性或对已有凝胶剂序列的排列组合。
色氨酸拉链(Trpzip)是一种相对尚未开发的组装基序。该基序的特点是四个交叉链色氨酸残基通过吲哚环相互锁定,将多肽折叠成β发夹构象。由于这种高度稳定的拉链效应,Trpzip 肽可以形成短至 12 个氨基酸的β发夹。这比以前报道过的β-发夹水凝胶剂(如 MAX 肽)要短得多,后者依靠四肽(-VDPPT-)单元和较长的序列(>20 个氨基酸)来维持折叠发夹结构。以前的工作表明色氨酸有望成为自组装水凝胶的构件;然而,这些系统仍然依赖于结合使用其他非天然疏水分子(如苯或萘残基)或常规的肽凝胶基团(如二苯基丙氨酸)来帮助驱动凝胶化。虽然 Trpzip 序列仅在数周内就能组装成纳米纤维,但其作为一种新的自组装结构基序的潜力是显而易见的。不过,Trpzip 肽基序尚未用于形成水凝胶。
二、研究成果
在这项工作中,新南威尔士大学Kristopher A. Kilian教授团队利用分子动力学模拟设计了一种基于 Trpzip 基序的多肽水凝胶剂。他们的 Trpzip 肽能在几分钟内分层组装,首先形成长纳米纤维,然后组装成具有周期性结构的微尺度结构域。由此产生的水凝胶显示出具有可调模量、自愈合和应力松弛特性的热膨胀性凝胶,即使没有细胞粘附基序,也能保持细胞活力和扩散性,并具有抗菌活性。添加短粘附肽对水凝胶的机械特性影响极小,而添加细胞外基质蛋白(如层粘连蛋白)则可培养成体干细胞和诱导多能干细胞衍生的肠器官组织。该材料的低屈服应变有利于在剪切力作用下快速流化,提供了一种简单的机制来回收嵌入的细胞和组织,并通过注射器分散含有细胞的 Trpzip 凝胶,从而实现细胞递送和生物打印应用。相关研究工作以“Hierarchical assembly of tryptophan zipper peptides into stress-relaxing bioactive hydrogels”为题发表在国际顶级期刊《Nature Communications》上。祝贺!
三、图文速递
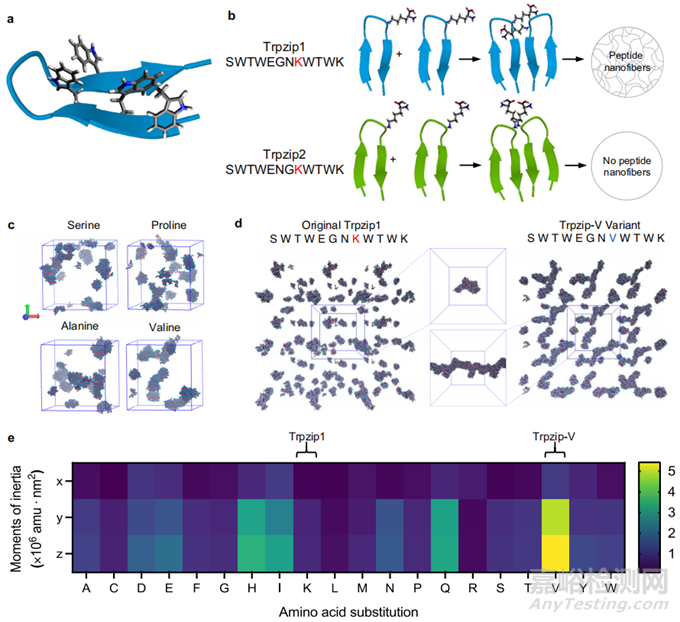
图1. 通过粗粒度分子动力学模拟识别易发生纳米纤维聚集的 Trpzip 序列
Trpzip 肽基序能够合成迄今为止报道的最短β发夹(图 1a)。Trpzip 肽的设计初衷是为了研究蛋白质折叠的热力学,但事实证明,Trpzip 肽序列的微小变化就能极大地改变聚集和纳米纤维的形成(图 1b)。
他们对所有二十种 Trpzip1 肽变体进行了 MD 模拟,并对每次模拟的最后一帧进行了目测评估(图 1c)。通过从每次模拟中提取最大的多肽聚合体并将它们排列在同一轴上来比较所有变体,他们发现与原始序列相比,缬氨酸取代的聚合模式差异最大(图 1d),他们将其命名为 Trpzip-V。量化所有 20 个变体的最大肽簇的惯性矩证实,缬氨酸取代的变体形成的大聚集体在形态上最具纤维性,而 Trpzip1 则形成小球形聚集体(图 1e)。
图2. Trpzip 水凝胶的合成、优化和表征
图3. Trpzip 水凝胶的力学特征
为了评估 Trpzip 水凝胶的机械特性,他们对不同肽浓度的凝胶进行了原位振荡平行板流变仪测试。Trpzip 水凝胶的硬度随肽含量的增加而增加,G'值范围为 1-60 kPa,所有凝胶在大约 12 小时后达到平衡储存模量(图 3a)。Trpzip 凝胶的凝胶化行为与温度有关,37 °C 时的硬度比 20 °C 时高十倍(图 3b)。令人惊讶的是,Trpzip 凝胶的屈服点出现在剪切应力约为 75 Pa 时(图 3c)。这与他们观察到的凝胶在中等压力下快速流化的现象一致。Trpzip 凝胶还表现出剪切稀化行为(图 3d),粘度与剪切率成正比线性下降,这表明它可能是挤压和生物制造的理想生物材料。由于其他肽水凝胶可以可逆地组装和分解其物理交联网络,他们对 Trpzip 凝胶进行了触变性测试,以确定它们在剪切后的自我修复和恢复速度。在 5%应变下暴露 5 分钟后,水凝胶会在剪切力停止后立即重新交联,并在一小时内恢复到初始硬度(图 3e)。
天然组织的一个重要方面是能够显示出应力松弛等非线性粘弹性特性,这对于分散组织扩张和形态形成过程中产生的细胞力至关重要。为了评估 Trpzip 凝胶是否具有类似的应力松弛曲线,他们进行了恒定剪切变形测量(图 3f),并将 Trpzip 凝胶(1% w/v)的应力松弛半衰期与天然基质 Matrigel 和聚乙二醇二甲基丙烯酸酯(PEG-DM)水凝胶进行了比较。不出所料,PEG-DM 因其共价交联网络而几乎没有应力松弛;然而,由于其动力学性质,Trpzip 凝胶显示出与 Matrigel 相似的应力松弛曲线。他们发现 Trpzip 凝胶的应力松弛半衰期(58.5 ± 0.4 秒)低于 Matrigel(87.1 ± 0.76 秒)(图 3g),但在其他天然基质的范围之内。天然材料的另一个重要方面是细胞粘附基序的存在。他们研究了在 Trpzip 水凝胶中添加层粘连蛋白衍生的 Ile-Lys-Val-Ala-Val (IKVAV) 粘连基序的效果。与纯 Trpzip 凝胶相比,将 Trpzip-IKVAV(200 μΜ)整合到 Trpzip 凝胶中不会导致硬度发生统计学意义上的显著变化(图 3h)。
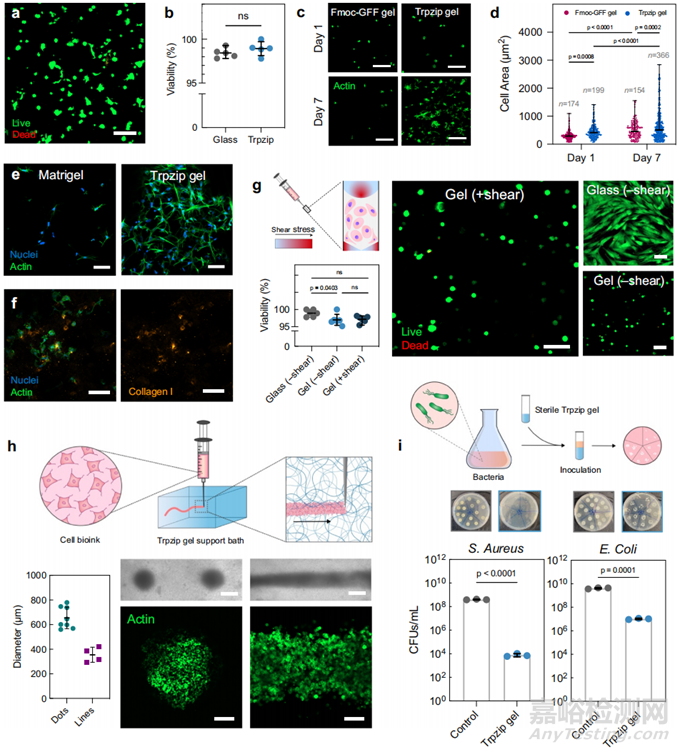
图4. Trpzip 水凝胶支持细胞生长、注射器挤压、生物制造,并具有抗菌特性
图5. 与 Matrigel 相比,在 Trpzip 水凝胶中培育成体干细胞衍生的肠器官组织
四、结论与展望
他们的工作展示了一种基于色氨酸拉链基序的多肽水凝胶,它能自组装成具有独特机械和生物特性的纳米和微结构材料。Trpzip 水凝胶很容易形成,无需严格的温度控制,这通常是天然基质所需要的。这种材料的模量可调,屈服应力低,是首例可改变粘弹性的材料,可通过简单的搅拌快速收获,从而直接实现生物功能。这将被证明对分子表征非常有益,因为分子表征通常需要以酶为媒介对周围基质进行侵入性溶解。同样,低屈服应力和自愈合特性为注射器挤压提供了一种方法,分层材料的流化可保护细胞免受剪切力的影响,从而应用于细胞输送和生物制造。考虑到这些水凝胶对哺乳动物细胞同时具有杀菌和生物活性,Trpzip 水凝胶在体外和体内作为治疗生物材料的应用前景十分广阔。
文献链接:https://www.nature.com/articles/s41467-023-41907-1