病毒很小,变异很快,每天都会复制成千上万个自己。更确切地说,是受感染的宿主细胞被挟持,成为产生这些新病毒拷贝的温床。病毒无法自行繁殖,它们处于惰性状态,直到侵入宿主细胞。
除了人体自身的免疫系统之外,抗病毒药物是人类对抗病毒入侵的最重要的武器。但肆虐全球数年的SARS-CoV-2病毒,让人类意识到了自身在对抗病毒时的困窘。其中一个很大的问题在于病毒没有很多属于它们自己的蛋白质和酶,可以作为药物开发的目标。病毒所拥有的少数蛋白和酶,也许只是在于执行最基本的功能,即允许病毒进入细胞、复制和逃逸,以及周而复始。即使如此,这些蛋白至的序列和结构在跨病毒,甚至同一类病毒中也可能大相径庭。所以,人类很难举一反三地使用一种治疗剂针对多种病毒。雪上加霜的是,由于缺乏可靠的动物模型和投资,抗病毒药物的开发显然面临严峻挑战。
为什么抗病毒药物难以开发?ACS旗下的C&EN做出了分析:
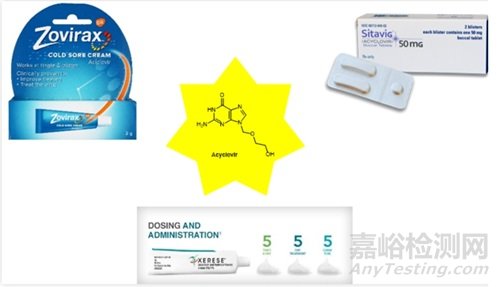
几十年来,科学家们并不知道病毒是否有自己的酶。研究人员假设,被劫持的细胞只是利用细胞自身的酶和蛋白质构建了病毒的新副本。1967年,科学家发现了第一种病毒酶,一种痘病毒DNA-依赖型RNA聚合酶[1]。该酶采用病毒的DNA编码基因组并将其转录为RNA,以开始生产新的病毒蛋白。在科学家确定了这些第一种病毒酶之后,他们就意识到他们可以设计针对病毒本身的药物,但这个过程进展得非常缓慢。抗病毒药物的开发一直落后于抗生素药物的开发。除了针对疣和类似疾病的局部治疗外,在acyclovir(阿昔洛韦,商品名:Sitavig, Xerese, Zovirax,如图1)出现之前,抗病毒药物的开发可谓举步维艰。
图1. Acylovir化学结构
阿昔洛韦用于治疗单纯疱疹病毒感染、水痘和带状疱疹。该药物于1974年获得专利,并于80年代首次获准使用。
由于病毒胸苷激酶的作用,阿昔洛韦成为单磷酸阿昔洛韦。阿昔洛韦单磷酸通过鸟苷酸激酶转化为二磷酸形式。随后,阿昔洛韦二磷酸通过核苷二磷酸激酶等生化反应,转化为三磷酸阿昔洛韦[2]。三磷酸阿昔洛韦对病毒DNA聚合酶的亲和力高于正常细胞的DNA聚合酶,并结合到DNA中,缺失的2'和3'碳会导致DNA链终止[3]。阿昔洛韦三磷酸与病毒DNA聚合酶的竞争非常激烈,以至于其他碱基无法与该酶结合,从而使其失活。
与早期的抗病毒药物不同,阿昔洛韦可以完全抑制病毒DNA聚合酶,而不会阻止细胞自身的酶,这意味着它几乎不会引起主要副作用。从那以后,研究人员一直在尝试采用类似的方法,直接靶向病毒蛋白。
宿主细胞感染和病毒复制的每个阶段都给抗病毒药物提供了机会。但是由于病毒仅编码其自身的几种蛋白质,因此药物可能只能靶向一种或两种蛋白质。这些病毒酶可能具有宿主细胞也具有的功能,因此靶向这些与人类蛋白相似的病毒酶,有良莠不分地无差别伤害健康人体细胞的可能性。这是抗病毒药物开发的另一个难点。
尽管如此,多年来药物开发人员已经找到了安全靶向几种关键病毒蛋白的方法,直接针对病毒蛋白,是面对新病毒威胁时的首选方案,尤其是那些负责DNA和RNA复制的聚合酶,因为这些病毒聚合酶在几种病毒中通常很相似,这为开发广谱抗病毒药物提供了机会。
除了聚合酶之外,一些病毒用来将RNA转化为DNA的逆转录酶(reverse transcriptases)一直是抗HIV的主要目标。在细胞中负责切割病毒蛋白的蛋白酶(proteases)也一直是慢性感染(如HIV感染和丙型肝炎)和急性感染(如SARS-CoV-2)的靶标。
广谱抗病毒药物开发之后,研究人员在大多数情况下只得让药物靶向特定病毒中的特定蛋白质。但换个角度来看这个无奈之举,靶向特定的病毒酶可以降低宿主酶受影响的风险,从而使药物更安全。
与直接针对病毒开发抗病毒药物形成正交策略的是,一些药物开发商将他们的准星瞄准了宿主细胞,这种策略理论上可以产生对整个病毒家族有效的药物。如果人们能够影响宿主细胞,那么在某种程度上,病毒的身份和行为将变得不那么重要。这也算得上是“以我为主”的对敌策略了。这种方法使药物更加灵活,而且病毒不太可能产生耐药性。但是专注于宿主细胞同样不可能万无一失,产生重大副作用的风险就更高。
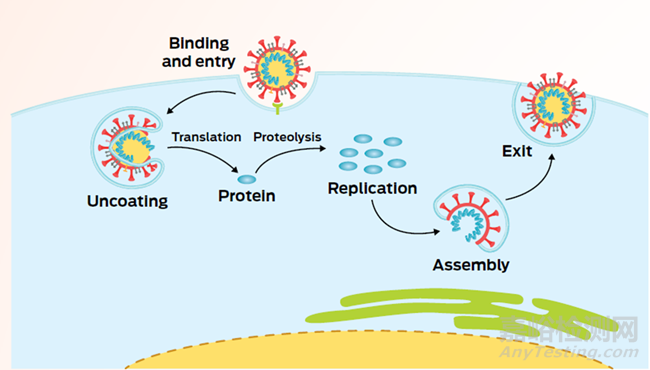
抗病毒药物发现的挑战不仅限于设计一种好的抑制剂。下一步是证明这种药物有效,首先是在细胞中,然后是动物,最后是人类。但是细胞和动物模型与人体的差异,可能会给病毒研究创造新的障碍。例如,研究人员多年来一直在努力让丙型肝炎在实验室的细胞中复制,这使他们能够研究破坏单个蛋白质如何影响病毒的生命周期。一旦药物在培养皿中的细胞阻止了病毒,科学家们就需要在可靠的动物模型中对其进行测试,以提供生理相关的结果。药物可以设计成在病毒进入和离开细胞之间的许多时间点,中断病毒的生命周期(图2)。
图2. 病毒感染宿主细胞以及复制的生命周期,来源:Nat. Rev. Microbiol.
每种病毒都使用细胞蛋白并影响下游的细胞过程,这种复杂性并不总是能在动物中模仿。例如,Gilead Sciences的瑞德西韦 (remdesivir,图3) 在小动物模型和非人类灵长类动物中对埃博拉病毒效果很好,但它在人类身上效果不佳[4]。
图3. Remdesivir化学结构
缺乏好的模型也是抗病毒药物开发的绊脚石。例如,RSV(呼吸道合胞病毒)的小鼠和大鼠模型的预测性不强。被辉瑞收购的ReViral,在人类挑战模型中测试了他们的化合物。在该模型中,健康人被故意感染RSV。这是一种人为的情况,但它很好地验证了药物在临床上的作用。很显然,这种策略并不能推而广之地用于所有病毒研究。
尽管生物学本身制造的问题,使抗病毒药物的开发变得棘手,但过去50年的研究表明,正确的激励措施可以推动创新。例如,数十年来在理解和开发HIV和AIDS药物方面的投资,极大地推动了抗病毒药物领域的发展。同样,筚路蓝缕的开发道路改变了丙型肝炎患者的治疗前景,过去治疗丙型肝炎需要近一年的药物治疗,而且副作用很大。现在相对较短疗程的药片就可以治愈它。
但是我们要知道,艾滋病和丙型肝炎都是慢性疾病,在全球范围内影响着大量人群。这些因素为能够开发新的更优治疗方法的制药公司,创造了一个巨大的市场。天下熙熙,皆为利来。利益的趋势,可以激发企业开发这些热门病毒疾病的相应药物。然而对于急性病毒感染,需要在被感染后立即服用抗病毒药物。这个狭窄的治疗窗口可能会缩小药物市场,因为病毒可能(必然)会影响世界上可能没有足够资金支付昂贵药物的落后地区。虽然公共资金可以帮助填补空白,但许多投资者的兴趣也譬如朝露。
Covid-19的大流行,让全世界都在考虑如何以不同的方式进行抗病毒药物的开发。由于缺乏针对Covid-19的治疗选择,人们意识到需要新的抗病毒药物。在度过了这场危机之后,科学界以及产业界有可能会迎来一个对于抗病毒药物开发的突破局面。去日苦多,来日方长。紧随人类的每一次苦难,都应该是人类的又一次进步。
参考资料:
[1] Kates, J. R. et al. Poxvirus DNA-dependent RNA polymerase. PNAS. 1967, 58, 134-141.
[2] Miller, W. H. et al. Phosphorylation of acyclovir diphosphate by cellular enzymes. Biochem Pharmacol. 1982, 31, 3879-3884.
[3] King, D. H. History, pharmacokinetics, and pharmacology of acyclovir. J Am Acad Dermatol. 1988, 18, 176-179.
[4]Warren, T. K. et al. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys. Nature. 2016, 531, 381–385.
[General] Howes, L. Why are antivirals so hard to develop? C&EN. Discovery Report. Q3, 2021.