导语:本篇内容为学习总结,源自审评三部刘文博老师关于《医疗器械生物学评价的技术审评考量》在器审中心学习云课程的讲座。内容主要涵盖四个方面:生物相容性风险、现行法规标准、生物学评价技术审评基本要求及常见问题分析。首先,介绍了生物学相容性相关概念及其潜在风险,并对现行法规标准(GB/T16886)进行了概述。重点讲解了生物学评价的三大路径,同时强调生物学评价并非仅在注册阶段进行,而是在产品设计开发阶段需结合风险管理开展。详细解析了生物学评价技术审评的基本要求(即 121 文件的具体要求)。最后,作者根据列举的生物学评价常见问题进行了归纳和总结,为大家提供一些参考。
第一部分:生物相容性风险
首先生物相容性概念,按照我国新版标准 GB/T 16886.1-2022,生物相容性是指医疗器械或材料在特定应用中具有适宜宿主反应的能力。
当医疗器械植入到人体以后,它的作用是相互的,一方面是材料或者是器械对于人体组织会产生一些反应(分为组织反应、血液反应以及免疫反应);同时器械植入人体以后,本身也会发生一些变化(比如:那个髋关节假体磨损,还有植物的表面形态影响和变化,还有一些像可吸收材料可吸收缝线等材料降解,金属材料腐蚀,还有像心脏瓣膜等会有一些钙化的现象)。
那我们要从两个方面进行评价,一方面是对人体对材料的影响,另外方面就是评价一下它和组织相容性。
刘老师通过两个案例,法国 PIP 公司乳房植入体案例(2010法国P IP公司使用了工业级的硅胶生产乳房植入物,导致不良反应最后产品召回公司破产)和天津眼用全氟丙烷气体案例(2015年天津一家公司生产的眼用全氟丙烷气体因生产中含有杂质导致“含量”不符合产品标准要求引起的群体性不良事件),阐述了生物相容性问题可能带来的风险。
通过这两个案例我们得知当医疗器械存在生物相容性的问题,可能产生危害。最后刘老师,强调了生物学评价的定位:生物学评价它是在风险管理过程范畴中的活动,它是作为医疗器械总体评价和开发过程组成的部分。
在医疗器械制备初期,生物学评价至关重要,而不仅仅在注册申报前才予以考虑。在选择材料时,需确保其对人体无毒,生产工艺设定时也要考虑去除杂质,并对去除工艺进行验证。此外,在临床实验前,医疗机构的伦理委员会会对医疗器械的生物学评价进行审查。
第二部分:生物学评价的规章、标准和技术指南
该部分主要介绍了医疗器械相关的规章、技术文件以及生物学评价的要求。整体介绍了注册资料中生物学评价的撰写要求解析,以及生物学评价路径进行了详细介绍。
首先,NMPA发布的《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2021年第121号)(以下简称121 号文,微信公众号回复 注册申报 即可获得)详细阐述了医疗器械注册申报资料要求和批准证明文件格式,其中包括生物学特性研究及评价的资料。其次,GB/T 16886 系列标准(由ISO 10993系列标准基本上是等同转化的,共19个)针对医疗器械生物学评价,同时还有一些行业标准作为参考(YY/T 0870遗传毒性和YY/T 1292生殖和发育毒性系列标准)。此外,《医疗器械已知可沥滤物测定方法验证及确认的注册技术审查指导原则》等技术审评指南文件也对生物学评价进行了规定。在具体类别的医疗器械技术审评指南中,也有生物学评价的相关内容。121 号文件的附件 5 进一步解析了生物学评价的基本要求。
除GB/T 16886 及行业标准外,刘老师也介绍了目前正在制定的一些文件,包括:
医疗器械未知可沥滤物评价方法建立及表征技术审查指导原则(征求意见稿)》制定中
《医疗器械生物学评价指导原则第1部分:总则(征求意见稿) 》制定中
《医疗器械生物学评价 第2部分:生物学试验 技术审评要点》制定中
《医疗器械生物学评价 第3部分:物理及化学表征 技术审评要点》制定中
第三部分:生物学评价技术审评基本要求解析
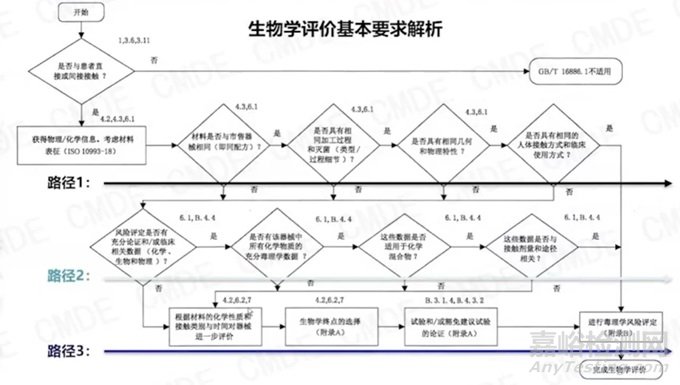
随后刘老师重点围绕121号附件5内容关于生物学特性研究的6条内容分别展开了详细的介绍。
1. 描述产品所用材料及与人体接触性质,设计和生产过程中可能引入的污染物和残留物,设计和生产过程中可能产生的析出物(包括滤沥物和/或蒸发物)、降解产物、加工残留物,与医疗器械直接接触的包装材料等相关信息
该部分主要介绍了医疗器械生物学评价中关于产品材料与人体接触性质、接触方式、接触时间和接触组织的分类。根据接触时间,医疗器械可分为短期(<24h)、长期(24h-30d)和持久接触(>30d)器械。按照接触方式和接触组织分类一般分为:不接触人体、表面器械(完好表面、损伤表面、黏膜)、外部接入器械(组织/骨/牙本质、血路,间接、循环血液)和植入器械(骨、组织、血液)。同时,内容还提到了生物学评价中需要注意的产品使用方式(比如说是否像隐形眼镜一样,它会有一个频繁更换累积使用的情况)、材料信息获取、供应商沟通等方面。
关于材料信息的获取方式,刘老师列举了如下几种方式:
材料化学名称和结构式 (IUPAC、CAS、 USAN名称及编号)
材料供应南提供的信息(材料组成成分配方、技术规范、可能引入的污染物和残留物、己有定性定量研究)
医疗器械的加工方、组件制造商提供的信息(加工助剂的使用情况及定性定量研究)
生物材料相关的国家、行业、国际标准
材料主文档(管理部门或第三方机构建立的材料控制文件Master File 及材料数据库)
器械制造商提供的信息(加工助剂残留物、可能 l入的污染物、可能产生的析出物及降解产物等)
初包装供应商提供的相关信息(包装生物学评价资料、安全性支持资料等)
因为某些材料可能是共混物或共聚物,虽然牌号可能固定,但成分仍相当多样。此时,我们可以请供应商提供具体信息和技术规范。此外,有些原材料供应商会对原材料进行生物学评价和实验,以评估其在生产过程中可能产生的污染物或残留物。他们是否进行了前期定性定量研究?如果供应商委托第三方进行医疗器械加工或某个程序的中间架构,可以由加工方提供的加工助剂使用情况和定量分析研究。
另外,如果器械使用的是生物材料,应明确相应的国家、行业或国际标准,并提供符合这些标准的证明文件。如果由于保密原因,原材料供应商不愿向医疗器械制造商透露技术秘密,可以由供应商向国家药监局登记原材料主文档,以便我们在审查医疗器械产品时获取原材料的更多信息。
此外,医疗器械制造商应对其生产产品的使用情况和助剂使用情况有深入了解,并在资料中如实反馈。对于液体类产品,我们主要关注初包装的生物相容性和安全性信息,这部分可以由包装供应商提供相关资料。
2 描述申报产品的物理和/或化学信息并考虑材料表征(如适用),如器械的物理作用可能产生生物学风险,应当进行评价
主要涉及医疗器械申报产品物理和化学信息的描述,以及材料表征的考虑。对于可能产生生物学风险的器械物理作用,需进行评价。
以下六种情况需要深入开展化学表征研究:
缺乏长期临床使用史的材料:提供更多化学信息研究数据。
成熟材料出现非预期结果:如碳金属制备植入器械在细胞毒性实验中出现阳性结果,需进行化学表征,找出原因。
器械材料在人体内发生变化:如骨水泥等,需考虑聚合和降解过程,提供相关研究资料。
已知毒性材料医疗器械:预期设计需使用已知有毒性材料,需进行深入表征研究。
新材料制备的医疗器械:在生产过程中使用新物质,需开展化学标准数据评价。
物理特性:如多孔材料、颗粒大小、形状和表面形态等,对生物相容性产生影响,尤其是局部植入反应、血栓形成和免疫刺激等。
案例方面,刘老师举例介绍了乳房植入相关的大细胞淋巴瘤,由于某特殊表面毛面假体发生率较高,与表面粗糙度有关。不同粗糙程度的乳房植入体表现出不同程度的慢性长期免疫反应。因此,在评估医疗器械生物学风险时,需关注物理和化学特性以及相关表征研究。
3.生物学评价的策略、依据和方法
任何预期用于人体的材料和器械,其评价都应遵循 YY/T 0316 标准,以确保在整个风险管理过程中对生物学评价的全面考虑。
具体的评价过程可以参考GB/T 16886.1 附录 B 中详细的评价过程和要求。同时,评价程序应按照 GB/T 16886.1 的评价流程图进行,以确保评价的准确性。需要注意的是,器械具有其特殊性,即使是同一企业的潜在产品,或者是新企业首次研发的产品,其评价过程也会有所不同。因此,评价应根据实际情况进行,并在注册申报时明确所参考的路线,并进行详细说明。对于各个具体终点的评价方法,可以参考相关系列标准的具体方法,以确保评价的全面和准确性。在注册申报时,需明确参考的评价路线并详细说明。针对具体评价方法,可参考相关系列标准。GB/T 16886.1 的图 1 展示了风险管理组成部分的医疗器械评价系统方法框图。
4.已有数据和结果的评价
121 号文和 2007 年的 345 号文件(《医疗器械生物学评价和审查指南》 微信公众号内回复 生物学指南 即可获得)要求提供已有数据和结果的评价,包括:
(1)国内外相关文献检索和评审:为生物学评价提供支撑性材料,如材料表征方法、毒理学评估等。
如:医疗器械材料表征数据及评估(科学及公认的表征方法有哪些? 毒理学阈值是多少?)、己经开展过的生物学试验(己有的该类产品或材料的生物学试验结果提示哪些潜在风险?)和临床使用信息(是否存在该类产品或材料生物相容性相关的不良事件情况?)
(2)医疗器械材料的表征数据和评估:关注产品中可萃取物质的系统分析,参考 GB/T 16886.18 中列举的化学表征方法(对于聚合物金属陶瓷还有天然大分子,它都列举了常见化学表征的方法,有数10种之多)。
这里刘老师采用茶包泡茶举了一个特别好理解的例子,我们评价的不单单是茶包,还要更要关注从茶包里边萃取出来的这些物质,就要对这些可萃取的物质来进行系统分析。
(3)已有生物学实验报告:
要求国内实验室具备 CMA 标识,国外实验室需符合 GLP 要求,并提供质量保证文件。实验过程中需参考生物学评价标准和临床使用信息。
(4)器械的临床使用信息和/或临床研究结论总结评价
考虑生物体内实验结果的差异,收集相关医疗器械临床数据;关注可能导致的不良反应,获取充足的临床信息。
鉴于材料在动物体内出现组织反应时,在人体内不一定出现同样的反应,且对于通过生物学试验己证实是最好的材料,由于人体间的差异,也会在某些人身上产生不良反应。因此,在医疗器械己经有临床评价数据的情况下,应当充分利用己获取的临床信息进行评价。医疗器械临床数据主要来自于:
国内外相关该医疗器械/材料的临床研究报道;
该医疗器械在上市前开展的医疗器械临床研究;
该医疗器械上市后从临床中获取的数据,包括医疗器械不良事件的报道和报告。
这些已有数据对医疗器械的生物学评价至关重要,有助于预测和预防潜在风险。在评价过程中,需遵循相关标准和规定,确保评价的准确性和全面性。
5.选择或豁免生物学试验的理由和论证
通过审查以下三个方面形成的文件,我们可以评估是否可以免除生物学实验:
第一方面涉及材料、化学、物理等同性以及毒理学等相关验证资料。对这些方面的评估有助于确保产品符合相关标准。
第二方面包括证明该类产品具有可论证的安全使用临床历史的相关文献资料。这些资料有助于证实产品在临床使用中的安全性。
第三方面关注申报产品与已上市产品在接触方式、制造和灭菌工艺方面是否具有等同性。对于存在差异的部分,需分析其是否会影响生物相容性,并提交相关分析证据。
通过对这三个方面的综合评估,我们可以明确是否豁免生物学实验,并确保产品符合医疗器械相关法规要求。
6.完成生物学评价所需的其他数据
该内容主要讲述了医疗器械生物学评价的相关规定和流程。其中,121 号文件提到了关于释放颗粒进入患者和使用者体内的影响,以及纳米材料纳米颗粒对人体影响的问题。在生物学评价过程中,需要关注材料的化学组成、比例、物理特性、工艺灭菌方法等方面。
评价流程可分为三个路径(由于整体内容较多,后续专门整理发文):
路径一为通过与国内市售器械毒理学等同性进行评价(一般是自家生产的上市产品对比,往往比其他家上市产品更具有可操作性和可实现性):中国已上市产品,材料(配方)包括组成成分及可沥滤物、加工过程和灭菌(考虑加工工艺引入物质及对终产品的影响)、几何和物理特性(表面形态、多孔结构、纵横比、厚度、纳米颗粒、亲疏水、溶胀、耐磨性等)、临床使用方式(如连续佩戴、使用前溶解等)等。
路径二为通过可沥滤物化学表征及毒理学分析进行评价,关注化学物质毒理数据来源和适用性。
路径三为通过生物学试验进行评价,需关注实验项目与器械总体设计相适应,预期接触人体的方式和时间,以及实验模型的选择等。具体可参考呕心沥血篇 | 浅谈医疗器械生物相容性评价。
第四部分:生物学评价的常见问题分析
刘老师详细介绍了生物学评价资料整体技术申评关注点,这里总结如下:
符合法规要求:是否符合121号文件以及相应的公告通知中对于生物学试验机构资质的要求。
符合GB/T 16886系列标准:评价流程是否按照GB/T 16886系列标准的要求进行,包括评价路径、理由等。
结合产品预期用途:生物学评价是否与产品的预期用途相结合,特别是在适用范围、预期人群(如儿童)、预期使用方式以及可能存在的累积接触等方面。
综合已有信息:生物学评价是否综合了已有的文献、以前生物学评价的经验以及其他临床前研究方面的信息,如化学表征、物理表面特性等。
评价报告完整性:生物学评价报告是否汇总了所有的数据和实验结果,以及是否考虑了潜在的毒性风险,并在开展研究时采取了一些其他措施,如降低浸提比例或进行稀释处理。
利用已有临床数据:在生物学评价过程中,是否充分利用了已有的临床评价数据来提高评价的质量。
在开展材料表征和毒理学分析时,需要特别关注那些可能存在潜在毒性的数据,以确保评价的准确性和完整性。
此外,刘老师特别强调了关于材料表征及毒理学分析评审关注要点,总结如下:
(1)材料表征的全面性:材料表征是否涵盖了主要材料成分以及提取出来的成分,确保能捕捉到器械中释放的所有化学物质。对新成分是否进行了必要的定性定量检测。
(2)化学表征的充分性:针对各类材料,在现有技术手段下,是否对所有目标化学物质进行了有针对性的测试,确保化学表征的充分性。
(3)检测方法的灵敏度:检测方法是否足够灵敏,以便捕捉到可能存在的潜在毒性。
(4)在进行等同性比较时,我们需要遵循毒理学等同性原则。当采用路径二,利用相关化学物质的毒理数据进行评估时,需要确保毒理数据的来源充分合理,并对每一种潜在毒性的化学物质都有充足的毒理学数据,以验证其在人体可接受的安全范围内。
(5)在排除颗粒物化学物质的存在或按照YY/T 0316 标准对化学成分进行安全使用评价并评估风险后,若得出可接受风险的结论,则可能无需再进行其他实验。
在采用路径三生物学试验进行生物学评价时,刘老师也介绍了生物学试验评审关注点,作者总结如下:
与产品设计相适应:生物学实验应与产品的总体设计和最终用途相匹配。在选择实验项目和终点时,要考虑产品的最终用途以及其在人体内的状态。例如,戊二醛保存的牛心包瓣膜在使用前需要清洗,因此在进行生物学实验时,要确保实验条件与实际使用情况一致。
预期接触方式和时间:根据产品预期与人体接触的方式和时间,选择相应的生物学评价终点。
实验项目的选择:并非表 A.1 中推荐的实验项目都要进行,要根据产品具体情况来选择。同时,有些表 A.1 未列出的实验项目(如辅助生殖用液、鼠培实验等)可能也需要进行。
实验条件应合理:实验模型、对照选择、观察时间、样本量、制备浸提方式等条件都应科学合理。如有国家或国际标准,应优先参考。若不适宜,需提供理由并可选替代方法,并提供相关验证资料。
使用代表性样品:在无菌最终产品或取自最终产品的代表性样品上进行实验。若无法使用终产品(如体积过大),需提供理由,并确保所用样品经过相同加工和灭菌方式。
考虑动物福利:在保证实验数据充足的前提下,尽量减少实验动物数量,以兼顾人类安全和动物福利。
多个组件及不同接触方式的评价:针对多个组件或不同接触方式,分别进行评价。实验报告应详细、完整,包括制样方法、实验细节、结果分析等。
生物学报告的完整性:可参考 GB/T 16886 系列标准及其他国家或行业标准,确保生物学报告的内容完整性。
通过以上关注点,确保生物学评价的准确性和合规性。
最后,刘老师介绍了9个常见的问题。这里不在一一列举具体的问题了,结合问题的类型和形式作者总结概括如下:
(1)前代产品生物学报告的利用:若前代产品为国内市售同类产品,且已证明等同性,则无需提供原有产品的生物学实验报告。但若前代产品未上市或存在不同之处,需提供相关生物学实验报告。
(2)生物学相容性影响因素:影响因素
产品材料化学组成、各组成材料比例、产品物理结构、表面特性、原材料供应商及技术规范、生产工艺、灭菌方法、内包装材料(如适用,主要涉及液体类产品、湿态保存产品)。在申报产品与本企业同类产品存在差异时,需考虑这些因素,并结合相关验证资料进行评价。
(3)不同生物学评价路径的选择:根据产品具体情况,选择合适的评价路径。有些项目可通过滤滤物表征和毒理学分析充分评价,而有些项目需要考虑表面形态等因素。
(4)重新进行生物学评价的情况:如原材料来源改变,需重新进行生物学评价。但并非所有情况下都需要全套重新做实验,而是要根据变化引起的潜在风险来判断。(微信公众号内 回复材料变化,可获得详细的指南性文件)。
(5)细胞毒性异常问题:对于含药器械、生物活性材料器械和含铜工业节育器等产品,需关注其细胞毒性。如有阳性结果,需结合已有文献和研究来确定导致细胞毒性的成分,并进一步评价。
(6)毒理学分析数据涵盖性:无可观察到不良反应水平剂量(NOAEL)和最低可观察到不良反应水平剂量(LOAEL)数据应源于与所研究终点相关的研究。例如,源手全身毒性研究的NOAEL和LOAEL通常可用于豁免进行急性、亚慢性或长期全身毒性试验,但是可能与遗传毒性,局部和全身致癌性、致致敏.刺激或生殖毒性评价无关(如果在选择用于确立NOAEL或
LOAEL的研究中未对这些终点进行评价);对于局部植入反应、血栓形成等生物学评价项目,器械的物理结构、表面特性等对结果影响较大,无法完全依靠可沥滤物毒理学分析方法完成评价。
(7)委托单生物学试验机构资质:目前要求市国内的实验室CMA的标识,并且在其承检范围内来开展相关的实验;国外实验室则需要GLP。
最后刘老师强调生物学评价贯穿整个研发过程:在设计变更、原材料供应商更改等情况下,都需要重新进行生物学评价。同时也总结了在生物学评价中,企业面临的挑战包括:
风险瓶理念未形成:部分企业仅关注实验结果,而忽略生物学评价贯穿整个研发过程的重要性。
生物学评价依赖实验:实验耗时耗力,涉及动物处理伦理,且有些实验条件较难实现。
新材料、新技术、新工艺的涌现:为生物相容性评价带来新挑战。
结束语:针对这些挑战,建议重视医疗器械的风险受益综合评价,减少对实验的依赖,充分利用已有的生物学评价资料。同时,开展规范的文献数据检索筛选,遵循检索剔除循证研究相关规则,针对不同类型的材料进行充分的物理化学表征,以支持非生物学实验方式的评价路径。