难溶性小分子药物由于其低溶解度、低生物利用度和配方挑战,通常会造成临床转化的障碍。据报道,市场上40%的药物和发现管道中90%的药物面临溶解度问题。由于药物难溶性问题的影响,所有潜在药物候选药物中有40%被搁置,造成了资源的严重浪费。纳米结晶作为一种配方简单(其配方简单源于纳米晶体完全由100%的药物或有效载荷(如表面活性剂)组成,从而消除了载体的辅助作用),增溶有效,生产工艺具有延展性,常常用于解决药物难溶性问题。
目前研发上市的纳米晶制剂的药物、上市公司、剂型、制备技术、适应症等相关信息如图1所示。上市纳米晶制剂多为口服制剂,且目前研发上市产品主要应用的制备技术是Top-down技术(湿法研磨、高压均质),由于仪器设备和生产工艺的限制,粒径多在200~800nm之间,粒径作为纳米晶的重要评价指标,其在纳米晶胃肠道吸收和体内分布等环节发挥非常重要的作用。纳米晶常用的稳定剂包括泊洛沙姆、吐温80、卵磷脂、纤维素衍生物、维生素E-TPGS和聚乙烯吡咯烷酮(PVP)等。
图1 FDA 批准上市和部分进入临床研究的纳米晶制剂(参考文献1)
如何去定义药物纳米晶?
药物纳米晶体的粒度大小在纳米的范围内,这表明其为晶体特征的纳米颗粒。有关于纳米颗粒定义的讨论,在胶体化学中,只有当颗粒的大小低于100nm甚至低于20nm时,才会将其视为纳米颗粒;在制药领域,基于大小单位,纳米颗粒的大小应定义为在几纳米到1000nm(=1μm)之间。因此,纳米颗粒的大小为1–1000μm。
药物纳米晶体由100%的药物组成,不包括聚合物材料。药物纳米晶体在液体介质中的分散制备成“纳米混悬液”。通常,分散的颗粒需要稳定,例如通过表面活性剂或聚合物作为稳定剂。分散介质可以是水、水溶液或非水介质(例如,液态聚乙二醇、油等)。
根据生产技术的不同,将药物微晶加工成药物纳米颗粒可能会产生结晶或无定形产品。从最严格的意义上讲,这种无定形药物纳米颗粒不应该被称为纳米晶体。
总之,药物纳米晶体更多的为尺寸大小在1–1000μm范围,具有晶体特性的纳米颗粒,其由于粒度较小,表面能较强,易于聚集,分散时需要借助稳定剂。
药物纳米晶体通过何种机制达到增溶效果?
a.比表面积增大,溶出速率增加
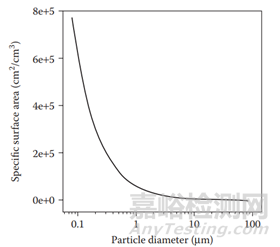
药物颗粒粒度,更准确的是药物颗粒的比表面积,是药物溶出过程中的重要因素。药物颗粒的比表面积与颗粒大小成反比(图2和图3)。溶出速率与颗粒比表面积成正比。大小减小导致比表面积增加,因此根据Noyes-Whitney方程,溶出速率增快。
其中dX/dt是溶出速率,A是比表面积,D是扩散系数,h是与溶解药物扩散层厚度,Cs是药物平衡溶解度,Xd是溶解固体的量,V是溶出介质的体积。
图 2 比表面积和粒度的函数关系(参考文献2)
图3 随着粒度的减小比表面积的增加(参考文献3)
因此,微粉化是成功提高药物生物利用度的合适方法,其中溶出速率是药物吸收限制步骤。通过从微粉化进一步降低药物的粒度-纳米化,颗粒的比表面积进一步增加,因此溶出速率也进一步增加。
其实,还有一条比较关键的信息需要格外的注意,高能冲击研磨和其他自上而下的颗粒尺寸减小技术可能会在晶格中(特别是在颗粒表面)造成小缺陷。这有望通过降低晶格中溶质-溶质相互作用强度对溶解度的限制来增加溶解度。在晶格中引入缺陷而发生明显变化,但稳定晶体的平衡溶解度保持不变。因此,药物纳米颗粒的快速溶出导致瞬时过饱和溶液的产生(相对于稳定晶体形式的溶解度),同时还可能导致重结晶的风险。
图4 不同制剂策略的萘普生口服给药后的血药浓度-时间曲线(<o>曲线为萘普生片剂;<à>曲线为萘普生混悬液;<ÿ>曲线为纳米晶混悬液)(参考文献2)
在人体临床试验中,萘普生纳米晶混悬液口服给药20min可达到显著的起作用的血药浓度(t90),比市场上大粒度药物产品作用时间快了12倍(图4)。
b.饱和溶解度的增加
教科书上的一般说法是,饱和溶解度Cs是一个常数,取决于化合物、溶出介质和温度。这适用于大小在微米范围或以上的日常生活粉末。然而,在1–2μm的临界大小以下,饱和溶解度也是颗粒大小的函数。事实上,奥斯特瓦尔德-弗伦德里希方程表明,在1μm以下(r=0.5μm)随着颗粒尺寸的减小,溶解度增加,影响变得显著:
其中Cs是饱和溶解度,C¥是由大颗粒组成的固体的溶解度,s是固体物质的界面张力,Vm是颗粒的摩尔体积,R是气体常数,T是绝对温度,r是固体的密度,r是颗粒半径。
因此,药物纳米晶体可以增加饱和溶解度。这有两个优点(图5):
1.基于Noyes-Whitney方程,药物溶出进一步提高;
2.由于饱和溶解度的增加,肠道和血液循环浓度差增加,从促进被动扩散吸收(涉及机理见Fick扩散第一定律)。
图5 药物溶解度和溶出对于其口服生物利用度的影响(参考文献2)
Fick扩散第一定律方程如下:
其中J是流量(通过单位截面的物质量),M是药物质量,A是表面积,t是时间,D是扩散系数,C1是肠腔一侧膜壁的药物浓度,C2是在血管一侧膜壁的药物浓度,h是膜厚度。
c.颗粒尺寸和形状对扩散层厚度的影响。
直径小于2μm的颗粒由于未固化扩散层厚度的减小而表现出更快的溶出速率。扩散层的尺寸由Prandtl方程描述,其中hH表示液体以恒定速度V流过的长度(直径)为L的颗粒周围的流体动力学边界层的厚度。k是常数:
Prandtl方程预测hH随着颗粒尺寸的减小而减小,并且根据Noyes-Whitney方程预测溶出速率的增加。Prandtl方程中流体在颗粒上流动的速度(V)取决于颗粒形状,在较小颗粒形状不规则且流体流动较慢的情况下,溶出速率会明显较慢。
图6 纳米晶药物递送系统增溶机理以及组成示意图(参考文献6)
总结:到2021,纳米晶药物产品估计占总纳米粒(NP)药物输送市场的60%。这一市场价值约为820亿美元。虽然纳米晶体技术因其易于配制、成分均匀和具有吸引力的药物经济价值而具有吸引力,而且也有潜力克服药物开发中的一些最大挑战。溶解度差可能导致生物利用度极差,从而影响药物的最佳递送。通过将难溶性药物配制成纳米晶体,由此产生的巨大的比表面积、饱和溶解度和溶出速率的增加可以确保大多数不溶性药物的生物利用度提高,在一定程度上,保证了提高难溶性药物的血液暴露情况,有希望解决难溶性药物递送的难题(图6)。
但是,我们仍需要看到纳米晶药物递送系统与常规制剂在理化性质以及随着而来生物药剂学性质上的差异,针对于其特殊的性质而进行研究和开发,以保证最终产品的安全性,有效性,稳定性以及可生产性。
参考文献
1.纳米晶技术增加难溶性药物的透膜性和跨膜转运的机理研究
2.Water-Insoluble Drug Formulation(book).
3 Nanocrystal technology, drug delivery and clinical applications
4.PHARMACEUTICAL AMORPHOUS SOLID DISPERSIONS
5. Nanocrystals: A perspective on translational research and clinical studies
6.Strategies to Address Low Drug Solubility in Discovery and Development.
7.A theoretical basis for a biopharmaceutic drug classification: the correlation of in vitro drug product dissolution and in vivo bioavailability.