今日头条
苏州勤浩SHP2抑制剂获批肺癌临床。勤浩医药1类化药GH21胶囊获国家药监局临床许可,拟联合甲磺酸奥希替尼片用于治疗伴有表皮生长因子受体(EGFR)突变的晚期非小细胞肺癌(NSCLC)。GH21是一款新型蛋白酪氨酸磷酸酶(SHP2)变构抑制剂,正在中美两地开展用于治疗晚期实体瘤的Ⅰ/Ⅱ期临床。已有研究数据显示,GH21具有良好的PK和安全性,同时在低剂量组已观察到初步疗效信号。
国内药讯
1.锦州奥鸿CDK4/6抑制剂报产。复星医药旗下奥鸿药业开发的CDK4/6抑制剂FCN-437c的上市申请获CDE受理,推测申报的适应症为“激素受体阳性/人表皮生长因子受体2阴性(HR+/HER2-)晚期乳腺癌”。公布于ASCO2022年会上Ⅰb期临床数据显示,FCN-437c的客观缓解率(ORR)为57.1%;6个月和12个月的PFS率分别为92.3%和83.5%,DOR率分别为100%和90%。此外,药物耐受性良好。
2.映恩HER2-ADC启动国际III期临床。映恩生物HER2 ADC药物DB-1303在中国登记启动一项III期临床(DYNASTY-Breast02),旨在评估DB-1303与研究者选择的化疗方案在接受内分泌治疗后出现疾病进展的HER2低表达、激素受体阳性转移性乳腺癌患者中有效性和安全性。这是一项国际Ⅲ期临床,中国部分的主要研究者由中国医学科学院肿瘤医院医学博士徐兵河和复旦大学附属肿瘤医院医学博士邵志敏共同担任。
3.安进长效多肽PDC在华获批减重临床。安进1类生物制品AMG 133获国家药监局临床试验默示许可,拟开发用于体重控制。AMG 133是一款GIPR/GLP-1R双抗多肽偶联(PDC)药物,目前正在Ⅱ期临床中评估用于超重或肥胖无糖尿病患者、超重或肥胖合并2型糖尿病患者减重的治疗效果。在I期临床中,与安慰剂相比,AMG 133(140mg和420mg)每四周给药一次可使患者体重显著下降(-7.2%和-14.5%,vs1.49%)。
4.AZ二代PRMT5抑制剂中国报IND。阿斯利康1类化药AZD3470薄膜衣片的临床试验申请获CDE受理。AZD3470是一款特异性靶向甲基硫代腺苷(MTA)和蛋白质精氨酸甲基转移酶5(PRMT5)复合物的二代PRMT5抑制剂,可减少一代PRMT5抑制剂的血液毒性等不良作用,提高治疗指数。在临床前研究中,AZD3470已在肺肿瘤异种移植模型中显示出积极的抗肿瘤活性。
5.海思科DPP-1抑制剂授权海外权益。海思科与意大利Chiesi公司就其临床期高选择性二肽基肽酶1(DPP-1)小分子抑制剂HSK31858签署许可协议,Chiesi将获得HSK31858在大中华区以外的全球开发、生产和商业化的独家权利。HSK31858临床拟用于治疗支气管扩张症及急性肺损伤/急性呼吸窘迫综合征引起的下呼吸道疾病。根据协议,海思科将获得首付款1300万美元,开发、监管和商业里程碑后期付款以及产品的销售提成。预计项目交易金额合计4.62亿美元。
国际药讯
1.长效PTH前药获批上市。Ascendis Pharma公司长效甲状旁腺激素(PTH)前药Yorvipath(palopegteriparatide)获欧盟委员会批准上市,用于治疗成人慢性甲状旁腺功能减退(HP)。在III期PaTHway研究中,与安慰剂组相比,Yorvipath治疗组实现不依赖常规治疗并保持血清钙水平在正常范围内(8.3–10.6 mg/dL)的患者比例更高(78.7%vs4.8%,p<0.0001)。就在上周,该公司在美国重新提交Yorvipath的新药申请,以及新的生产控制策略。
2.强生EGFR/c-MET双抗报sBLA。强生EGFR/c-Met双抗药物Rybrevant(amivantamab)向FDA递交补充生物制品许可申请(sBLA),与化疗(卡铂和培美曲塞)联用治疗EGFR ex19del或L858R突变、局部晚期或转移性非小细胞肺癌(NSCLC)经治患者。在Ⅲ期临床MARIPOSA-2中,与单独化疗相比,Rybrevant(伴和不伴lazertinib)和化疗两种方案均显著提高患者无进展生存期,将疾病进展或死亡的风险分别降低56%和52%。
3.施维雅IDH1/2抑制剂Ⅲ期临床积极。施维雅潜在“first-in-class”IDH1/2抑制剂vorasidenib治疗IDH突变型弥漫性胶质瘤的Ⅲ期临床INDIGO积极结果公布于SNO2023年会上。与安慰剂相比,vorasidenib治疗患者显著改善无进展生存期(中位PFS:27.7个月vs11.1个月);vorasidenib组患者每六个月肿瘤体积平均减少2.5%,而安慰剂组患者的肿瘤体积平均每六个月增加13.9%。该公司计划在年底向FDA提交vorasidenib新药申请。
4.新型放疗药物胶质瘤Ⅱ期临床积极。Plus公司可注射放疗药物186Re-obisbemeda治疗复发性胶质母细胞瘤(rGBM)的Ⅱ期临床ReSPECT-GBM结果积极。与贝伐珠单抗相比,186Re-obisbemeda治疗显著提高患者总生存期(mOS:13个月vs8个月),将死亡风险降低63%。两组患者中位无进展生存期(mPFS)分别为11个月和为4个月。此外,药物的总体安全性良好。
5.拜耳口服XIa抑制剂III期临床失败。拜耳宣布终止新型口服FXIa抑制剂Asundexian用于预防有卒中风险的房颤患者发生卒中或体循环栓塞的III期OCEANIC-AF研究。根据独立数据监测委员会(IDMC)评估,asundexian的疗效数据统计劣效于对照组(阿哌沙班)。不过,asundexian的安全性与已知研究一致。在II期临床中,Asundexian与阿哌沙班相比至少减少50%的出血事件。
6.百时美施贵BCMA CAR-T疗法sBLA被延迟审评。FDA延迟审查百时美施贵宝与2seventy bio开发的BCMA靶向CAR-T疗法Abecma用于治疗已接受免疫调节剂、蛋白酶体抑制剂和抗CD38单抗治疗的复发和难治性多发性骨髓瘤(MM)的补充生物制剂许可申请(sBLA)。在临床研究KarMMa-3中,在接受过2-4线的患者中,Abecma治疗较对照组使疾病进展或死亡风险降低51%(mPFS:13.3个月vs4.4个月)。目前FDA尚未确定ODAC会议时间,预计需提供OS数据。
医药热点
1.欧洲国家禁止Ozempic用于减肥。近日,由于糖尿病患者药物短缺,比利时(Belgium)宣布禁止将诺和诺德公司的糖尿病药物Ozempic用于减肥,德国正在考虑采取类似的行动。司美格鲁肽以治疗2型糖尿病的Ozempic和减肥的Wegovy的双品牌策略上市,但两者都有相同的活性成分,进而导致了广泛的标签外使用。诺和诺德11月10日在其网站上更新的一份声明中表示,预计“供应将持续中断”,并将限制低剂量的批发商向零售药店分销。
2.上海13家医院成为国际医疗旅游试点单位。11月16-18日,上海召开第四届海峡两岸国际医疗与特需服务发展大会,确定首批13家上海三甲综合医院和三级专科医院作为国际医疗旅游试点单位。该项目由复旦大学附属华山医院牵头,正在制定“国际医疗服务规范”上海市地方标准,填补国内该领域空白。预计到2025年,中国医疗旅游市场规模将达到3000亿元。
3.首都医学科学创新中心揭牌。11月9日,首都医学科学创新中心在首都医科大学正式揭牌,梅林教授受聘担任创新中心主任。创新中心将密切联合首都医科大学院系及学科特色明显的附属医院,充分挖掘和利用首都地区优质临床资源,致力于探索建立以医学为核心,以有目标、有组织科研为主的新型医学研究组织模式,建立促进基础研究和临床医学研究成果转化的平台体系,推动医学基础研究和转化医学研究相结合,建设世界高水平医药创新研发集群。
评审动态
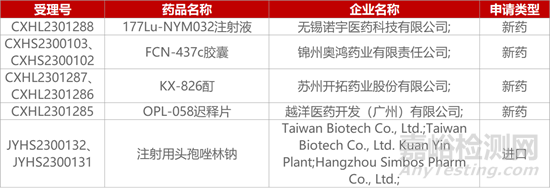
1. CDE新药受理情况(11月21日)
2. FDA新药获批情况(北美11月20日)