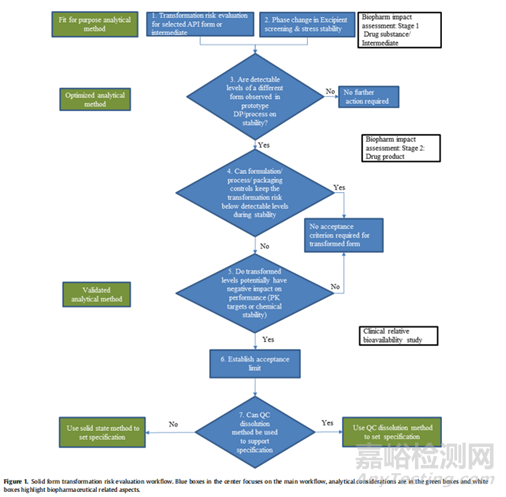
药物的多晶型是影响药物安全性和有效性的重要因素。多晶型药物的物理化学性质差异而可能导致药效的不同,这些不同一般表现在晶型的外观、溶解速率、溶解度、熔点、光学和电子学性质、蒸汽压和密度、溶出度、生物有效性等方面,从而影响了药物的稳定性、生物利用度及疗效。近些年来,药物的多晶型研究越来越受到医药研发与国家药监监管领域的关注与重视。在ICH Q6A文件决策树4(#1)~(#3)及2020版药典《药物晶型研究及晶型质量控制指导原则》均提供了与多晶型转化相关的指导原则,供研发人员参考借鉴。接下来我们就结合相关指导原则,再结合文献案例实际相关的研究工作情况深入了解指导原则的深刻意义。因本人经验不足,如有不当之处,还请指出,共同进步。
中国药典指出:当固体药物存在多晶型现象,且不同晶型状态对药品的有效性、安全性或质量可产生影响时,应对原料药物、固体制剂、半固体制剂、混悬剂等中的药用晶型物质状态进行定性或定量控制。药品的药用晶型应选择优势晶型,并保持制剂中晶型状态为优势晶型,以保证药品的有效性、安全性与质量可控。但是要如何始终如一的保持优势晶型,则需要研发人员要充分了解评估晶型转化是否存在风险,或者某种程度的转化是否可以接受,需要重点考虑以下因素,包括: 1)对晶型转化机理的深刻理解,从而可以制定控制策略;2)检测和量化晶型转化的能力; 3)预测和测试晶型转化对安全性和有效性的影响的能力,以证明晶型控制策略的合理性。
1.晶型转化机理的深刻研究与理解
1.1多晶型筛选及转化关系研究
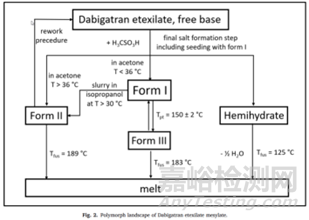
对所选的原料药的目标晶型要充分进行转化风险评估,以为下游制剂的开发奠定晶型研究的基础。做项目开发的最早期,尽可能进行彻底、可靠的晶型筛选,筛选的目的是尽可能地找到更多的晶型,并确定最适合、稳定的晶型进行研究。多晶型筛选常用化学方法主要包括:重结晶法、快速溶剂去除法、沉淀法、种晶法等;常用物理方法主要包括:熔融结晶法、晶格物理破坏法、物理转晶法等。各种方法影响晶型物质形成的重要技术参数包括:溶剂(类型、组成、配比等)、浓度、成核速率、生长速率、温度、湿度、光度、压力、粒度等。如参考案例:达比加群酯甲磺酸盐的多晶型研究主要是通过冷却结晶法,考察溶剂种类、溶剂比例、析晶温度等条件对达比加群酯甲磺酸盐晶型的影响,制备出几种不同晶型的达比加群酯甲磺酸盐晶体。在开发过程中,他们以无水形式I进行了开发。
1.2 多晶型的表征方法
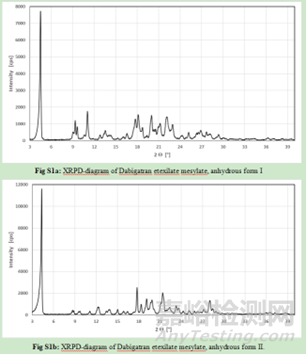
由于药物多晶型现象,快速有效并且准确的鉴别方法对多晶型的研究与表征很有必要。目前,多晶型研究常用的表征方法有X射线衍射方法、光谱分析方法、热分析方法以及熔点分析法等。近年来,固态核磁、拉曼光谱、近红外光谱和漫反射红外光谱也被广泛的应用于药物的晶型分析。
1.3 晶型可开发性评估
晶型可开发性评估一般需要根据不同晶型的特点、种类和复杂性,采用多种表征手段联用的方式,以提高对晶型理化性质的全面深入理解。需要结合晶型方法的可加工性/稳健性/可放大性、晶型的稳定性、制剂过程中的辅料相容性、制剂稳定性、溶出速率等方面进行充分评估确认,最终目的是选择一种优势晶型,以指导后续制剂处方工艺开发,并形成控制策略。
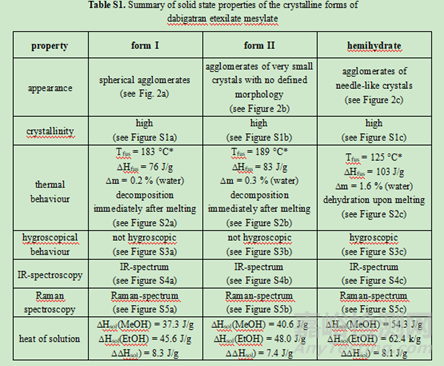
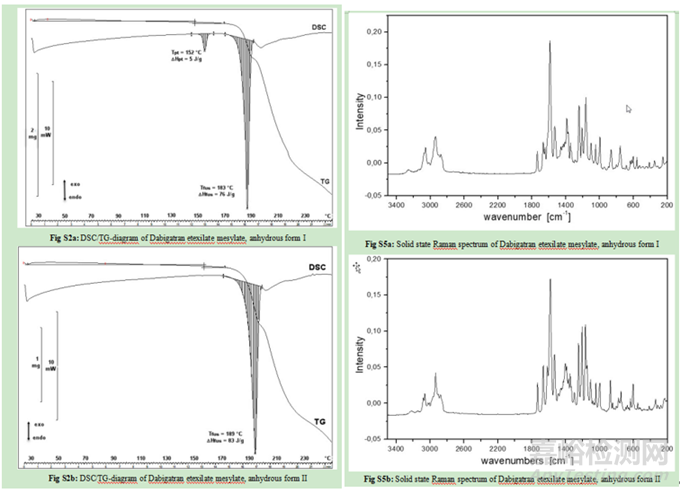
如达比加群酯甲磺酸盐选择无水物Ⅰ晶型作为目标晶型开发原因如下:1)原料药生产中具有稳健的可加工性:在盐沉淀步骤中更容易分离出形式I晶型。且形式I结晶通常呈球形团块,具有良好的整体物理特性,如易于过滤、易于干燥和优异的流动特性;2)它表现出稍好的长期化学稳定性。化学稳定性数据表明,无水形式I的化学稳定性略高于无水形式II。在36个月的时间里,形式I的总杂质含量在25℃/60% RH.的条件下从0.30%增加到0.44%,在40℃/75% RH的条件下从0.29%增加到0.98%。形式II的总杂质含量在36个月内从25℃/60%RH的条件下从0.25%增加到0.85%、40℃/75%RH保存时0.3% ~ 2.3%。半水化合物在热力学上也是一种稳定的形态,但由于晶体形态不利,没有被选中进行开发。半水结晶成很长很细的针状物(见图2c),导致比无水形式II更差的物理化学性质。此外,达比加群酯甲磺酸盐对水解的敏感性阻止了其水合形式的发展。因此,半水合物虽然热力学稳定,但不能被选做目标晶型。
2.检测和量化晶型转化的能力
2.1晶型定性、定量方法的开发
一般来说,特异性、灵敏度和稳健性是影响用于分析检测技术决策的三个主要因素。对于不同药物的不同晶型,其检查方法的专属性是不同的。进行晶型质量研究时,应根据化合物的自身特点,选择适宜的、具有专属性的晶型检查方法。基于晶体学、显微镜学、热分析或光谱学的物理技术可用于表征晶体形式。在早期开发过程中,为了支持风险评估研究,重要的是开发一种适宜的分析方法,该方法对晶体形式的变化具有广泛的特异性,但对辅料、制粒工艺等的变化具有稳健性。每种技术检测低水平晶型变化的能力取决于分子结构、药物负载、赋形剂种类等,因此,无法直接比较或假设这些技术的灵敏度,还是需要根据各个品种的自身特点去做详细的分析检测已开发出专属性、灵敏度适宜的检测方法。如下表为文献中介绍的几种固态表征技术开发时需要考虑的方法的专属性,以及对每个属性效用的介绍。
如可参考达比加群酯甲磺酸盐的晶型I和晶型II定量分析的分析方法开发过程研究:
X射线粉末衍射和红外光谱中两种晶型形式的峰或信号强烈重叠,因此无法考虑该两种方法进行定量分析。幸运的是,DSC和拉曼光谱对该药物的晶型检测更为灵敏。因此开发了一种DSC方法,能够定量由晶型I组成的原料药样品中掺杂0.6%的晶型II。但遗憾的是,由于受辅料的干扰,该DSC方法不能用于分析药物成品及其制粒中间体。,拉曼光谱能够检测颗粒制剂中的晶型II,定量限为5%。
2.2 晶型定量方法的实际应用评估
2.2.1 原料或制剂生产过程中的转晶风险评估
利用2.1章节所开发的晶型定量方法,需要应用该方法对多晶型药物制剂进行晶型物质状态的稳定性研究。在制剂的整个制备流程中,亚稳态药物晶型在受到溶剂、温度、湿度、压力、研磨、辅料等影响时,很容易发生药物晶型的转变。因此需要对原料、制剂的各工艺进程进行转晶风险评估,研究内容包括:原料药成分的晶型物质状态的稳定性、原料药晶型物质与制剂处方中各种辅料的相容性、制剂的制粒、成型、干燥等工艺对原料药晶型物质状态的影响等。通过晶型物质状态的稳定性研究,可为优势药物晶型物质状态选择、药物制剂处方、制备工艺过程控制、药品贮存条件等提供科学依据。
可参考达比加群酯甲磺酸盐的晶型研究控制:
(1)原料药合成
一系列实验调查了晶型II是否可以在拟定的商业原料药合成所描述的条件下或稍微偏离该拟定过程的条件下自发形成。研究主要集中在合成成盐步骤的两个主要参数:温度和处理时间。从实验数据中有迹象表明,转变为晶型II的风险随着温度和/或处理时间的延长而增加。然而,数据也表明,在原料药合成的最后一步,当温度不超过36℃时,晶型I的可重复性沉淀是可行的。第二组实验研究了当存在晶型II种子时晶型I合成的稳健性。从数据来看,很明显,在几个小时内就可以将晶型Ⅰ转化为晶型Ⅱ。为了避免这种转化,应避免与晶型II种子接触。综上所述,为避免在原料药合成过程中形成热力学更稳定的II型,在拟定的商业化工艺中实施了以下措施:盐沉淀步骤的温度已降至36℃以下,其他操作条件也相应优化,例如,在原料药分离步骤中,干燥器在低于50°C的温度下使用。
(2)原料药受机械应力的影响研究
在铣削或压缩等机械应力的影响下,无水形式I向无水形式II的转变也可能发生。对于甲磺酸达比加群酯,在结晶不能直接满足指定粒度分布的情况下,研磨是一个可选的工艺步骤。因此,铣削必须被视为另一种可能的来源,以形成热力学上更稳定的无水晶型II。另一方面,通过压缩向无水晶型II的转化可以忽略不计,因为在达比加群酯胶囊的制造过程中不包括压缩步骤,是将原料药直接喷在酒石酸丸上。
主要通过X射线粉末衍射、热分析和溶液量热(溶液热)等手段,对不同批次的研磨和未研磨原料药批次进行分析,以观察研磨过程是否引起固态相变(部分或全部转变为无水型II或非晶态)。结果显示所有方法(原则上能够检测固态相变)都没有检测到研磨和未研磨之间的任何差异,因此可以得出结论,没有发生向无水型II (LOQ: 0.6%)或非晶态的转变。
(3)制剂生产过程中转晶的影响研究
市场上销售的达比加群酯甲磺酸盐药物是一种胶囊,无水晶型Ⅰ在异丙醇和羟丙基纤维素衍生物中分散形成悬浮液中直接喷在酒石酸丸上。在此过程中,当原料药分散在异丙醇中时,也可能发生无水晶型I向晶型II的转化。如上所述,异丙醇是一种溶剂,其中达比加群酯甲磺酸至少具有一定的溶解度。为了更好地理解这一生产步骤中的多晶型转化,进行了几项小型实验室实验,模拟了异丙醇悬浮液的制备条件和甲磺酸达比加群酯的成球过程。在这些小规模的实验室实验中,不同组分(原料药、异丙醇、羟丙基纤维素)的比例反映了组分的比例。这些探索性实验室规模实验的结果总结如下:正如预期的那样,观察到强烈的时间,温度和初始无水晶型II含量依赖性。一般来说,在较高的温度和较高的初始晶型II水平下,转化率随着时间的推移而增加。在制备达比加群酯甲磺酸悬浮液前,将喷雾悬浮液辅料羟丙基纤维素溶解于异丙醇中,转化率降低。在异丙醇中悬浮的纯I型原料药批次(小于0.6%的II型原料药(DSC定量限))保存:A)在30℃下保存48小时;或B)在15℃下可达96 h,所得悬浮液中未检测到II型(拉曼法LOQ为5%)。然而,如果同一批次在30°C下悬浮48小时以上,则观察到16%的转变为II型。需要注意的是,实验室比例模型模拟的是最坏的情况,因为整个悬浮液被搅拌而没有喷射,从而减少了悬浮液的体积。在大规模生产中,搅拌好的悬浮液被连续喷洒,从而减少了悬浮液的体积,因此只有最后一部分在高达30°C的悬浮中停留48小时。因此,预计最终颗粒生产过程中产生的晶型II含量将显著低于实验室模型。且药品稳定性研究表明,在储存期间没有从I型转化为II型。
2.2.2 原料和制剂成品的稳定性放置过程中转晶风险评价
在这一阶段,该评估是在典型稳定性留样条件下进行的,可以提供对转化风险和程度的定量了解。期望的结果是根据已开发的定量分析方法的检测限度证明没有发现晶型转化过程。如果在制剂中检测到晶型变化,接下来的步骤是进行适当的研究,了解晶型转化的相关触发因素,并重新设计配方和/或工艺和/或存储条件,以调节或消除这些风险因素。因此,这一步的预期结果是在药品的生产过程中抑制晶型转化。危险因素的例子包括为转化提供良好微环境pH值的赋形剂、生产过程中使用的水分、或引入机械应力的高能单元操作。这些机制方面的考虑很重要,因为它们有助于确定晶型的控制战略。如果开发研究导致了配方和/或工艺修改的实施,并证明在生产或稳定过程中没有可检测到的晶体形态转变,则在药品中不要求建立晶体形态的验收标准。为了确认修改后的配方和/或工艺和/或存储条件一致地减轻了晶型转化的风险,可能会继续监测未来的药品批次。被监控的批次应包括规模扩大、技术转移和主要稳定性批次,因为一些与工艺相关的晶体形态转化可能取决于规模的大小。
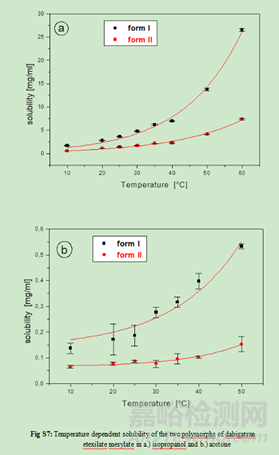
2.3多晶型的溶解性、固有溶出速率或溶出度评价
如果溶解方法能够以适当的灵敏度检测到不同晶型形式的变化,则多晶型的溶解性、固有溶出速率或溶出度研究可作为体外晶型物质评价的辅助方法。但需要注意一点:溶出度是一个测量药物从配方基质中体外释放的过程。除药物本身的溶解度以外,溶出还受润湿性、粒径等配方或工艺参数的影响,因此溶出速率的变化机制是混乱的,与晶体形态变化没有具体联系。溶出试验对晶体变化的敏感性也可能取决于化合物的溶解度。溶出不太可能区分高溶解度化合物的不同晶型形式。对于溶解性差的化合物,如果它们的溶解度存在足够的差异,则可以选择一种溶出介质来区分它们的不同晶型形式。
开发一种QC溶出方法,能够以可接受的特异性和灵敏度检测多种晶型形式,往往是一项挑战。一般来说,QC溶出介质需要满足3倍漏槽条件,以确保在溶出测试结束时药物可完全释放。在QC溶出设置中,通常会减小不同晶型之间的溶解度差异,特别是在溶出介质中使用表面活性剂,以增强溶解度,从而可以获得用于质量控制目的的完全释放要求。然而,在某些情况下,QC溶出方法可以用来监测不同晶体形态的变化,例如,当在溶出介质中观察到不同晶型之间的溶解度有显著差异时,缓慢或不完全的溶解释放可能表明存在晶型的转化行为。开发可区分晶型的QC溶出方法时,文献中提供以下的工作流程可供参考:
1)在生理pH值范围(1.0 ~ 7.5)和生物相关的介质中,收集每个纯晶型在多种介质中的平衡溶解度数据。如果在溶解度测量过程中发生了晶体变化,应该注意的是,溶解度值代表的是转化后的晶体,而不是最开始投入的晶体形态。
2)选择溶解介质并计算剂量/体积比,以评估是否能够满足漏槽条件(3倍平衡溶解度)。避免或尽量减少表面活性剂的使用,这样在溶解过程中,不需要的晶体形式可以保持不溶性。根据配方选择合适的溶出设备和搅拌速度。
3)通过将非目标的多晶形式(即1 - 10%)添加到目标晶型(即90 - 99%)中,支制备成相应的制剂进行定量评估。根据选择的方法条件进行溶出试验,并在最终采样时间点取样分析。计算释放百分比,并评估释放程度是否与配方中目标晶型的的溶出水平相当,以确定该方法对检测配方中不需要的晶型形式是否足够敏感。
4)如果QC溶出方法能够在制剂样品中检测出合理数量的非目标晶型形式,那么它就可以用于晶型的控制策略之一。如果是这种情况,则适当设置溶出标准,以确保在产品性能可接受的水平上检测和控制不良的晶型转化形式。否则,仍将需要开发固态相关检测技术。
3、多晶型药物的生物学评价
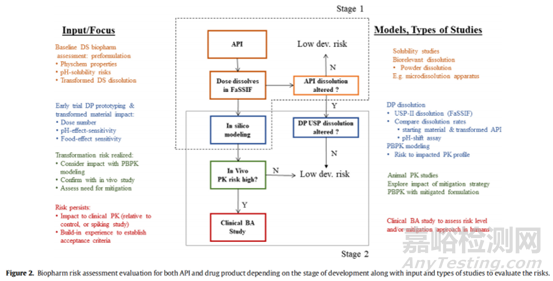
为了确认晶型转化风险对体内有效性/安全性造成的影响,而不是过度区分体外溶出方法学的产物,必要时也可以进行动物PK研究。通常,狗和犬科动物模型是常用的,大鼠和迷你猪也可以考虑。在转化风险评估的早期阶段,可在大鼠体内研究不同晶型掺杂比例的原料药混悬剂配方。对于口服固体剂型的晶型转化研究,狗和犬科动物在禁食状态、喂食状态或pH值改变状态下的研究是最具代表性的给药经验。各种模型的原料药和剂量转化、晶体形态转化风险和对人体生物性能的预测程度都有已公布药物的例子,大家可以自行查阅参考。
临床研究:临床相对生物利用度研究对于建立和/或可接受的晶型转化形式的水平也很有价值。FDA关于生物利用度和生物等效性的指南提供了关于相对于参考产品进行此类转化的临床研究的详细信息。通常,这是一种多交叉的相对生物利用度研究,将已知(加标)晶型转化原料药水平的试验剂型与低转化原料药或无晶型转化原料药水平的参考剂型进行比较。有文献提出了一种体外生物相关溶出、计算机建模、动物PK和临床PK评估的生物学评价工作流程是监管机构建立和认可的工具,用于评估患者体内的晶型转化风险,并证明降低风险策略的有效性。
例如达比加群酯甲磺酸盐在两项临床研究中评估了晶型II对药品相对生物利用度的影响。在一项双向交叉、随机、开放试验中进行的相对生物利用度研究没有证明纯剂型I和纯剂型II批次之间的生物等效性。两种形式的PK差异很小,但具有统计学意义,无水晶型II的Cmax和AUC略低。然而,第二次生物等效性研究表明,含有17%晶型II的试验批次与参考纯晶型I批次之间具有生物等效性。因此,最终药品中可以接受一定量的晶型II,并根据此结果制定原料药和制剂的晶型控制策略。
参考文献:
[1] P. Sieger , U. Werthmann , S. Saouane ,The polymorph landscape of dabigatran etexilate mesylate: Taking the challenge to bring a metastable polymorph to market [J]European Journal of Pharmaceutical Sciences ,186 (2023) 106447
[2] A. Bauer-Brandl,Polymorphic transitions of cimetidine during manufacture of solid dosage forms[J]International Journal of Pharmaceutics 140 (1996) 195-206
[3] Umesh Kestura, Anisha Patela, Sherif Badawya, Neil Mathiasa, Limin Zhangb ,Strategies for Managing Solid Form Transformation Risk in Drug Product[J]Journal of Pharmaceutical Sciences 112 (2023) 909−921