引言
外周血管疾病(Peripheral Artery Disease,PAD)是指除了冠状动脉和颅内血管之外的血管病变,包括上肢动脉、内脏动脉、下肢动脉、弓上动脉分支及主动脉等,其病理机制主要为动脉粥样硬化性血管狭窄[1]。在全球范围内,有2亿多人存在不同程度的PAD[2]。PAD常见的治疗方式包括药物治疗、手术治疗和腔内治疗,腔内治疗又可分为球囊成形术,又称经皮腔内血管成形术(Percutaneous Transluminal Angioplasty,PTA)、支架植入术(裸金属支架和药物洗脱支架)、斑块切除术、药物涂层球囊(Drug-Coated Balloon,DCB)等 [2-5],由医生根据患者病情选择治疗方式。球囊成形术是将球囊扩张导管沿导丝轨道送达动脉的靶病变处,利用球囊加压充盈后产生膨胀力而使狭窄的动脉扩张的一种介入治疗方法。自1977年,临床开始使用球囊扩张导管(以下简称为球囊)行PTA[6],其在冠状动脉血管疾病和PAD的治疗中发挥重要作用。球囊根据设计特性可分为顺应性、半顺应性和非顺应性3种类型,根据特殊功能又可分为普通球囊和修饰性球囊,修饰性球囊一般指切割球囊(显微刀片)、棘突球囊(尼龙棘突状)和双导丝球囊(金属丝)等[7]。对于轻中度钙化等高阻力病变,修饰性球囊能够使内膜钙化破裂,改善对钙化病变的扩张效果。普通球囊对于斑块的无序扩张造成的撕裂容易导致夹层血肿,增加血管急性闭塞风险,而修饰性球囊扩张后可引导斑块撕裂多发生在血管长轴方向,减少限流性夹层形成;修饰性球囊扩张易固定于斑块表面,避免球囊滑脱。刻痕球囊是将镍钛合金丝,螺旋状地环绕在球囊外表面,其工作原理与双导丝球囊类似,也是修饰性球囊的一种。
美国食品药品监督管理局(Food and Drug Administration,FDA)将应力集中程度更接近于刀片的球囊称为切割球囊,应力分布更接近于导丝或普通球囊的导丝球囊、棘突球囊称为刻痕球囊,但未明确区分两类球囊的应力阈值,将外周刻痕或切割球囊产品分类为Ⅱ类器械,通过510(k)路径注册[8]。我国在相关医疗器械产品注册审评审批中,一般认为用于冠脉的、对斑块有修饰作用的修饰球囊(刻痕、切割等)需考虑临床试验路径。随着外周血管修饰球囊临床应用的增多,如何确保上市产品的安全性和有效性,关系到人民群众的健康和行业的发展,也对科学监管提出了更高的要求。本文拟从刻痕或切割球囊的工作原理、临床应用出发,综述这类产品的特点,并结合现行的监管框架和要求,旨在从临床评价的角度总结产品审评和审批的思考。
切割球囊由非顺应性球囊及黏附表面的纵向平行排列的显微刀片组成,刀片切开斑块,产生纵向切口。由于切割球囊与病变的接触面是由不锈钢制成的刀片,局部作用力大,易于切开坚硬的病灶,但存在造成意外损伤的风险。
双导丝球囊由导丝和球囊组成,两根导丝纵向平行排列,黏附于球囊的表面,其结构简单,类似于医生在普通球囊旁放置额外的引导导丝,但导丝易随着球囊滑动,不易固定于血管壁。
1、 刻痕或切割球囊的发展
球囊扩张导管通过远端球囊膨胀,挤压血管的斑块,拉伸血管壁,达到减少血管狭窄的目的,但也可能伴随如血管内膜撕裂、血管弹性回缩等并发症。对于坚硬的狭窄病变(如钙化病变),通常需要提高球囊的充盈压力,才能减轻狭窄程度,获得足够的管腔容积。而充盈压力的增加,会使血管壁的拉伸作用增加,导致出现血管损伤相关并发症(如严重夹层、回弹)的可能性更大。对于特别顽固坚硬的病变,可能将球囊充盈至接近爆破压,仍无法压缩斑块。
医生发现,在球囊外再置入一条额外的伴行导丝 [9],当球囊膨胀时,外部伴行导丝与狭窄病变(如钙化病变)交界处,因局部压强较大,形成压槽,随着球囊继续膨胀,根据弹性力学的理论,槽底部位会出现局部应力集中的现象,即压力聚焦作用,从而有效地压碎硬的斑块,扩张血管,达到减少血管狭窄的目的。这种方法被称为双导丝技术[9]。1995年,Sandeep等[10] 报告使用导引导丝辅助球囊成形术的效果,对美国心脏病学院/美国心脏协会A或B型病变行经皮冠状动脉腔内血管成形术,使用双导丝技术时,球囊充盈压为435697.5Pa,最终残余狭窄率为21% ;不使用双导丝技术时,球囊充盈压为678877.5Pa,最终残余狭窄率为29%,存在显著差异(P=0.001)。
刻痕球囊和双导丝球囊等产品的设计理念都源于双导丝技术,主要将导丝与球囊相结合,形成一个整体。医生遇到复杂的纤维钙化病变或难以扩张病变时,无须在普通球囊旁边放置额外的引导导丝,简化了临床操作。
2、 刻痕或切割球囊的组成和特点
刻痕球囊由修饰性组件(导丝)和球囊组成,导丝由镍钛合金制成,表面经电抛光,与镍钛合金的支架相似,呈螺旋状,绕在球囊的外表面。球囊未充盈时,贴附于球囊的表面,使刻痕球囊拥有与普通球囊类似的通过性。球囊充盈后,导丝呈螺旋状贴附于血管壁,起到类似于螺丝的固定作用,防止球囊的滑动。
切割球囊由非顺应性球囊及黏附表面的纵向平行排列的显微刀片组成,刀片切开斑块,产生纵向切口。由于切割球囊与病变的接触面是由不锈钢制成的刀片,局部作用力大,易于切开坚硬的病灶,但存在造成意外损伤的风险。
双导丝球囊由导丝和球囊组成,两根导丝纵向平行排列,黏附于球囊的表面,其结构简单,类似于医生在普通球囊旁放置额外的引导导丝,但导丝易随着球囊滑动,不易固定于血管壁。
3、 刻痕或切割球囊的临床应用
刻痕或切割球囊在不同外周血管病变的临床应用的专家共识中存在差异,在一些病变中,刻痕或切割球囊作为辅助治疗(预处理或病变准备)方式,而对于某些病变,刻痕或切割球囊可作为供选择的治疗方式。
3.1 辅助治疗(预处理或病变准备)
3.1.1 肾动脉狭窄
2017年,中国医疗保健国际交流促进会血管疾病高血压分会发布了《肾动脉狭窄的诊断和处理中国专家共识》[11],对于大动脉炎引起的非粥样硬化性肾动脉狭窄(Renal Artery Stenosis,RAS)的患者,共识指出PTA未成功患者包括球囊扩张后病变即刻发生弹性回缩或夹层,病变坚硬难以充分扩张,导致影像结果不满意。在该类患者中,选择性支架置入术或加用切割球囊扩张可能是备选的治疗方式之一,针对上述情形,切割球囊可作为预处理治疗选择方式。对于粥样硬化性 RAS患者共识指出,介入治疗方法包括PTA和支架置入术,该共识建议粥样硬化性RAS要获得满意的血管重建和减少再狭窄率应常规使用支架置入,但对于小部分不适合支架置入的病变仍可采用球囊扩张术治疗,在此情形下,刻痕和切割球囊可作为支架置入前的预处理器械。在上述情形下,使用刻痕或切割球囊扩张后,减轻了病变部位的坚硬度,减少了发生回缩或夹层的发生,然后医生根据扩张效果进行后续的支架置入操作。
3.1.2 部分股腘动脉病变预扩张治疗
2018 年,美国心血管造影和介入学会(Society for Cardiovascular Angiography and Interventions,SCAI),发布了《股腘动脉介入治疗中器械选择的SCAI共识指南》[12],共识指南指出,在临床实践中,特殊球囊多作为股腘动脉(Femoral-Popliteal,FP)疾病的辅助治疗(病变准备)器械,特殊球囊辅助治疗的病变如表1所示,刻痕或切割球囊作为特殊球囊预期可治疗或辅助治疗严重钙化和难以扩张病变。目前对于病变准备尚无明确定义,但有多种不同的方法和技术[13]。病变准备可用作单独的治疗目的,但更多的是作为最终治疗器械(如DCB或支架)使用前的辅助准备。病变准备的工具包括减容器械,例如,定向斑块切除术、旋磨术或旋切术、激光消蚀,以及血管内碎石术。除上述器械以外,还有一些特殊球囊,如切割球囊、聚力球囊和斑块修饰球囊,这些特殊球囊可以作为简单易用的工具来准备病变。
设计这些特殊球囊是为了更可控的扩张动脉粥样硬 化斑块,从而达到更高的即刻技术成功率(弹性回弹更 少、球囊滑动更少、夹层更少),并发症发生率更低(穿 孔更少),提高抗增殖药物的渗透,与普通球囊血管成 形术相比更高的手术通畅率的目的。它们既可以单独作 为最终治疗器械,也可以在其他最终治疗器械前作为辅 助器械使用。
3.2 病变治疗
3.2.1 动静脉内瘘术中的血管狭窄
2019 年,中国医院协会血液净化中心分会血管通路
工作组发布了《中国血液透析用血管通路专家共识(第 2 版)》[14],对于自体动静脉内瘘狭窄的治疗,共识指出 可应用高压球囊导管、超高压球囊导管及特殊球囊导管 (如带导丝球囊导管、切割球囊导管、药物洗脱球囊导管、 棘突球囊导管等)[15]。对于动静脉瘘狭窄的治疗,切割 球囊导管及带导丝的特殊球囊导管可作为临床治疗方式之一。
在以下情况时可以考虑支架植入:① 血管成形术后弹性回缩(残余狭窄超过50%);② 3个月内狭窄复发。即球囊扩张效果满意 :残余狭窄<50%且不影响血流的夹层,则使用产品后无须进一步处理,或球囊扩张效果满意:无弹性回缩、残余狭窄 <50%且预期3个月内狭窄不会复发,则使用切割球囊导管及带导丝的特殊球囊 产品后无须支架进一步处理。
3.2.2 部分股腘动脉病变
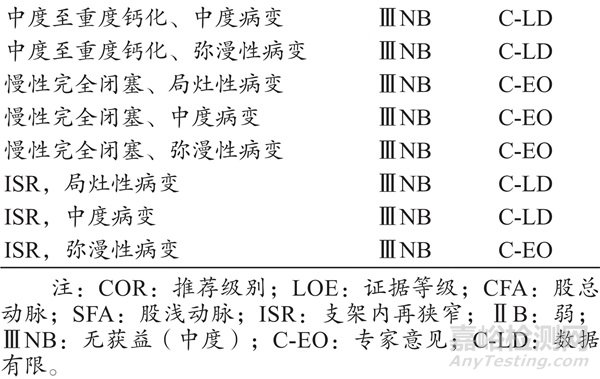
基于有限的已发表数据[16-22],可单独使用特殊球囊(刻痕球囊、外周切割球囊等)治疗FP疾病,推荐情况 如表2所示。
4、 刻痕或切割球囊器械注册审评思考
根据相关专家共识和指南,刻痕或切割球囊作为特殊球囊预期可治疗或辅助治疗严重钙化和难以扩张病变[12]。在临床实践中,刻痕或切割球囊可以作为血管病变预处理或最终治疗方式。
根据应用部位的区分,常见的有冠脉刻痕或切割球囊和外周刻痕或切割球囊。外周刻痕或切割球囊的适用范围通常为预期用于扩张髂动脉、股动脉、髂股动脉、腘动脉、腘下动脉和肾动脉内的病变,并用于自体或人工动静脉透析瘘管的阻塞性病变的治疗。冠脉刻痕或切割球囊的风险较外周刻痕或切割球囊高,但作用机理类似,本文对冠脉刻痕或切割球囊的注册审评思路进行了总结。
4.1 外周刻痕或切割球囊临床评价
美国FDA将外周PTA刻痕或切割球囊分为Ⅱ类器械,通过510(k)路径注册[23],刻痕或切割球囊可通过钙化实验室模型、具有钙化病变的动物模型、尸体模型和/或临床试验证明刻痕或切割器械的安全有效性。
根据我国现行的注册监管要求,外周刻痕或切割球囊为Ⅲ类器械,临床评价可以基于申报产品自身的临床试验数据,也可以基于同品种产品的临床资料。当通过同品种临床评价路径时,选择的同品种产品应为已上市的,具有基本相同的预期用途和相似技术特征的产品。
对比申报产品和同品种产品在适用范围以及临床使用相关信息的相同性和差异性,建议重点考虑以下内容:适应证、适用部位及血管类型以及使用方法、禁忌证等。技术特征的对比需考虑:① 基本原理,包括聚力原理等;② 结构组成,重点关注刻痕组件的设计及规格参数,提供各组件的尺寸、公差和工程图纸等 ;③ 制造材料,与人体直接或间接接触的原材料 ;④ 性能要求,常用需进行对比的性能要求包括 :尺寸(球囊直径、球囊长度、导管轴的工作长度、兼容的导丝及导引导管)、压力(标称压力、额定爆破压力)、涂层性能、刻痕组件相关性能(如刻痕或切割组件的牢固性、防滑性能等)。
上述对比内容的差异可通过性能、涂层性能、防滑性能、尺寸、压力台架试验、动物试验(可为无病理模型)的验证论述等同性,需要注意的是刻痕或切割球囊对于斑块的扩张效果需要提供能够模拟临床的验证方法,例如,钙化实验室模型、具有钙化病变的动物模型、符合法规要求的尸体试验模型和/或临床试验。美国FDA对于动物试验和/或尸体试验研究一般关注器械的输送通过性能、可跟踪性、对血管壁的损伤,包括夹层的发生率及严重程度、血栓及穿孔的发生率,钙化病变的扩张治疗效果,需在动物试验和/或尸体试验的研究方案中给出接受标准。
考虑到冠状动脉与外周动脉管脉系统存在一定的相似性,如血管壁各层(内膜、中膜及外膜)的厚度相当、动脉粥样硬化斑块的成分及病理进程相似、冠状动脉与外周膝下动脉的血管直径相近,但冠状动脉相较外周动脉血管并发症风险更高(如冠脉动脉血管穿孔可能导致心包填塞、心梗等需进行紧急开胸手术,而外周动脉可通过加压或止血带或相对直观的外科手术控制并发症)。设计特征相同的冠状动脉产品临床使用中的安全有效性数据(如临床试验数据),可以作为外周动脉产品临床应用安全有效性的重要支持证据的一部分。
与同品种产品详细对比,所有差异均应逐一分析,提供支持性资料,并提交相应非临床或临床证据证明该差异不对产品的临床使用产生不利影响,相关内容需符合《医疗器械临床评价技术指导原则》[24]。
4.2 冠脉刻痕或切割球囊临床评价
冠脉刻痕或切割球囊的临床评价方式一般采用临床试验路径。试验设计应参考《医疗器械临床试验设计指导原则》[25] 的相关要求。例如,可采用前瞻性、单组目标值的临床试验设计。主要评价指标可考虑从如下几个方面选择:① 安全性指标,主要为术后14d内无主要心血管不良事件)事件率,主要有效性终点为手术成功率(术后即刻残余直径狭窄≤50%,围术期无死亡、MI心肌梗死、冠脉搭桥术[26-27];② 器械成功率,包括试验球囊能够成功输送、扩张、收缩和撤出,术后即刻无血管穿孔、限流性夹层(C级以上)或与试验球囊有关的心肌梗死溶栓(Thrombolysis In Myocardial Infarction,TIMI)血流减少(相较基线),经皮冠状动脉介入治疗(Percutaneous Coronary Intervention,PCI)术后即刻TIMI血流分级为3级 [28]。
次要有效性及安全性评价指标可考虑 :① 器械使用成功率(成功输送、扩张、收缩和撤出,且扩张后残余病变狭窄<50%);② 30 d 内靶病变失败复合终点,即出现心源性死亡、靶病变相关的心肌梗死及临床驱动的靶病变血运重建 ;③ 术后30d内患者相关的心血管临床复合终点,包括全因死亡、有所心肌梗死以及任何再次血运重建 ;④ 器械操作使用性能评价 ;⑤ 术后即刻的手术成功率,即PCI术后靶病变的管腔狭窄<20%,TIMI血流3级,且围手术期无心源性死亡、靶病变MI或临床驱动的血运重建 [29] ;⑥ 夹层发生率和夹层类 ;⑦ 不良事件等。
临床试验目标值/界值以及样本量应当综合当前临床诊疗实际(如参考临床指南、专家共识或临床文献荟萃分析等)和产品自身设计特征科学设定。球囊各型号规格在临床试验中的确认,一般可考虑四角矩阵的原则,即长度,直径最长、最短、最大、最小的组合。申请人声称的各种特殊病变类型(如慢性完全闭塞病变、血管内再狭窄、原位小血管等)宜纳入临床试验分组中,并给出各特殊病变的亚组结果。
5、 总结与展望
在全球范围内,刻痕或切割球囊已成为介入治疗中重要的医疗器械。根据相关专家共识和指南,刻痕或切割球囊在临床使用中可以作为辅助准备治疗(预处理)或最终治疗。该类产品在中国和美国的注册监管审评中,冠脉刻痕或切割球囊的临床评价,一般采用临床试验。外周刻痕或切割球囊的临床评价,可基于临床试验,也可基于同品种的临床资料,还可将设计特征相同的冠状动脉产品临床安全有效性数据,作为外周动脉产品临床安全有效性的一部分支持证据。随着人民对医疗和健康的要求日益提高,新的医疗器械不断涌现,在审评过程中,充分了解产品的作用机理、结构和组成和临床应用,才能准确地判断临床证据的可接受性和可外推性。同时,吸收和借鉴美国、欧盟、日本等国家或地区的审评思路和经验,也是优化和扩展审评思路的有效途径。以更有效地促进国内医疗器械产业的发展,更好地为人民群众的健康服务。
[参考文献]
[1] 苗雨晴, 李拥军. 药物涂层球囊在外周血管疾病中的应用及展望[J]. 中国临床医生杂志, 2020, 48(8): 898-900.
[2] Kokkinidis DG, Armstrong EJ. Armstrong, emerging and futuretherapeutic options for femoropopliteal and infrapoplitealendovascular intervention[J]. Interv Cardiol Clin, 2017, 6(2):279-295.
[3] van der Vijver-Coppen RJ, Mannetje YW, Menting TP, et al.Treating complex femoropopliteal lesions[J]. J CardiovascSurg, 2018, 59(2): 158-163.
[4] Bradbury AW, Adam DJ, Bell J, et al. Bypass versusAngioplastyin Severe Ischaemia of the Leg (BASIL) trial:a survival predic tion model to facilitate clinical decisionmaking[J]. J Vasc Surg, 2010, 5195(l): 52S-68S.
[5] Adam DJ, Beard JD, Cleveland T, et al. Bypass versusangioplasty in severe ischaemia of the leg (BASIL):multicentre, randomised controlled trial[J]. Lancet, 2005,366(9501): 1925-1934.
[6] Grüntzig A. Transluminal dilatation of coronary arterystenosis—experimental report[R]. Heidelberg: PercutaneousVascular Recanalization , 1978: 263.
[7] 国家卫生健康委. 国家卫生健康委办公厅关于印发冠状动脉球囊成形术与支架植入术操作规范(2022年版)和髋膝关节置换术操作规范(2022年版)的通知(国卫办医函〔2022〕77号) [EB/OL]. (2022-03-21) [2022-11-21]. http://www.nhc.gov.cn/yzygj/s7659/202203/d5cb0d71f5db461da0097c54b8296814.shtml.
[8] U.S. Food and Drug Administration. Peripheral percutaneoustransluminal angioplasty (PTA) and specialty catheters -premarket notification (510(k)) submissions draft guidancefor industry and food and drug administration staff (FDA2019-D-5422)[EB/OL]. (2020-01-13)[2022-11-21]. https://www.fda.gov/regulatory-information/search-fda-guidancedocuments/peripheral-percutaneous-transluminal-angioplastypta-and-specialty-catheters-premarket-notification.
[9] Carlson TA, Teirstein PS. The “Concorde” stent: a novel use ofa stiff bent guidewire to facilitate stent deployment[J]. CathetCardiovasc Diagn, 1997, 40(3): 277-280.
[10] Sandeep K, Donovan B, Theodore S, et al. Facilitated lumenen largement by longitudinal force focused angioplasty[J]. JInvasive Cardiol, 1995, 25(2): 345A-346A.
[11] 中国医疗保健国际交流促进会血管疾病高血压分会专家共识起草组. 肾动脉狭窄的诊断和处理中国专家共识[J]. 中国循环杂志, 2017, 32(9): 835-842.
[12] Dmitriy N. Feldman EJ, Aronow HD, et al. SCAI consensusguidelines for device selection in femoral-popliteal arterialinterventions[J]. Catheter Cardiovasc Interv, 2018, 92: 124-140.
[13] Blessing E, Lugenbiel I, Holden A. The evidence to supportthe use of focal force balloon technology to improve outcomesin the treatment of lower extremity arterial occlusive disease[J].J Cardiovasc Surg, 2019, 60(1): 14-20.
[14] 中国医院协会血液净化中心分会血管通路工作组. 中国血液透析用血管通路专家共识(第2版)[J]. 中国血液净化, 2019,18(6): 365-381.
[15] Nikam MD, Ritchie J, Jayanti A, et al. Acute arteriovenousaccess failure: long-term outcomes of endovascular salvage andassessment of co-variates affecting patency[J]. Nephron, 2015,129(4): 241-246.
[16] Poncyljusz W, Falkowski A, Safranow K, et al. Cuttingballoon angioplasty versus balloon angioplasty as treatment forshort atherosclerotic lesions in the superficial femoral artery:randomized controlled trial[J]. Cardiovasc Intervent Radiol,2013, 36: 1500-1507.
[17] Amighi J, Schillinger M, Dick P, et al. De novo superficialfemoro-popliteal artery lesions: peripheral cutting balloonangioplasty and restenosis rates -randomized controlled trial[J].Radiology, 2008, 247: 267-272.
[18] Canaud L, Alric P, Berthet JP, et al. Infrainguinal cuttingballoon angioplasty in de novo arterial lesions[J]. J Vasc Surg,2008, 48: 1182-1188.
[19] Cotroneo AR, Pascali D, Iezzi R. Cutting balloon angioplastyin short femoropopliteal arterial stenoses[J]. J Endovasc Ther,2008, 15: 283-291.
[20] Dick P, Sabeti S, Mlekusch W, et al. Conventional balloonangioplasty verses peripheral cutting balloon angioplasty fortreatment of femo- ropoliteal artery in-stent restenosis: initialexperience[J]. Radiology, 2008, 248: 297-302.
[21] Peeters P J, Bosiers M, Scheinert D, et al. Role of theAngioSculpt scoring balloon catheter for the treatment offemoro-popliteal disease: 1-year results from the MASCOTTrial[J]. Cardiovasc Revasc Med, 2010, 11(4): 272-273.
[22] Bouras G, Lansky A, McClure J, et al. Outcomes from thechocolate BAR: a large, multicenter, prospective, post-market study on use of the chocolate percutaneous transluminalangioplasty (PTA) balloon[J]. J Am Coll Cardiol, 2016, 68:B314.
[23] U.S. Food and Drug Administration. Certain PercutaneousTransluminal Coronary Angioplasty (PTCA) Catheters - ClassⅡ SpecialControls Guidance for Industry and FDA[EB/OL].(2010-09-08)[2022-11-21]. https://www.fda.gov/medicaldevices/guidance-documents-medical-devices-and-radiationemitting-products/certain-percutaneous-transluminal-coronaryangioplasty-ptca-catheters-class-Ⅱ-special-controls.
[24] 国家药品监督管理局医疗器械技术审评中心. 国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告(2021年第73号)[EB/OL]. (2021-09-28)[2022-11-21]. https://www.cmde.org.cn/flfg/zdyz/fbg/fbgqt/20210929092409574.html.
[25] 国家药品监督管理局医疗器械技术审评中心. 总局关于发布医疗器械临床试验设计指导原则的通告(2018年第6号)[EB/OL]. (2018-01-04)[2022-11-21]. https://www.cmde.org.cn/flfg/zdyz/fbg/fbgqt/20180205150300135.html.
[26] U.S. Food and Drug Administration. Premarket approval(PMA)-P050018 AngioSculpt® Evo RX PTCA scoring balloon catheter with hydrophilic coating[EB/OL]. (2021-12-23)[2022-11-21]. https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=P050018S030.
[27] U.S. Food and Drug Administration. Premarket approval(PMA)- p020037 FX minirail RX percutaneous transluminalcoronary angioplasty (PTCA) catheter [EB/OL]. (2003-06-11) [2022-11-21]. https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=P020037.
[28] U.S. Food and Drug Administration. Premarket approval(PMA)- P200041 scoreflex NC scoring PTCA catheter [EB/OL]. (2021-12-21)[2022-11-21]. https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=P200041.
[29] 朱丹丹, 高婧, 夏慧琳, 等. 切割球囊系统在治疗冠状动脉血管疾病中的有效性和安全性分析[J]. 中国医学装备, 2022,4(19): 49-53.
Zhu DD, Gao J, Xia HL, et al. Analysis on the effectivenessand safety of cutting balloon system in the treatment of vasculardisease of coronary artery[J]. China Med Equip, 2022, 4(19):49-53.本