1 、流行病学
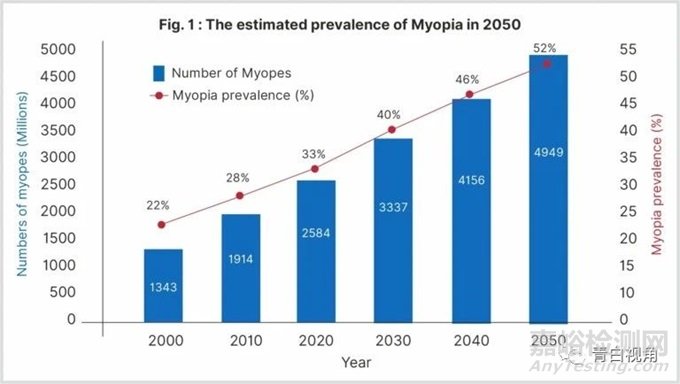
近视是可避免的视力丧失的主要原因,尤其是儿童。据估计,到 2050 年,近视将影响世界人口的 52%(49.49 亿)(见图 1)。据估计,与非洲人 (5.5%) 相比,东亚人 15 岁儿童近视患病率最高 (69%)。在过去 30 年中,美国的近视患病率增加了 8 倍。图2显示了部分国家 的儿童近视患病率。事实上,较年轻的眼睛近视发展速度更快,导致高度近视程度比报告的情况更高。到 2050 年,预计世界上大约 10% 的人口患有高度近视(<-5 D),从而带来威胁视力的并发症。根据最近的估计,近视的屈光度 (D) 每增加一个D,近视性黄斑病变、开角型青光眼和视网膜脱离的发病率分别增加 58%、20% 和 30%。
2 、现有治疗方案
目前对于近视的主要分为行为控制、环境改造和医学矫正三大类。
2.1 行为控制---更多户外活动
2.2环境改造---照明环境设施
2.3 医学矫正
光学矫正(如普通单焦框架眼镜、隐形眼镜、离焦软镜、离焦框架镜、OK镜、巩膜镜等)。
药理学控制(如低浓度阿托品滴眼液等),目前以局部疗法为主。
近视手术矫正(适用于成人)等。
以上简单罗列,还有一些其他近视防控技术等不在此处赘述。然而迄今为止,没有任何一种方法能够治愈或者逆转近视。
但是如果说未来或许还有口服疗法选择,期待吗?其实近视防控的口服疗法并不是一个横空出世、新颖的理念。来自丹麦的一位眼科医生(中后期联合中国中山大学眼科中心眼科研究团队)已经在这个研究领域上花了近20年的时间去做转化。目前正逐渐走向临床。
由于近视控制需要持续多年,理想的分子必须具有非常低的毒性、高功效并且相对低成本。
3 、口服疗法
3.1 创始人、公司及产品管线
该项技术源于一位眼科医生的技术成果转化,丹麦眼科专家Klaus Trier,1957年出生,1983年获得哥本哈根大学医学博士。他和另一位1963年出生的有化工和金融从业背景的产业创业者Sundeep Aurora在2000年一起联合创设了Theialife。Sundeep Aurora目前也同时运营一家CRO和CDMO公司。
Theialife 作为一家创新型生物技术公司,重点是发现和开发具有眼科应用的一流药物,通过一系列针对眼部疾病的突破性疗法彻底改变眼科行业,来解决未满足的医疗需求。Theialife管线药物涉及眼科多个适应症,包括翼状胬肉、干眼症、角膜盲、圆锥角膜、高度近视、白内障、AMD等。
3.2 近视口服疗法候选资产
3.2.1 当前进展
其中处于开发阶段较为后期的候选资产便是今天我们要讨论的主角:7-MX,一种新型的首创口服药物,针对近视适应症。 经过Klaus Trier20多年的研究表明,近视是可以预防的,并且通过在早期进行适当的干预可以减缓其发展。
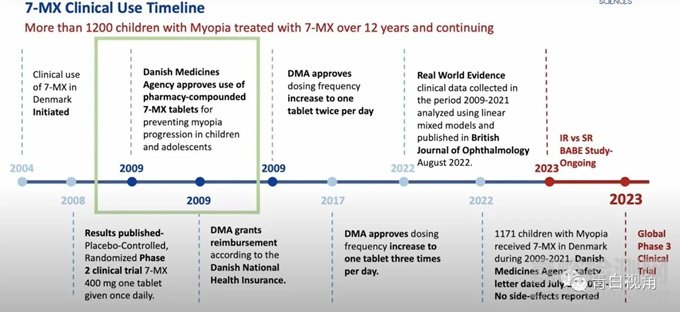
7 -MX 自 2009 年以来仅在丹麦权威药房进行临床使用,且当地只有两家药店获得丹麦监管机构许可可以为近视儿童配发7-MX。该项用于控制近视进展候选产品已在丹麦超过 1171 名儿童使用,人体使用已有超过12年的历史。
该近视口服疗法候选资产已完成临床前开发,在丹麦完成了 2 期临床试验,正在启动全球 3 期临床研究。
3.2.2 最早的研究---如何发现
在1999年之前,Trier一直对糖胺聚糖和巩膜的研究兴趣较大,直到1999年他做了一项关于兔巩膜的生物化学和超微结构的研究,用了四种不同的物质成分让兔子口服,其中一种成分便是7-MX 。而最后的研究结果出来之后,也开启了他对7-MX长达20余年的研发之旅。以下这篇发表在「Br J Ophthalmol」的文章也是Trier 所有文献中最早提及7-MX的研究成果。
当时的研究发现7-MX 这种咖啡因的代谢产物,可增加后巩膜中胶原蛋白的浓度和胶原纤维的直径,可能有助于治疗或预防与巩膜胶原蛋白水平低和/或质量差相关的疾病,例如轴性近视、慢性开角型青光眼以及可能的新生血管性年龄相关性黄斑变性。而其中一种物质乙酰唑胺长期治疗引起的胶原蛋白明显损失被视为潜在的有害副作用。
另外,笔者注意到在这个兔实验中的7-mx的血清峰浓度约为70μmol/l,半衰期约为1小时,药效时间比较短。
3.2.3 最关键的研究---广泛应用
之后在2003年,为了测试 7-mx 是否有助于防止儿童近视眼轴延长和近视加深。Klaus Trier创立的Trier研究实验室发起了一项临床研究。77 名 8-13 岁、最低基线近视为 -0.75 D 的近视儿童被随机分配到每天一次 400 毫克 7-MX 组或安慰剂组,为期 12 个月。在接下来的 12 个月内,所有 68 名剩余参与者均接受了 7-MX,而在为期 36 个月的研究的最后 12 个月内,所有 61 名剩余儿童均未接受治疗。
研究成果在2008年发表:在第一年中,与安慰剂治疗的儿童相比,随机接受 7-MX 治疗的儿童的轴向伸长减少了 0.04 毫米;与前 12 个月接受安慰剂治疗和随后 12 个月接受 7-MX 治疗的儿童相比,连续接受 7-MX 治疗 24 个月的儿童的轴向生长显著降低。在治疗周期中,轴生长率显著低于前一时期,但在停止治疗后的第三年,轴向增长率与上年无差异。只要继续7-MX治疗,眼轴生长速度就会减慢,一旦停止治疗,眼轴生长速度就会增加,但没有反弹效应(停止治疗后近视进展加速)的迹象。结果表明,7-mx 可减少儿童近视的眼轴伸长和近视进展。该治疗安全且无副作用,可以持续到 18-20 岁,此时近视进展通常会停止。
正是这项关键的试验结束后,2009年丹麦药品管理局 (DMA) 允许权威药房配比使用 7-MX 来控制儿童和青少年的近视。最初,儿童的处方为每天一次 400 毫克(早上);从 2011 年开始,剂量增加到每天两次(早上一粒,晚上一粒);从 2017 年开始增加到每天 3 次(一粒)。
自 2009 年 DMA 批准使用 7-MX 片剂控制近视以来,共有 1171 名儿童和青少年接受了治疗,并且没有副作用报告(2022 年 7 月个人通讯,DMA)。
3.2.4 近期的研究---真实世界证据
最近的一项真实世界研究目的是评估服用 7-MX 的儿童近视进展率的研究,研究使用线性混合模型分析 711 名丹麦近视儿童接受不同剂量口服 7-MX(0-1200 mg/天)治疗后的纵向散瞳验光和眼轴长度数据。这项研究我国暨南大学附属深圳眼科医院的崔冬梅教授也参与了研究。相关研究报告于2023年10月发布在「Br J Ophthalmol」。
结果基线时中位年龄为 11.1 岁(7.0 –15.0 岁),儿童的平均随访时间为 3.6 年(0.9-9.1 年),平均近视进展为 1.34 屈光度 (D)( -6.50 至 +0.75 D)。模型显示,平均而言,每天服用 1000 毫克 7-MX 的 11 岁儿童在未来 6 年内近视度数将达到 -1.43 D,而如果不治疗,近视度数将达到 -2.27 D。当每天服用 1000 毫克 7-MX 剂量时,该儿童的眼轴长度将在 6 年内增加 0.84 毫米,而如果不治疗则增加 1.01 毫米。没有报告 7-MX 治疗的不良反应。该研究的结论为在丹麦近视儿童样本中,口服 7-MX 与近视进展减缓和眼轴伸长降低相关。
3.2.5 安全性
7-MX 是多种甲基黄嘌呤(可可碱、茶碱和咖啡因)的代谢产物,它天然存在于可可果实中。它是人体组织和体液中常见的嘌呤碱成分。属于甲基黄嘌呤类,每天在茶、咖啡、巧克力和饮料等饮食中消耗。咖啡因代谢主要由 CYP1A2 和黄嘌呤氧化酶催化,导致形成 14 种不同的代谢物,包括 7-MX。
7-MX 应用于近视防控是为 6-8 岁年龄段至 16-18 岁年龄段的近视长期治疗而开发的。根据新分子的法规指南,对于长期给药开发的药物,必须进行亚慢性和慢性毒性研究。
在前述2003年发起并在2008年发文的这项关键性研究后,Klaus Trier教授与原/现中山大学眼科中心的诸位教授,其中包括有葛坚、杨晓、曾骏文、胡建民、陈翔、崔冬梅等等专家共同做了大量的临床前研究。
急性和亚急性毒性研究进行了评估最大耐受剂量(MTD)和 LD50,这对于与临床上使用的其他黄嘌呤(即咖啡因和可可碱)相比,对啮齿动物进行毒性评估是必要的。在急性毒性研究中,7-甲基黄嘌呤以单剂量给药。这项研究是在两种不同的物种上进行的,Wistar 小鼠和大鼠。在这项急性毒性研究中,两种啮齿类动物在服用 7-MX 后均未表现出任何形式的发病或死亡,而咖啡因组和可可碱组的死亡率分别为 66.6%(小鼠)和 33.3%(大鼠) 。施用7-MX后体重和采食量没有显著变化,这与咖啡因和可可碱处理相似。在亚急性研究中,每天口服 7-MX,持续 28 天,剂量分别为 250、500 和 1000 mg/kg。第28天进行的组织病理学研究未发现任何处死动物出现任何病理变化,并且在任何剂量的 7-MX 给药下,动物均未表现出任何毒性症状和死亡。在另一项亚慢性(90 天重复剂量毒性)和慢性毒性(180 天重复剂量毒性)评估研究中,发现 7-MX 与咖啡因和可可碱相比是无毒的。
这些毒性研究的数据显示,7-MX本质上是无毒的,可在临床上用于慢性近视的治疗。
以上研究可以得出,7-MX 似乎比其前体咖啡因安全得多,而后者已被美国 FDA 归类为 GRAS(普遍认为安全),因此可以不受限制地添加到膳食产品中。由于西方世界的大多数人每天摄入含有咖啡因或可可碱的饮食产品,因此大多数人不断接触低浓度的 7-MX。例如,一杯可可含有约 200 毫克可可碱,由代谢可可碱形成的 7-MX 稳态血清浓度约为可可碱的 10%,相当于摄入 20 毫克 7-MX产生的血清浓度。
3.2.6 作用机制
在过去的几年中,已经进行了大量的实验来研究各种甲基黄嘌呤在各种人类疾病中的药理作用,如呼吸、心脏、神经、肾脏、男性生育力和肥胖症等。7 - MX是黄嘌呤家族中第一个用于有效控制近视发展和眼轴长的分子。
甲基黄嘌呤已被证明可以通过充当腺苷受体拮抗剂来调节 GABA 受体、抑制磷酸二酯酶并动员细胞内钙。7 -MX 是一种非选择性腺苷受体拮抗剂,由于以下原因可充当腺苷受体的竞争性抑制剂:其结构与其他甲基黄嘌呤(咖啡因、茶碱和可可碱)相似。人类的腺苷受体有四种亚型:A1、A2A、A2B 和 A3。这些腺苷受体已在豚鼠、大鼠和人眼的巩膜、视网膜色素上皮、脉络膜和视网膜中发现。巩膜是眼睛的主要部分,维持视觉器官和生化特性,可能导致眼睛过度伸长。胶原蛋白负责巩膜组织的强度和硬度。胶原蛋白占巩膜干重的 80%。眼轴长度与巩膜重塑、巩膜组织减少和胶原蛋白降解增加有关,导致巩膜成分改变。
图:7-MX 预防近视加深机制
腺苷受体直接参与眼睛的生长。腺苷受体还在形觉剥夺性近视中各种视网膜神经递质的活性中发挥作用。乙酰胆碱和多巴胺通过作用于腺苷受体来协调下游事件,这可能是近视的原因。7-MX 竞争性阻断毒蕈碱乙酰胆碱或多巴胺腺苷受体。这些受体直接参与调节在形式剥夺性近视或药物引起的实验性近视中观察到的各种视网膜神经递质,这会干扰神经传递,如上图。7-MX可抑制豚鼠和色素兔形觉剥夺性近视引起的近视和眼轴长度的进展,并增加后巩膜中胶原纤维的直径和浓度。
Trier教授和前述的几位原/现中山大学眼科中心的眼科专家教授为此共同做了大量的机制探索研究,不在此处一一赘述,见下图。
3.2.7 待解决问题
严谨出发,尚需要进行随机对照试验来确定7-MX在控制近视进展的确切疗效。然而与其他近视控制方法进行比较很困难,其他方法还没有使用类似方法的长期研究。而且目前所有研究的样本人群均集中在丹麦的儿童,所以目前待开展的全球性临床研究是非常必要的。另外根据目前研究来看,7-MX 实现的绝对效应大小似乎与年龄无关。在这点上这与阿托品滴眼液与角膜塑形镜相对有优势。
其次,与其他疗法的联合使用上,7-MX 的效果是否与光学设备或阿托品滴眼剂的效果相加还有待观察。已有研究显示在佩戴近视镜片的恒河猴中,发现 7-MX 治疗可增强远视表明7-MX 可能会提高旨在减少近视进展的光学设备的功效。而且作为一种口服治疗,7-MX 易于给药,可以方便地与眼镜和隐形眼镜结合使用。
再次,7-MX 存在一个显著问题,会从血流中快速消除,因此如果剂量增加到每天 3 次以上,疗效可能会进一步提高。或许更稳妥的解决方案是将 7-MX 作为缓释制剂,比如实现每天仅给药一次或两次即可维持稳定的血药浓度。
4 、结语
近视防控应用于儿童且作为长期用药,理想的药物应该没有毒性或毒性最小。目前,对于控制近视进展的药物疗法,似乎只有7-MX这种新分子在临床前和临床研究中均被发现有效且无毒。7-MX几乎实现了长期治疗近视的药物所需的所有特性。因此7-MX可能为近视提供另一种药物治疗选择。如果接下来的全球性三期临床试验开展顺利,这种一流的分子将改变近视治疗的前景,尤其是对于早发性近视的儿童,因为可用的治疗方法有限。
总之,7-MX显示出作为一种无毒、无副作用的口服近视控制药物的前景。
参考:
Theialife官网
https://mp.weixin.qq.com/s/JO5Jmt5KlicTte-onYl2-w
Trier相关研究https://pubmed.ncbi.nlm.nih.gov/?sort=date&term=Trier+K&cauthor_id=18385786