糖尿病的全球发病人数高达4.25亿人,其日益加重的疾病负担是一个重大的挑战,解决该问题对患者、护理人员、医疗系统和经济都有多方面的要求。在糖尿病患者中,7500 万人依赖胰岛素治疗。这些严重的胰岛素缺乏和胰岛素抵抗亚型患者需要通过注射或输注胰岛素、生活方式干预和持续血糖监测等综合措施严格控制血糖,以降低急性不良事件(高血糖和低血糖)的发生率以及心血管疾病或肾病、神经病和视网膜病变等长期并发症的发生率。虽然当前的注射胰岛素是一种广泛使用的疗法,但是依然有可能发生危及生命的低血糖事件。
来自澳大利亚悉尼大学的Nicholas J. Hunt和Victoria C. Cogger团队利用胰岛素共轭硫化银量子点与壳聚糖/葡萄糖聚合物的涂层,开发出一种反应灵敏的口服胰岛素纳米制剂。这种制剂对 pH 值有反应,在酸性环境中不溶解,在中性 pH 值下,人体十二指肠外植体和秀丽隐杆线虫(Caenorhabditis elegans)的吸收率增加。该制剂对葡萄糖苷酶敏感,可触发胰岛素释放。研究发现,该制剂口服后会分布到小鼠和大鼠的肝脏,并促进血糖的剂量依赖性降低,而不会导致患有糖尿病啮齿动物出现低血糖或体重增加。非糖尿病狒狒的血糖降低也呈剂量依赖性。在小鼠、大鼠和非人灵长类动物中未观察到生化或血液学毒性或不良事件。该制剂显示了口服控制血糖而不引起低血糖发作的潜力。相关工作以题为“Oral nanotherapeutic formulation of insulin with reduced episodes of hypoglycaemia”的文章发表在2024年1月2日的国际顶级期刊《Nature Nanotechnology》。
1. 创新型研究内容
口服胰岛素被认为可以模拟胰岛素的内源性释放,因此为这些挑战提供了解决方案。胰腺分泌的胰岛素大部分作用于肝脏,只有一小部分可避免肝脏清除而作用于全身。同样,在口服后,口服胰岛素首先通过门静脉循环输送到肝脏。然而,以往的口服胰岛素临床试验表明,口服胰岛素对降低低血糖发生率的作用微乎其微。口服胰岛素在长期坚持用药和药物可接受性方面也有一些优势,因为胰岛素注射对于儿童、老年人和新确诊的胰岛素依赖型 2 型糖尿病患者来说尤其具有挑战性,会导致他们回避、犹豫或延迟胰岛素治疗。此外,注射胰岛素在新的治疗领域(如认知障碍和阿尔茨海默病)并不被认为是一种可行的治疗方法,而在这些领域,注射胰岛素可能具有临床疗效。此前,本研究团队已证明硫化银(Ag2S)量子点(QDs)具有口服生物利用度,并能提高二甲双胍和烟酰胺单核苷酸的吸收率、口服生物利用度和肝细胞靶向性。这些药物本来就具有口服生物利用度,但与 QDs 共轭后,药效提高了 100-10,000 倍,并克服了与年龄相关的药效受损问题。本研究将这一纳米技术平台与 pH 值和酶敏感性封装聚合物结合应用于胰岛素。
【纳米载体对 pH 值敏感】
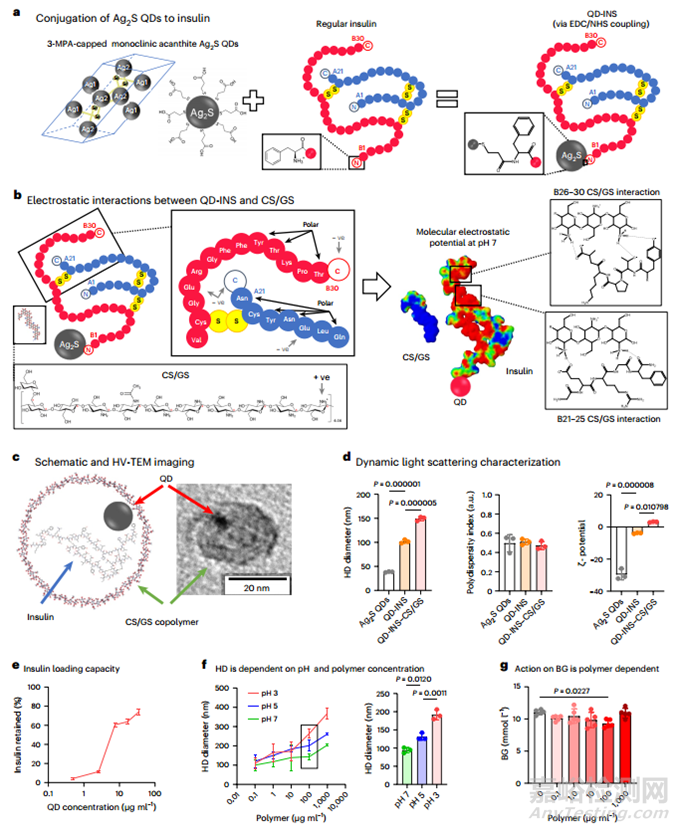
胰岛素口服给药最初面临的挑战是其在低 pH 值下的高溶解度和降解。本研究发现与单独使用胰岛素或 QDs 相比,将胰岛素附着在 Ag2S QDs 上可降低 QD 胰岛素(QD-INS)在低 pH 环境中的溶解度。利用 N-(3-二甲基氨基丙基)-N′-乙基碳二亚胺盐酸盐(EDC)和磺基-N-羟基琥珀酰亚胺(NHS)化学交联法,将可溶性胰岛素(pH 值为 3)结合到用 3-巯基丙酸(3-MPA)封端的 Ag2S QDs [直径为 6.5 ± 1.2 nm(通过透射电子显微镜(TEM)测量)]表面(图 1a)。胰岛素的附着是在 pH 值为 9 的条件下进行的,生成的是可溶的 QD-INS 溶液。透析后,可溶性 QD-INS 溶液的 pH 值为 7。傅立叶变换红外光谱(FTIR)显示,在透析过程中去除游离胰岛素后,QD-INS 具有与单独胰岛素相似的峰值,表明其附着。CS/GS 的化学结构是通过一维 1H 和二维 [1H,1H] 核奥弗霍塞尔效应光谱(NOESY)、核磁共振和傅立叶变换红外光谱确定的(图 1b)。在傅立叶变换红外光谱中,β-1,4 糖苷键非常突出,这是因为使用了脱乙酰化壳聚糖(葡糖胺单体),它们通过这些 β-1,4 糖苷键聚合。葡萄糖单体在形成糖原或淀粉时通常会形成 α-1,4 或 α-1,6 糖苷键;但在长链中,它们也可以形成 β-1,4 糖苷键,从而形成纤维素。CS/GS 似乎同时含有 α 和 β 糖苷键,因此在设计时就考虑到了这种降解形式,其分解会导致胰岛素的释放。
在 pH 值为 7 时,由于 QD-INS 的负ζ电位和 CS/GS 的正ζ电位,QD-INS 和阳离子共聚物通过静电吸引将 CS/GS 包覆在 QD-INS 上。在 α 和 β 链的 C 端,特别是 B21、25-27 和 30,可能促进了氢键的形成(图 1b)。将这些溶液混合后,形成了 20.0 ± 1.7 nm 的 CS/GS 纳米粒子,在 TEM 下可观察到其中同时含有 Ag2S QDs 和胰岛素(图 1c)。添加 CS/GS 增加了 QD-INS-CS/GS 的动态光散射测量的流体动力(HD)直径,而ζ电位的变化可以忽略不计(图 1d)。在具有 -OH 功能基团和胺基团的 QD-INS-CS/GS 的傅立叶变换红外光谱和核磁共振光谱中,CS/GS 涂层消除了胰岛素的指纹标记。将 QD-INS-CS/GS 在 37 ℃ 的 pH 值为 3 的溶液中培养以促进聚合物降解,这种效应是可逆的。不同浓度的胰岛素在 QDs 上的负载能力表明,胰岛素的最大保留率为 80%,根据摩尔比,每个 QD 上有 1-2 个胰岛素分子(图 1e)。
图1 口服胰岛素(QD-INS-CS/GS)的配制和表征
【胰岛素的释放是由 CS/GS 的酶裂解介导的】
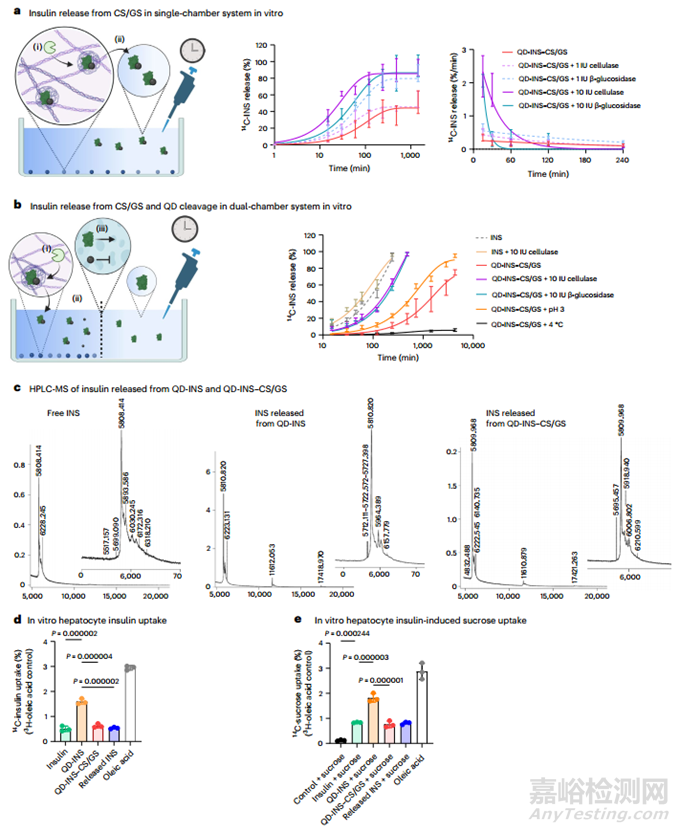
为了检查胰岛素有效载荷的释放情况,本研究在肝细胞培养物中与各种水解酶、低 pH 值和温度共孵育,测量了 QD-INS-CS/GS 的碳 14 (14C) 胰岛素 (14C-INS) 释放情况。与纤维素酶或β-葡萄糖苷酶共孵育明显提高了释放速度,在单室中 0.5 小时内释放了 50%(图 2a)。随后,本研究使用了一个由 10 kDa 透析管隔开的双室系统,只允许在第二个室中检测游离的(非 QD 连接的)胰岛素。与纤维素酶或β-葡萄糖苷酶共孵育会导致胰岛素在 1 小时内释放 50%(图 2b)。释放率随温度和 pH 值的降低而增加(图 2b),这表明 CS/GS 对酶降解,尤其是对β-葡萄糖苷酶的降解非常敏感。通过质谱分析,释放的胰岛素主要是单体(87.5%),少量存在二聚体(11.5%)和三聚体(<1.0%)(图 2c)。在 QD-INS 和 QD-INS-CS/GS 与单独的胰岛素之间观察到了类似的光谱峰(图 2c)。
本研究还在肝细胞培养物中评估了胰岛素和蔗糖的吸收。当与 QDs 共轭时,14C-INS 的摄取量增加了一倍,而与 QD-INS-CS/GS 共轭的制剂则逆转了这种效应(图 2d),这表明 CS/GS 与受体激活关键的 β 链 C 末端发生了相互作用。用 QD-INS-CS/GS 或 QD-INS-CS/GS 释放的胰岛素预处理肝细胞,突出表明 CS/GS 必须在胰岛素作用前降解,并显示 QD-INS 具有生理活性(图 2e)。
图2 QD-INS-CS/GS 的胰岛素释放量
【纳米载体提高人体肠道外植体的吸收率】
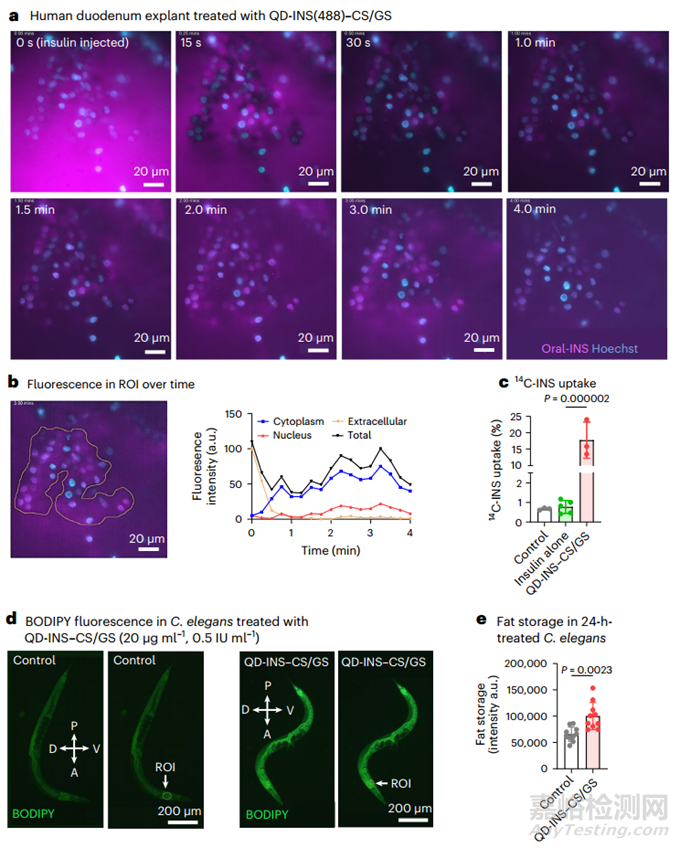
本研究使用人十二指肠外植体研究了肠道摄取情况,这与本研究团队之前在小鼠体内的研究类似。人十二指肠外植体细胞摄取的实时成像(图 3a)显示,2-4 分钟内的活体摄取主要集中在细胞质中(70%)(图 3b)。8 分钟后观察到内泡形成和外排。用 QD-INS-CS/GS 配制后,人十二指肠外植体对 14C-INS 的吸收率提高了 40 倍(图 3c)。
【胰岛素纳米载体促进秀丽隐杆线虫的脂肪储存】
本研究还在秀丽隐杆线虫(C. elegans)中对肠道吸收进行了验证。由于其肠道屏障和对胰岛素的生理反应,该模型可用于口服给药纳米技术的初步筛选。过量的胰岛素会抑制体内储存脂肪的释放和能量利用,促进脂肪储存。本研究观察到,与对照组相比,20 µg ml-1 QD-INS-CS/GS 与 OP50 大肠杆菌(大肠杆菌)以 1:1 的比例混合 24 小时的高剂量会增加前部脂肪储存(图 3d,e)。
图3 十二指肠外植体对 QD-INS(488)-CS/GS 的吸收率
【纳米载体提高了小鼠的生物利用度和疗效】
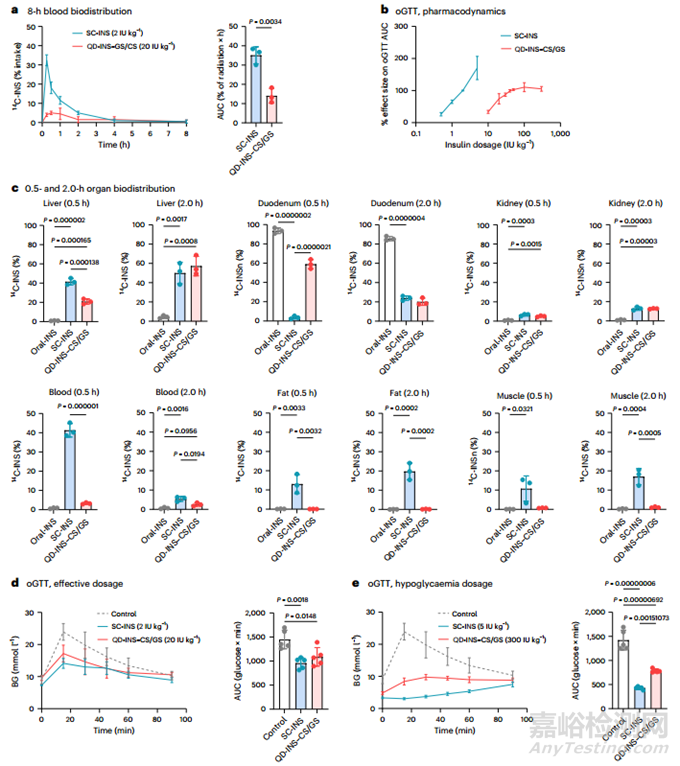
使用 14C-INS 评估了皮下注射胰岛素(SC-INS)和口服 QD-INS-CS/GS (20 IU kg-1)的生物分布。在 C57BL/6J 小鼠体内,QD-INS-CS/GS 的 Cmax 值为 0.06 IU ml-1,Tmax 值为 0.5 小时,T½ 值为 0.5 小时;相比之下,SC-INS(2 IU kg-1)的 Cmax 值为 0.1 IU ml-1,Tmax 值为 0.25 小时,T½ 值为 0.25 小时。根据血药浓度计算,口服 QD-INS-CS/GS 的生物利用度为 4%(图 4a)。
本研究还关注了 SC-INS、QD-INS-CS/GS 和不含纳米技术的口服胰岛素(Oral-INS)在全血、肝脏、肌肉、脂肪、十二指肠、肾脏和脾脏中的分布情况。0.5 小时后,SC-INS 在血液、肝脏和肌肉/脂肪中的分布比例分别为 40%、40% 和 20%(图 4b)。相比之下,QD-INS-CS/GS 在肝脏的分布比例为 20%,在肠道的分布比例为 60%(图 4c)。2 小时后,SC-INS 和 QD-INS-CS/GS 在肝脏、小肠和肾脏的分布比例分别为 50%、20% 和 10%。SC-INS在肌肉和脂肪中的分布更多,而QD-INS-CS/GS则只针对肝脏。口服-INS 仍留在小肠中。
通过口服葡萄糖耐量试验(oGTT)和口服葡萄糖前 15 分钟用 SC-INS 和口服 QD-INS-CS/GS 进行预处理,本研究关注了 C57BL/6J 小鼠的药效学效应。SC-INS(2 IU kg-1)和口服 QD-INS-CS/GS(20 IU kg-1)对 oGTT 曲线下面积(AUC)的降低作用相似(图 4d)。注射和口服胰岛素都出现了剂量依赖性效应(图 4b)。高剂量(5 IU kg-1)SC-INS 会引起低血糖(血糖 < 3.0 mmol l-1),而口服胰岛素即使在 300 IU kg-1 的剂量下也不会引起低血糖(图 4e)。QD-INS-CS/GS 的单个成分(QD,0.6 µg;胰岛素,20 IU kg-1;CS/GS,10 µg)也通过 oGTT 进行了检测。没有观察到单个材料或单独口服胰岛素(100 IU kg-1)对 AUC 有任何影响。
图4 单剂量 SC-INS、QD-INS-CS/GS 和单独口服胰岛素的药代动力学和药效学研究
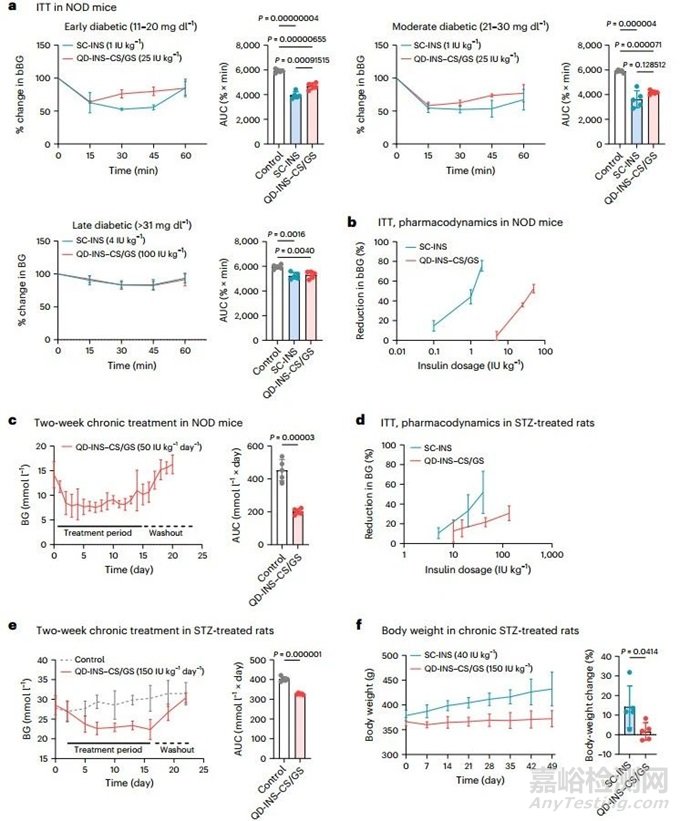
【胰岛素纳米载体在 T1D 动物模型中发挥疗效】
本研究在以下 T1D 动物模型中比较了 SC-INS 和 QD-INS-CS/GS 单剂量和/或慢性治疗的药理作用:非肥胖糖尿病(NOD)小鼠(自身免疫诱导的 T1D)和接受链脲佐菌素(STZ)(单剂量 65 mg kg-1)治疗的大鼠(毒素诱导的 T1D)。在 NOD 小鼠中,SC-INS(1 IU kg-1)和 QD-INS-CS/GS(25 IU kg-1)都能在 15 分钟内降低血糖,并使 ITT AUC 降低 40%(图 5a)。随着剂量的增加,这两种药物的血糖降低也呈现剂量依赖性(图 5b)。慢性 2 周 SC-INS 给药或在饮用水中自由给药 QD-INS-CS/GS 表明,QD-INS-CS/GS 可在治疗期间维持血糖小于 11.1 mmol l-1。这种效应在 7 天的冲洗期后逆转(图 5c)。经 SC-INS 治疗的小鼠在治疗后 1 小时血糖下降,随后在治疗后 8 小时恢复到基线水平。在重度糖尿病 STZ 大鼠(血糖 > 30 mmol l-1)中,注射胰岛素和口服胰岛素对血糖的降低具有相似的剂量依赖性(图 5d)。慢性用药是通过使用 SC-INS 或在饮用水中自由给药 QD-INS-CS/GS 进行为期 2 周的治疗。在治疗期间,QD-INS-CS/GS 可将血糖维持在 15-25 mmol l-1 的较低水平,而在 3 天的冲洗期后,这种效应消失(图 5e)。持续 6 周的治疗表明,SC-INS 大鼠的体重增加了 30%,而接受 QD-INS-CS/GS 治疗的小鼠体重没有变化(图 5f)。这些大鼠的血清生化或血脂也没有变化。
图5 在 NOD 小鼠和 STZ 治疗大鼠中使用 SC-INS 和 QD-INS-CS/GS(口服胰岛素)进行单剂量和 2 周每日治疗的药效学研究
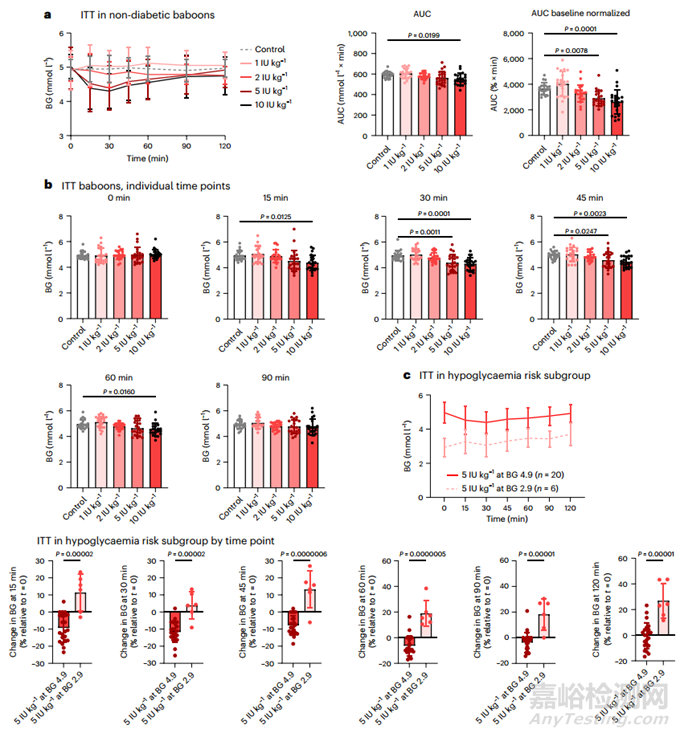
【胰岛素纳米载体在非人灵长类动物中发挥疗效】
为了检验 QD-INS-CS/GS 在临床应用中的有效性和准备情况,本研究对来自美国国家狒狒群落的非糖尿病狒狒进行了研究,BG 和毒性数据收集工作均独立进行。每只狒狒都在一夜禁食后进行了 ITT;在基线和口服 1-10 IU kg-1 胰岛素后收集数据(图 6a)。使用 5 和 10 IU kg-1 的 QD-INS-CS/GS 治疗可使血糖分别下降 10% 和 13%,在 15-30 分钟内即可观察到效果(图 6a)。即使在初始血糖为 2.9 mmol l-1 的狒狒子群中,单次剂量为 5 IU kg-1 的 QD-INS-CS/GS 也不会导致任何狒狒出现低血糖。对血糖为 4.9 mmol l-1 的狒狒施用相同剂量可使血糖降低 10%(图 6c)。试验后进行的血液生化、血脂和血液学评估显示,没有超出参考范围的变化。此外,未报告任何不良事件,包括任何低血糖发作。
图6 非糖尿病狒狒的 ITT
2. 总结与展望
总之,胰岛素与带有 CS/GS 聚合物涂层的 Ag2S QDs 共轭过程在 CSIRO 的生产过程简单且具有可重复性。该产品促进了胰岛素的口服吸收和肝脏靶向性。在小鼠、大鼠和狒狒身上,该产品显示出剂量依赖性效应,低血糖发生率降低,且无毒性。这些研究为在人体中评估这种制剂、正在进行的毒性和临床研究奠定了基础。这项技术旨在成为口服多肽给药的平台。它适用于作用于肝脏(如干扰素-α)或其他器官(如胰腺的胰高血糖素样肽-1 促效剂(利拉鲁肽))的多肽和蛋白质。
文章来源:https://www.nature.com/articles/s41565-023-01565-2