美国总统乔·拜登签署立法,新药无需在动物身上进行测试即可获得FDA的批准,这取代了1938年罗斯福签署《联邦食品、药品和化妆品法案》中的规定,即在动物中测试潜在药物的安全性和有效性。
著名的“反应停”(沙利度胺)致多达1.2万名的婴儿出现短肢畸形事件后,新药筛选通常需要采用多个物种的动物来进行。此后,正常一款新药临床前研究需要用到至少60只实验猴,新冠后更是出现了天价猴、一猴难求的种种现象。
事实上,公司在新法案签署前为了使药物在美国获得批准(FDA通常要求对一种啮齿动物(如小鼠或大鼠)和一种非啮齿动物(如猴子或狗)进行毒性测试),每年使用数以万计的动物进行此类测试,但是动物模型并不能完全模拟人类生物系统的复杂性,其中有超过9/10的进入人体临床试验的药物因不安全或无效而失败,即动物实验并不完美,动物模型研究到临床评估的成功转化能力不足10%!
全球药物研发几十年的“游戏规则”被新法案改写,单纯的非动物模型可能很难取得FDA的信任(换句话说,FDA可不一定买账!)。虽然如此,新法案的实施催生了包括类器官在内新替代方式的发展。
下文我们来了解一下今天的主角---类器官。
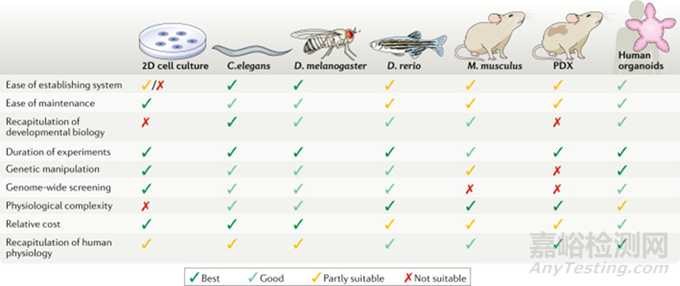
二维细胞系和动物模型已经在细胞信号转导、筛选化合物、识别潜在靶点和阐明病理机制等方面得到了成功的应用,尽管如此,优化目前系统模型以消除其局限性对现代医学发展具有深远意义。
目前最常用的模式生物是酿酒酵母、秀丽隐杆线虫、黑腹果蝇、斑马鱼和普通家鼠。对于癌症研究,还使用患者来源的异种移植物(patient-derived xenografts, PDX)和癌细胞系。
图1:类器官与其他模型系统的比较
类器官不同于细胞球体,它是部分或全部的多细胞结构。类器官是体外小型化和简化的三维结构,具有构成器官的多种器官特异性细胞类型。类器官应该满足:1)它们由靶器官的细胞组成;2)具有靶器官的特定结构;3)它们可以再现靶器官的特定功能。球体模拟实体瘤用于癌症治疗,类器官则提供了研究器官对象的形态、功能和疾病相关模型。
图2:类器官是体外小型化和简化的三维结构
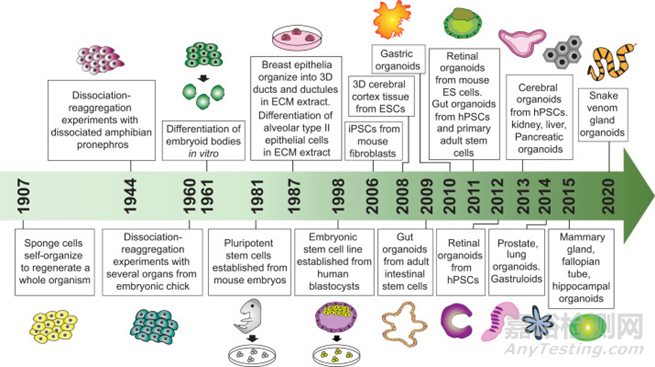
类器官相关研究早在上个世纪就开始了,而第一个类器官是2009年Hans Clevers小组产生的类似于天然肠道组织上皮的隐窝状结构,开辟了类器官发展的一个新纪元。
图3:类器官培养物开发的时间轴
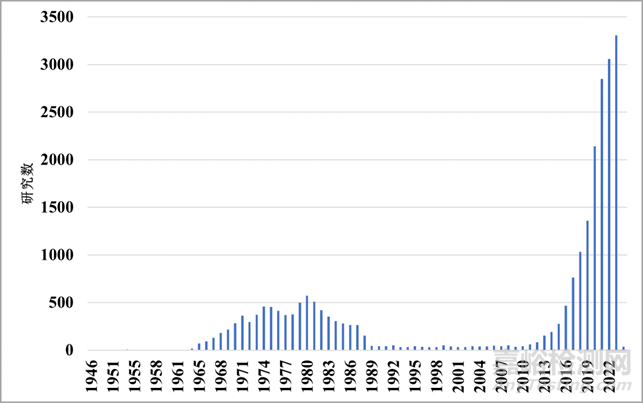
在PUBMED上以“类器官(organoids)”为关键词进行所搜发现类器官的研究在
1966-1988年间首次出现爆发(研究数>50篇),归因于通过细胞解离和再聚集实验来描述器官发生的经典发育生物学实验的研究。类器官研究的复兴在2010年后,但形式有所不同:类器官被定义为干细胞生长的3D结构,由器官特异性细胞类型组成。
图4:PUBMED上以“类器官(organoids)”为关键词进行所搜得到的研究数(篇)
类器官来源于多能干细胞(pluripotent stem cells (PSCs))(胚胎干细胞、诱导多能干细胞(iPSC))和成体干细胞。其中,胚胎干细胞有一定的伦理问题,而肿瘤患者穿刺等活检也可以是类器官来源之一。多能干细胞在3D培养过程中可聚集形成拟胚体,并诱导分化产生外胚层、中胚层和内胚层后最终形成特定组织的类器官。
图5:类器官生成的示意图
目前采用的类器官方法包括浸没式培养、气液界面培养和诱导多能干细胞中产生。
图6:Organoid methodologies
研究者可以通过添加特定的生长因子来促使产生不同类型的类器官,常见的是细胞外基质,但是动物源Matrigel批次差异大,异质性往往会造成结果不稳定,尤其是神经发育和脑部疾病研究领域。类器官芯片技术的产生会加速类器官领域的发展,稳定高通量技术会产生更加稳定可靠的器官模型。
人类类器官的两个主要应用是人类遗传疾病的建模和新治疗策略的开发。
图7:类器官应用示例
接下来,我们来了解下目前临床现状:
以“organoid”为关键词在ClinicalTrials(https://classic.clinicaltrials.gov/)进行搜索,相关临床试验多达197项。以“类器官”为关键词在“中国临床试验注册中心”(https://www.chictr.org.cn/index.html)进行搜索,登记的类器官相关临床试验仅有 49 项(数据均截至2023年12月)。
图8:以“organoid”为关键词在ClinicalTrials进行搜索的相关临床试验分布(197项)(截至2023年12月数据)
图9:以“类器官”为关键词进行搜索得到的相关临床试验(2017-2023年)
临床试验中相关类器官研究探索和建立人体来源样本的各种类器官模型,用于药物筛选(ChiCTR2100051210/NCT05351983)、预后相关的评价和预测(NCT04777604)、检测药物敏感性(ChiCTR2200063320 /NCT03453307)等来探索其用于指导治疗方案选择的可行性。绝大部分是肿瘤相关类器官的研究,还有少量肠道类器官以及关于脑/肺/肾/子宫内膜和胚胎等类器官的临床试验(NCT03256266 et al)。
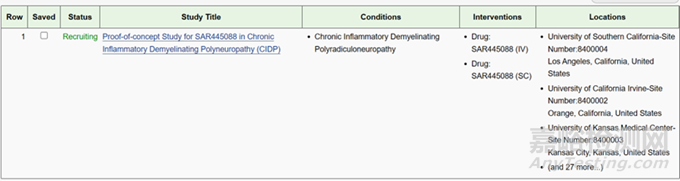
2022年FDA批准了没有动物实验疗效数据的而是基于类器官芯片技术的临床试验( NCT04658472),用于新适应证(自身免疫脱髓鞘疾病) 的治疗。这是全球首个完全基于体外微生理系统研究获得临床前数据的新药获批进入临床试验,表现了FDA对新技术---类器官芯片研究的信任,是器官芯片技术发展应用的一个重要里程碑,这一重大批准为上千种没有动物模型的疾病提供了临床研究的新渠道!
图10:类器官芯片技术的临床试验( NCT04658472)信息
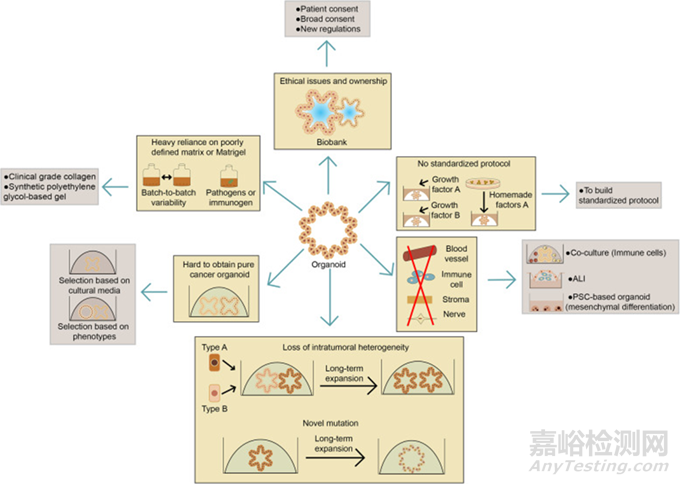
尽管类器官发展较快,但是也存在一些挑战。
首先,针对类器官的培养方法没有统一的标准化方法。类器官培养物中存在混合细胞群,需要不同的营养条件,而实验室有着自己的培养条件,这使得研究会产生差异化的实验结果。
其次,类器官的培养过程中需要使用到基质胶或其他基于动物的基质提取物来使其形成3D结构,而这些物质成分往往存在批次差异。
第三,获得纯的肿瘤类器官是研究人员面临的另一个关键问题,肿瘤类器官可能过度生长并被正常类器官污染。而且,肿瘤类器官在传代过程中可能会失去肿瘤内异质性和长期扩增发生突变问题。
第四,对于成体干细胞衍生的类器官,仅代表器官的上皮室,而缺乏血管,免疫细胞,基质和神经。
最后,基于活体人体组织的模型的开发中,该模型可以存储在生物库中并被扩增利用,会引发伦理问题。
图11:类器官培养开发中局限性(黄色)和解决方法(棕色)
同FDA文件生效,国内政策支持也是近两年国内类器官赛道火热的重要原因。
2021年1月科技部下发文件将“基于类器官的恶性肿瘤疾病模型”列为“十四五”国家重点研发计划中首批启动重点专项任务,而同年11月中国CDE首次将类器官列入基因治疗及细胞治疗的验证指南基因治疗产品非临床药理学研究。次年7月中国首个类器官指导肿瘤精准药物治疗的专家共识面世。
图12:CDE官网通告(2021年第49号)
类器官整个行业都还处于比较早期的阶段,行业处于起步阶段,国内外也新兴一批类器官研究公司。国内起步发展较晚,国内类器官公司主要分布于广深、长三角以及北京。
表1:部分类器官相关公司(据公开资料整理)
|
公司 |
国家 |
成立时间 |
技术 |
|
Epistem |
英国 |
2000 |
提供肠道类器官模型(人以及动物模型) |
|
大橡科技 |
中国 |
2013 |
研发和生产人替器官芯片和类器官 |
|
Xcell |
美国 |
2014 |
类器官培养基 |
|
科途 |
中国 |
2016 |
培养基优化筛选、药筛等 |
|
System 1 |
美国 |
2017 |
自动化生产类器官 |
|
吴佰生物 |
中国 |
2019 |
NA |
|
丹望医疗 |
中国 |
2019 |
癌症类器官构建、肿瘤类器官药敏检测 |
|
弘瑞医疗 |
中国 |
2021 |
药筛等 |
|
明澳生物 |
中国 |
2021 |
类器官培养基优化平台、高通量药物测试技术平台 |
政策的利好为商业化带来更多空间,类器官技术距独当一面尚有一段距离,研究的需求在未来一定会增加,类器官技术要用实际数据去说服更多人。愿国内外新兴类器官研究公司乘上政策东风,能为行业带来真正突破,为患者解决实际问题。