抗体偶联药物 (ADC) 是一类新兴的强效生物药物,它通过合适的连接子将强效细胞毒性有效载荷与工程化单克隆抗体结合起来,实现其偶联化合物的组织特异性递送。该抗体通过靶向肿瘤细胞表面表达的特定抗原,帮助将偶联的有效载荷递送到特定的疾病部位。因此减少了因旁观者效应引起的副作用,提高了治疗指标。尽管有100多种ADC处于临床试验阶段,但FDA批准临床使用的ADC只有14种(截止原文发表)。14种获批药物中,有7种用于临床治疗血液系统恶性肿瘤,7种用于治疗实体肿瘤。由于脱靶毒性和低疗效,大多数ADC在临床阶段停止或终止,超过100种ADC正在临床试验中。
不完善的连接/偶联方法以及分子量、连接子长度、位阻、半衰期、异质性和合适关键组分的选择等理化因素是导致ADC不成功的根本原因。具有靶向合适抗原的抗体、连接子和化学稳定的有效载荷的ADC可以精确靶向肿瘤细胞,提高治疗指数。选择肿瘤区域特异性的抗原和抗体可以减少脱靶毒性和旁观者效应。理想的连接子有助于通过防止脱靶载荷来提高ADC的稳定性。有效载荷应具有高效力,较低的半数最大抑制浓度 (IC50) 值以及对体循环理化条件的稳定性。
在本文中,我们将讨论关键成分及其对ADC疗效的重要作用或贡献。此外,我们还介绍了偶联方法的最新进展。此外,我们还将重点介绍了ADC的作用模式、当前的挑战和未来的前景,以克服当前的挑战。本文将深入探讨成功的ADC开发过程中应考虑的关键因素。
ADC的关键部件
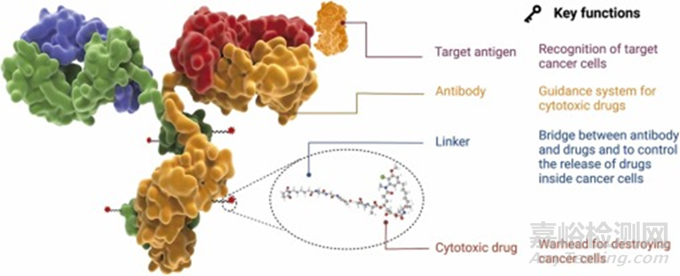
ADC由抗体、连接子和细胞毒性有效载荷组成 (图1)。ADC的每一个组成部分都起着至关重要的作用,使ADC稳定以及潜在地使副作用最小化。理想的ADC应能有效地到达靶点而不释放任何脱靶载荷,并具有杀死肿瘤细胞而不影响正常健康细胞的效力。为了开发一种有效的ADC,必须考虑抗原、抗体、高毒性载荷以及连接子的选择等因素。
图1. ADC的原理图,展示了关键部件及其重要作用。ADC的关键成分包括抗体、连接子和细胞毒性药物 (有效载荷)。抗体帮助ADC获得靶向特异性结合,有效载荷有助于破坏肿瘤细胞。此外,连接子在抗体和有效载荷之间起桥梁作用,控制药物脱靶释放和不良副作用。
抗原的选择
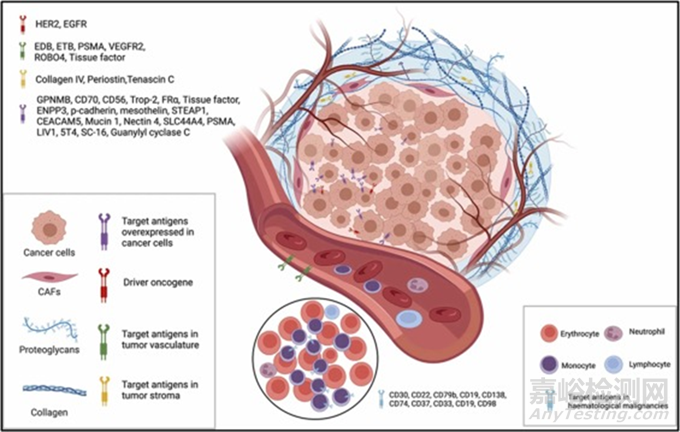
靶抗原有助于区分肿瘤细胞和正常细胞,从而降低脱靶毒性。因此,选择合适的靶抗原是开发理想ADC的第一步。理想的抗原必须具有某些特征,如i)与健康细胞相比,它应该在肿瘤细胞表面过表达。例如,人表皮生长因子受体2 (HER2) (三阳性乳腺癌的靶抗原) 在肿瘤细胞中的拷贝数是正常细胞的100倍。ii) 靶抗原的结合位点应面向肿瘤细胞的外表面,而不是面向肿瘤细胞的内部,使从血管扩散的ADC能够在内化之前与靶抗原结合;iii) 靶抗原不应进入体循环,以避免ADC在肿瘤外的不必要结合;iv) 靶抗原应具有内化结合ADC的效力。在已批准和处于临床期的ADC中,最常用的血液和实体瘤靶点分别是CD33、CD30、CD22、BCMA、CD19、CD79B和HER2、Nectin-4、Trop-2、EGFR、组织因子(TF) 。此外,细胞外基质成分、促进血管生成的因子和肿瘤微环境成分已被报道为杀死肿瘤细胞的可能靶点,并在临床前和临床阶段显示出其效力。计算机模型的最新进展有助于更快、更经济地选择靶抗原。在这种方法中,与包含基因组数据,特别是最丰富的肿瘤类型的mRNA分析数据,的公开可用数据库进行比较分析。主要数据库有肿瘤基因组图谱(Cancer Genome Atlas, TCGA) 和基因组织表达(Gene-Tissue Expression, GTEx)。
图2. 示意图为肿瘤细胞和肿瘤微环境中最常用的靶抗原。靶点包括过表达的表面抗原、肿瘤微环境如ECM成分、血管生成支持因子等。图2解释了主要使用的靶抗原。缩写:HER2(人表皮生长因子受体2)、EGFR(表皮生长因子)、ETB(内皮素受体)、PSMA(前列腺特异性膜抗原)、VEGRF2(血管内皮生长因子受体-2)、ROBO4 (Roundabout同源物4)、GPNMB(糖蛋白非转移性黑色素瘤蛋白B)、ENPP3(外核苷酸焦磷酸酶/磷酸二酯酶3)、STEAP1(前列腺六跨膜上皮抗原1)、CEACAM5(肿瘤胚抗原相关细胞粘附分子5)、SLC44A4( 溶质载体家族44成员4),CAFs(肿瘤症相关成纤维细胞)。
抗体的选择
在理想ADC中,抗体是与靶抗原特异性结合的重要载体。抗体必须对靶抗原具有高结合亲和力和低免疫原性。此外,抗体应具有维持较长的血浆半衰期和快速内化的能力。在过去的几十年里,小鼠抗体 (小鼠衍生)被用于ADC,但具有高免疫原性和针对抗体的适应性免疫反应。经过重组技术的发展,嵌合抗体最终于1988年被开发出来。嵌合抗体是将小鼠衍生的可变区与人衍生的恒定区融合而成。而人源化抗体则是将小鼠源性抗体的互补决定区 (CDR) 与人抗体的可变区结合在一起。人血清中共存在5种抗体。其中免疫球蛋白G (IgG) 类是最丰富的血清抗体,约占总抗体的70-85%,半衰期约为21天。由于IgG具有最丰富的抗体种类和启动免疫效应的效力,因此IgG是ADC发展中最常用的抗体。此外,IgG类抗体有IgG1、IgG2、IgG3和IgG4 4类亚类。在这四个亚类中,IgG1是ADC发展中使用最多的抗体,并已被证明是一种有效的免疫效应器。一般来说,抗肿瘤抗体药物通过Fc介导的效应功能起作用,如抗体依赖性细胞介导的细胞毒性 (ADCC)、补体依赖性细胞毒性 (CDC) 以及抗体依赖性细胞吞噬 (ADCP)。基于铰链区域的长度、链间二硫键和Fc效应功能,IgG的每个抗体亚类都是独一无二的。为了获得最佳的ADCC效果,最小值为10^ 5-10 ^6个靶抗原应在肿瘤细胞表面表达。虽然IgG1对FCYR具有很高的结合亲和力,但与其它亚类相比,IgG1诱导ADCC和CDC更有效。ADC的半衰期取决于与Fc受体的结合亲和力。工程Fc部分在增加结合亲和力方面起着至关重要的作用。例如,在一项研究中,作者描述在缺乏人类IgG1 (N-链寡糖)的情况下,IgG1对FcYrIII具有更强的结合亲和力,同时能够诱导更多的ADCC。

图3. 该示意图代表了基于抗体的疗法的作用模式。A) 解释了双特异性抗体的结构和作用方式。双特异性抗体能够同时结合两种不同类型的靶标。一只手臂与效应细胞 (如自然杀伤细胞和T细胞)结合,另一只手臂与靶抗原结合。这种现象激活效应细胞,破坏肿瘤细胞。B) 解释了基于抗体的治疗方法杀死靶向肿瘤细胞的原理。帮助抗体杀死肿瘤细胞的三种最重要的机制是ADCC、CDC和ADP。在ADCC中,抗体的Fc区与Fcγ受体结合,在效应细胞表面表达,同时与靶细胞结合。抗体与Fcγ受体结合触发效应细胞的激活,并分泌穿孔素、颗粒酶和其它细胞毒性产物,杀死肿瘤细胞。在CDC中,一种抗体结合靶细胞和C1q组分,诱导肿瘤细胞表面形成膜攻击复合物,导致肿瘤细胞死亡。在ADP中,抗体与靶细胞和巨噬细胞结合,通过巨噬细胞吞噬靶肿瘤细胞。
IgG2在体内通过非共价结合和高温形成二聚体。此外,由于位阻,降低ADC的血浆浓度,ADC的效力降低。IgG3的半衰期很短,约为7天,因此降低了ADC的治疗效果,并且在半衰期增加的同时不能改善Fc介导的效应物功能。尽管IgG4具有诱导ADCC的能力,但它含有fab臂交换,导致有效性降低。内化是影响ADC疗效的另一个主要因素。特别是在实体瘤中,抗体应具有较长的半衰期以及在体循环中的高稳定性,通过滞留和渗透作用有效到达肿瘤部位。然而,为了获得满意的疗效,ADC应在整个肿瘤中均匀分布,ADC分布不均匀会导致疗效不理想。解离常数 (Kd) 是影响ADC内化至肿瘤细胞的主要因素。Kd越低,抗体与存在于肿瘤细胞表面的新生Fc受体 (FcRn) 的结合亲和力越高,导致疗效较低。因此,理想情况下,Kd应该高,以便有效穿透并均匀分布在整个肿瘤细胞中。因此,在成功开发ADC时应考虑所有这些参数。此外,抗体的分子量是影响ADC进入肿瘤细胞的另一个关键因素。IgG抗体分子量约为150千道尔顿 (KDa)。由于ADC的高分子量,使其穿透血管到达肿瘤部位成为一个具有挑战性的部分。因此,理想的ADC开发应考虑较小的Ab尺寸。为了克服这一问题,一种低分子量ADC被开发出来,目前正在研究中。在这些ADC中,有效载荷与抗体的小片段或抗体的成分结合在一起。
连接子
连接子是抗体和有效载荷之间的桥梁,对ADC的稳定性和有效性起着重要作用。此外,有效载荷的释放也主要取决于连接子的类型和性质。理想的连接子应具有高度的水溶性,防止ADC聚集的形成以及有效载荷在体循环中的过早释放。一般情况下,可以对ADC的抗体、连接子和有效载荷等3个组成部分进行修改,从而获得稳定、有效的ADC。影响连接子稳定性和载荷释放的三个主要因素是偶联位点、位阻和连接子长度。
通过选择特定的偶联位点和修饰的连接子,已经开发了一些不同的方法来获得稳定的ADC。
对ADC的稳定性的影响
偶联位点是影响ADC稳定性的主要因素,其次是影响其疗效的因素。例如,在一项研究中考察了将半胱氨酸偶联位点工程置于HER2/neu抗体不同位点的影响,结果对于稳定性存在差异。偶联位点可以在体循环中对逆迈克尔反应介导的有效载荷损失产生抗性。它还可以影响体内非特异性缬氨酸-瓜氨酸(Val−Cit)的解偶联。也有报道称,偶联位点还可以通过降低代谢负荷来提高ADC的疗效。这项研究表明,偶联位点对ADC的稳定性起着至关重要的作用。
根据研究,偶联位点产生空间屏蔽,导致ADC稳定性的变化。单克隆抗体提供的空间屏蔽调节连接子的解偶联和有效载荷的代谢。例如,HC-A140、HC-A118和LC-K149等偶联位点周围的高空间屏蔽提高了ADC的稳定性,同时降低了组分溶剂可及性 (FSA)。另一个因素是连接子长度,据报道通过单克隆抗体与有效载荷之间的距离影响空间屏蔽,导致ADC稳定性的变化,[39]。与长度较长的连接子相比,较短的连接子具有更好的ADC稳定性。较短的连接子使有效载荷更靠近抗体提供的空间屏蔽体。理想情况下,连接子应该在体循环中稳定,并在目标肿瘤细胞中以化学或酶的方式解偶联。有效解偶联连接子、以释放足够量的有效载荷是ADC有效性的关键因素。已经有研究考虑了各种连接子的改性技术以及连接子的化学性质。本文将讨论两种主要的连接方法:马来酰亚胺连接和二硫键连接。马来酰亚胺可用于可切割和不可切割的连接子。而可切割连接子采用二硫键。在这两种连接体系中,最关键的因素是在解偶联位点上形成的位阻,这可以通过多种化学修饰技术来实现。
对载荷释放的影响
有效载荷的快速释放取决于用于连接单克隆抗体和细胞毒性有效载荷的偶联/连接技术的类型。对于基于不可切割连接子的ADC,通常抗体通过溶酶体蛋白酶水解,形成小肽-有效载荷偶联物。而在可切割连接子的情况下,一个游离的未修饰的有效载荷释放在溶酶体内部。这些ADC经过化学或酶的裂解。因此,有效载荷的释放速率取决于连接子的解偶联方法和连接子的破坏步骤。马来酰亚胺法和二硫键法都影响其释放速度。含有马来酰亚胺连接子的ADC释放其有效载荷的速度比含有二硫化物连接子的ADC更快。因此,偶联位点对有效载荷释放速率有很大的影响。如LC-K149、LCV205、HC-A140、HC-A118位点之间的比较研究发现,HC-A118C释放有效载荷的速度比LC-K149快15 min。偶联位点的位阻增加了ADC的稳定性,但降低了载荷释放率。例如,根据研究,通过环丙基与环丁基连接子的比较,发现环丙基类似物在肿瘤细胞中释放有效载荷的效果不如环丁基。
因此,为了有效地释放有效载荷而对ADC进行修改是另一个关键且具有挑战性的因素。总之,偶联位点、连接子位阻和连接方式是影响ADC稳定性和有效性的主要因素。
有效载荷
有效载荷是ADC的弹头,是一种高细胞毒性药物。理想的ADC应具有强效性,对全身循环中多种代谢或分解代谢过程中的任何化学反应都具有稳定性,溶解度高。此外,它还应具有偶联和膜透性的官能团。
尽管由于溶酶体屏障和肿瘤微环境的复杂性,很少有细胞毒性药物能到达靶点,但低IC50值的有效载荷应该是一种高效的理想ADC的选择。DAN破坏类有效载荷的IC50值为皮摩尔浓度,而微管抑制剂的IC50值为纳摩尔范围。例如,Duocarmycin、Pyrolobenzodiazepines的IC50值分别为1-10 pM和0.1-1 pM,对肿瘤细胞的杀伤效率很高。此外,另外两种被认可的脱氧核糖核酸(DNA)损伤强效细胞毒有效载荷是Calicheamicins和Exatecans,IC50值分别为0.1-1 nM和1-10 nM。在稳定性方面,有效载荷应该在系统循环和生产过程中对任何化学反应都是稳定的。不稳定的有效载荷可以转化为前药形式,在血液循环中转化为活性形式,导致不良副作用。如果有效载荷在溶酶体状态下不稳定,则应在细胞表面或进入细胞之前将有效载荷分离。特别是,对溶酶体蛋白酶不敏感的有效载荷不应用于不可切割的连接子。以α氨基酸和酯为官能团的有效载荷通常对溶酶体蛋白酶不稳定。高效液相色谱 (HPLC) 技术可以通过两种方式分析有效载荷的稳定性。首先,将含有放射性标记有效载荷的ADC与细胞孵育。然后,用分离的溶酶体孵育未结合的有效载荷。
在溶解度和膜渗透性方面,一般来说,由于抗体的蛋白质性质,偶联过程是在水环境中进行的,可能是水不相容的有机溶剂。然而,具有疏水性的有效载荷需要大量的有机溶剂进行偶联。过度使用有机溶剂会使抗体变性。此外,疏水载荷可以改变药代动力学性质并形成聚集。因此,应该使用最佳数量的有机溶剂,并且可以选择水溶性有效载荷来避免上述复杂性。如果ADC本质上是可切割的,那么它应该是亲水的,以支持ADC获得水溶性。为了通过细胞膜进入,所选择的有效载荷本质上应该是亲脂性的,并且可以通过溶酶体膜到达靶点。
偶联方法
连接方式和连接位置也是设计理想ADC的关键因素。它可以调节有效载荷释放的位置和速率,最终与ADC的安全性和有效性相关。这里,我们将描述用于结合抗体和有效载荷的技术。
工程半胱氨酸
工程半胱氨酸残基允许细胞毒性载荷均匀分布在整个ADC。IgG类抗体含有8个半胱氨酸键,可以通过特异性工程获得2-4的药物抗体比 (DAR)。Seattle Genetics、Genentech、MedImmune、诺华和辉瑞等多家公司都将其作为开发方向。根据工程半胱氨酸的数量,ADC形成均匀的化学计量结果,DAR约为2或4。与传统ADC相比,这些ADC在临床前阶段显示出巨大的潜力和耐受性。然而,由于马来酰亚胺与白蛋白、游离半胱氨酸或谷胱甘肽中的活性硫醇交换,高溶剂可及性位点在血浆中迅速失去了偶联巯基反应性连接子。为了克服这一挑战,在带正电的环境中,一个部分可达的位点促进了连接子中琥珀酰亚胺环的水解,从而阻止了马来酰亚胺交换反应。研究表明,靶向CD33的SGN-CD33A对急性髓性白血病 (AML) 细胞系具有较高的抗肿瘤活性。SGN-CD33A含有一种工程抗CD33A,其具有高效的吡咯苯二氮卓二聚体,通过蛋白酶可切割连接子连接。此外,根据研究,砜与硒代半胱氨酸的偶联提高了ADC在人血清中的稳定性。此外,在THIOMABs中,这种砜连接子标记了工程半胱氨酸残基,并增加了血浆中的稳定性。因此,偶联位点的结构和化学特性通过影响ADC的稳定性来影响其性能。
聚糖修饰
一般来说,抗体在Fc区有一个糖基化链。N297残基具有N-糖基化位点,是修饰的中心。化学氧化、代谢工程、化学-酶或酶修饰等几种方法已被开发用于修饰天然抗体的碳水化合物基团(N-聚糖)。
鉴于此,腙化学可用于修饰未修饰的单克隆抗体的聚糖。为了氧化碳水化合物基团,使用高碘酸钠形成醛基。但由于在氧化过程中使用了苛刻的条件,蛋氨酸残基也会被氧化,并存在于FcRn结合位点上。而且,蛋氨酸的氧化过程会影响其结合亲和力,降低血清半衰期。
代谢工程是提高均匀性的另一有效方法。在该方法中,一种岩藻糖衍生物,即6-硫代岩藻糖取代单克隆抗体上存在的天然岩藻糖,并通过马来酰亚胺基团偶联有效载荷。然而,所有这些方法都有不必要的并发现象,应该注意。深入了解影响每种修饰的因素可能有助于未来开发强大的靶向治疗。
酶定向修饰
酶定向修饰,其中酶特别作用于氨基酸,选择性地将有效载荷附加到特定位点。转肽酶 A (SrtA) 催化转肽化反应,将SrtA识别肽插入轻链和重链的C端,然后通过转肽化反应加入美登素或单甲基奥瑞他汀(MMAE)。Redwood开发了一种SMARTag,利用甲酰基甘氨酸生成酶 (FGE) 将Cys-X-Pro-X-Arg序列插入到抗体中,导致半胱氨酸被甲酰基甘氨酸取代。然后,修饰后的单克隆抗体通过肼- Pictet - Spengler连接特异性结合到含醛的载荷物上。另一种通过细菌转谷氨酰胺酶 (BTG) 进行位点特异性偶联的方法在生物过程中起着至关重要的作用。转谷氨酰胺酶通过共价键在赖氨酸的伯胺和谷氨酰胺的酰胺基团之间形成酰胺键。然而,根据研究,与其它TG相比,从莫巴氏链黄霉中收集的BTG含有一个非典型的催化位点,并且它不会在赖氨酸的伯胺和谷氨酰胺的酰胺基之间形成键。Innate Pharma开发的一种ADC,通过BTG将MMAE与IgG1结合。这种BTG介导的ADC形成高度稳定的键,DAR为2。
半胱氨酸再桥接
半胱氨酸再桥接是一种很有前途的技术,可以在不需要对抗体进行任何特异性工程的情况下开发出均匀稳定的ADC。这些ADC在体外和体内模型中均表现出较高的疗效,具有较高的结合能力和血浆稳定性。这项技术吸引了几家公司,如Igenica, Sorrento Therapeutics, ThioLogics, biotheraptics。
氨基末端工程丝氨酸
氨基末端工程丝氨酸具有水解稳定性和均质性。在该技术中,重链和轻链的氨基端含有工程丝氨酸残基。丝氨酸残基含有一个羟基,经过轻度氧化形成醛基。然后这些醛基参与肟连接。对这样技术感兴趣的公司包括ImmunoGen和MedImmune。
连接到Fab核苷酸结合位点
IgG抗体的Fab区在核苷酸结合袋 (NBP) 处含有赖氨酸基团。根据加州大学的研究人员的研究,可以通过基于偶联的吲哚基 5-二氟-2,4-二硝基苯连接子-药物基团特异性地对这些赖氨酸基团进行连接。
非天然氨基酸工程
这是一种通过掺入非天然氨基酸对蛋白质进行位点特异性改变的合适方法。根据研究,利用转运核糖核酸(tRNA)/tRNA合成酶对将非天然氨基酸整合到终止密码子处。例如,据研究报道,对乙酰-苯丙氨酸是一种非天然氨基酸,掺入抗HER2 IgG1中,在不干扰其它氨基酸的情况下改变酮基。另一项研究使用该方法将曲妥珠单抗与单甲基奥瑞他汀F (MMAF)偶联。该方法对抗体的官能团是可耐受的;因此,它是一种调节DAR的有用技术。然而,引入非天然氨基酸会引起免疫反应。此外,由于基因工程的参与,这需要先进的技术。
ADC的作用机制
ADC是一种能够精确靶向肿瘤细胞的抗肿瘤药物,具有治疗指数高、脱靶毒性小的特点。下图显示了ADC作用机制的主要概述。如图所示,与正常细胞相比,ADC的单克隆抗体与肿瘤细胞上过表达的靶抗原结合时,ADC被内化到细胞中形成早期内体,随后该早期内体成熟为晚期内体并与溶酶体融合。此外,由于溶酶体蛋白酶的存在,细胞毒性有效载荷与单克隆抗体分离,并通过靶向微管或DNA杀死肿瘤细胞。透过膜的有效载荷可以扩散回细胞外基质,并杀死邻近的细胞,称为旁观者效应,这进一步增强了ADC的功效。此外,其它机制,如ADCC、CDC和ADCP机制也参与了ADC的抗肿瘤作用。在这些机制中,ADC抗体的Fab片段与抗原表位结合,在肿瘤细胞表面表达,而同一抗体的Fc片段与免疫细胞 (如自然杀伤细胞、巨噬细胞等)的FCR结合,直接导致细胞死亡。单克隆抗体直接结合肿瘤细胞的特异性抗原,抑制相应的下游信号转导。例如,T-DM1的曲妥珠单抗与HER2受体结合时,可阻断HER2与HER1、HER3或HER4之间异源二聚体的形成,抑制MAPK、PI3K等信号通路,导致细胞凋亡。
图4. ADC的作用方式。
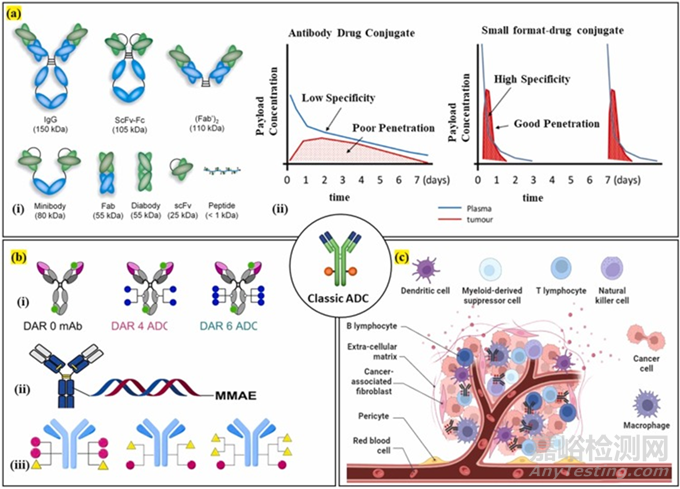
图5. 下一代ADC:a) 显示了不同的抗体片段,以降低分子量并增加ADC的渗透率;b) 显示了通过使用支链连接子,以及具有双载荷和DNA作为连接子的ADC,来增加ADC的DAR和效力的方法;c) 显示了TME靶向ADC。在这种方法中,ADC可以针对TME的不同成分,而不是细胞内部环境。
原文:A.Samantasinghar, N.P.Sunildutt, F.Ahmed, et al., A comprehensive review of key factors affecting the efficacy of antibody drug conjugate. Biomedicine & Pharmacotherapy, 2023.