文章在对药品生产洁净环境监测相关法规进行分析的基础上,结合药品生产企业洁净环境监测实践,将药品生产洁净环境监测注意点划分为监测程序规定、监测计划和监测实施3个方面,进行要点及注意事项的分析与阐述。并通过国内外药品检查时在药品生产洁净环境方面发现的缺陷进行统计分析,对缺陷分布情况及典型问题进行介绍,为我国药品生产企业,特别是无菌药品生产企业,进一步做好药品生产洁净环境监测提供参考与借鉴,同时也为各类药品生产洁净环境监测的检查提供思路。
药品完成内包装前的洁净环境控制良好,可有效避免药品受到微生物和微粒等外来污染。2013 至2019 年,全球因微生物污染及无菌保证缺乏等因素召回的药品占召回药品总量的40.26% [1]。因此,做好药品生产洁净环境监测对保证药品质量有重要意义。
洁净环境监测是制药企业污染控制的重要组成部分,主要用于评估药品生产中微生物控制的有效性,特别是无菌药品。近年的国内外药品检查中发现,药品生产企业洁净环境监测仍存在问题,洁净环境监测实践方面仍有不足。因此,有必要就如何有效开展药品生产洁净环境监测,进行系统分析与要点研究。
1、药品生产洁净环境监测法规指南概述
国内外GMP 对于药品生产环境监测均有明确规定,尽管其中对于洁净级别的分类存在微小差异,但总体原则与要求是相似的。我国GMP 附录《无菌药品》中将洁净级别分为A 级、B 级、C 级和D 级,并与国际标准化组织(ISO) 的洁净室及相关控制环境系列标准(ISO 14644) 进行了关联;同时GMP正文中明确,非无菌制剂生产的暴露工序区域应当参照《无菌药品》中D 级洁净区的要求设置,企业可根据产品的标准和特性对该区域采取适当的微生物监控措施[2]。欧盟新修订的GMP 附录《无菌药品生产》中也明确,洁净室和洁净空气设备的确认可参考ISO 14644 系列标准[3]。WHO 和美国FDA关于无菌药品生产的技术标准与指南中均有类似的描述[4-5]。
各国GMP 均以ISO 14644 系列标准为基础,结合药品生产特性,将药品生产环境分类为4 个不同等级。其中,除尘埃粒子外,增加了微生物标准(包括浮游菌、沉降菌和表面微生物),并要求基于设施设备、生产工艺与步骤、操作、确认数据及历史监控数据等的风险评估,制定全面的环境监测计划与程序(包括取样位置、监测频率、监测方法、行动限与警戒限、趋势分析方法、异常情况调查与纠正措施等),以保证洁净室和洁净空气设备能持续提供符合设计和法规要求的适宜空气,并及时发现异常和偏离环境限度的情况。
除GMP 规定外,《中华人民共和国药典》2020年版(ChP 2020)、《美国药典》(USP 2022) 及《WHO药品微生物实验室管理规范》(2011 版) 中对洁净环境监测也有相关规定。其中,《WHO 药品微生物实验室管理规范》要求基于风险评估结果制定环境监测计划[6];而ChP 2020 和USP 2022 针对不同洁净级别均明确了指导性监测频次,但二者适用范围并不相同,监测频次的差异也较大。《美国注射剂协会技术报告》中的环境监测计划基本原则认为,环境监测属于污染控制策略的一部分,适用于评估无菌药品生产中微生物控制的手段[7]。从执行角度来看,环境监测本身也是一种干预行为,并非越多越好,关键在于基于风险评估结果,确保监测行为科学、合规、有效。
2、药品生产洁净环境监测要点
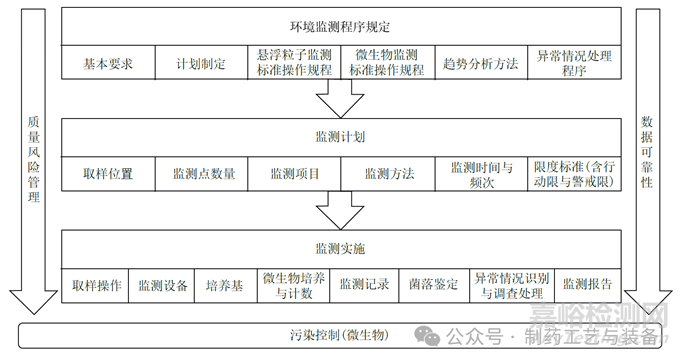
在探讨药品生产洁净环境监测要点前,需要明确药品生产洁净环境监测不是一项孤立的工作,有着必要的前提条件,包括有相应资质的人员、合理的厂房设施设计与维护、适宜的清洁与消毒程序、可靠的工艺控制,以及有效的质量管理体系。本研究主要着眼于暖通空调系统(heating,ventilation and air-conditioning systems,HVAC) 及洁净区已完成设计、安装、运行及性能确认后,在常规生产期间的洁净环境监测要点(图1)。
图1 药品生产洁净环境监测要点图
质量风险管理贯穿药品生产洁净环境监测的全过程,数据可靠性是药品生产洁净环境监测的基础;环境监测计划的制定需要基于风险评估,环境监测的实施必须保证数据可靠性。根据药品生产洁净环境监测开展的不同阶段与逻辑,可从环境监测程序规定、监测计划和监测实施3个方面进行分析。
2.1环境监测程序规定
环境监测程序是整个药品生产洁净环境监测工作开展的依据与指导文件,应明确不同洁净级别环境监测的基本标准与要求,包括:温度、相对湿度、压差、悬浮粒子与微生物等;同时需要明确环境监测计划制定的原则与程序、悬浮粒子及微生物监测标准操作规程、趋势分析方法与要求、异常情况处理程序、记录与定期分析报告要求等。
温度、相对湿度、压差应采取适宜的方式监测。对于压差梯度是关键性影响因素的房间(如人流与物料的缓冲间、气锁间),需要考虑进行持续在线监测,并考虑人员现场进入房间前确认的方式。悬浮粒子监测标准程序中需重点关注采样管长度、弯管半径及采样体积。微生物监测标准程序需注意浮游菌采样法、沉降菌法、表面取样法的细节操作,如平皿盖摆放、平皿编号原则与方式、沉降菌实际采样时间的折算要求、培养方式与条件、微生物观察与记录要求、擦拭取样面积的保障等。趋势分析及异常情况处理程序中需关注警戒限与行动限的建立原则、定期(如每季度或每年) 数据趋势分析的要求、趋势分析中的判异原则、出现异常趋势时的调查要求、难以去除微生物(如细菌芽孢或霉菌)的特殊处理程序等。
2.2环境监测计划
洁净区环境监测计划应基于全面的风险评估制定,包括对实际生产设施设备、生产工艺与步骤、涉及操作、HVAC 系统确认期间的数据及历史监控数据等的全面评估。风险评估的重点包括:确定悬浮粒子和微生物监测的取样位置、监测点数量、监测项目、监测或取样方法、监测时间、监测频率,以及明确的行动限与警戒限等内容,并应形成质量风险评估报告。
取样位置的选择需考虑房间布局、生产工艺和网格化设计[8],关注可能导致产品污染的位置与工艺、可能发现微生物污染的位置、难接近和消毒的位置,以及必要的轮换或随机取样位置。监测点数量通常取决于该区域的洁净级别、开展的工作、物料和人员流向、操作情况、区域面积等因素。以无菌药品生产的A 级区为例,常见的关键监测位置包括灌装线开关、灌装容器附近以及关键设备表面(如敞口小瓶转盘、灌装位置、胶塞料斗、灌装针、操作手套等)。监测项目与监测或取样方法主要是指对悬浮粒子与微生物的监测要求,A 级区对悬浮粒子的要求最高,需要全过程监测,B 级区可以采用略低的监测频率。对于微生物的监测,通常要采用多种方法。对A 级区的关键操作全过程要进行浮游菌和(或) 沉降菌监测;在生产结束后,A 级区与B 级关键区域都需要进行表面微生物监测[如灌装线、控制面板、胶塞料斗、灌装针、门把手、墙壁、限制进出屏障系统(restricted access barrier system,RABS)门及操作手套、隔离帘等]。
值得注意的是,监测或取样方法的有效性需在风险评估中进行论证。在监测时间与监测频率方面,GMP 在无菌药品生产章节对部分关键区域的监测时间与频率进行了规定,如:A 级区关键操作的全过程(含设备组装阶段),基本要求是应能发现潜在的系统问题及对产品的潜在污染风险。在制定时应考虑法规规定、产品类型与生产工艺、人员操作与干预、产品后期是否灭菌、历史监测数据、季节引起的微生物变化(如梅雨季节的霉菌、特定区域不同月份微生物的增长趋势差异[9]) 等因素。注意考虑在生产过程中对关键区域进行监控是否会增加产品污染的可能性;如果可能存在此风险,应在操作完成后进行取样。此外,如果生产过程中污染的可能性很低(如密闭系统生产),则可以考虑降低监测频次。对于行动限与警戒限:通常行动限是基于法规或行业指南建立的;而警戒限则是基于对环境监测历史数据的分析结果建立的,常见的建立方法包括阈值法、正态分布法(尽管环境监测数据往往不属于正态分布) 和公差限值法。在监测计划制定时,应注意无菌隔离系统的特殊性,其风险与常规的无菌生产环节不同,需要更多关注破损或泄露导致的污染。
2.3环境监测的实施
环境监测计划制定后,需要按照环境监测程序文件规定和计划对药品生产洁净环境实施监测,此环节需重点关注数据的可靠性。实施环节的取样操作应严格按程序规定开展,避免任何可能影响监测结果的操作(如取样时间不足、消毒剂与培养基接触等) ;使用经校准或确认后符合要求的监测设备;确保微生物监测用培养基的灵敏度,在规定条件下采用适宜的方式进行培养(一般考虑在20 ~ 25 ℃培养3 d 后,继续在30 ~ 35 ℃培养2 d),在培养过程中及结束时计数,并对A 级区和B 级区检出的微生物进行鉴定,必要时对超出限度标准的C 级区与D 级区微生物进行分离鉴定。对于出现超出限度规定的结果与异常趋势,均需按程序规定进行调查,必要时采取纠正和预防措施。所有监测与调查操作需要进行记录,并保证记录符合ALCOA+ 原则(即可追溯、清晰、同步、原始、准确、完整、一致、持久与可获得)[10],例如环境微生物监测记录信息至少应包括监测日期与时间、取样位置、取样方法、培养基名称与批号、培养条件、培养时间、微生物监测结果(菌落单位)、取样及检测人员等,并注意采样后培养基平皿标识与实际记录的关联。最终按程序对环境监测数据进行收集、分析,形成阶段性监测报告。
3、药品生产洁净环境监测的典型问题
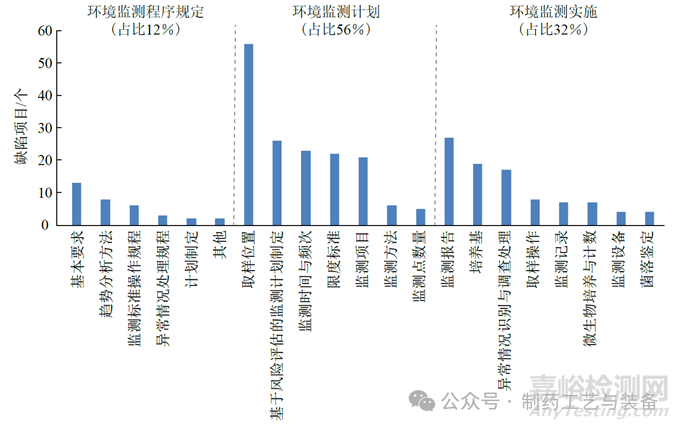
对2019 至2022 年我国国家药品监督管理局、美国FDA、欧洲药品质量管理局及WHO,在全球药品生产企业检查中针对药品生产洁净环境监测提出的部分缺陷进行了收集与整理,通过对近300 个环境监测相关缺陷的统计分析,基于上述洁净环境监测要点分类,归纳出当前药品生产企业在环境监测方面的常见问题分布(图2)。
图2 药品生产洁净环境监测中常见缺陷的分布
药品生产洁净环境监测相关的常见缺陷分布主要是3 个方面:环境监测程序规定(12%),环境监测计划(56%) 和环境监测实施(32%),其中占比较高的问题依次是取样位置(19.6%)、监测报告(9.5%)、基于风险评估的监测计划制定(9.1%)、监测时间和频次(8%)、限度标准(7.7%)、监测项目(7.3%)、培养基(6.6%)、异常情况识别与调查处理(5.9%)、基本要求(4.6%)、趋势分析方法(2.8%) 和取样操作(2.8%),上述缺陷项目总和占全部的80%以上。
3.1洁净环境监测程序规定的典型问题
洁净区内温度、相对湿度和压差是监测的基础指标,典型问题有以下几种。(1) 程序中对“关键性”与“非关键性”房间采取不同的监测要求,但二者的定义与区分不明确;(2) 关键生产区域未进行特定指标的监测,或监测方式存在潜在风险(如缺少持续监测或报警系统、现场人员不能确认区域状态、限度标准范围不合理等);(3) 生产现场温度、相对湿度或压差超出标准规定。
趋势分析方法方面主要有以下典型问题。(1)未规定如何报告、展现、分析和执行环境监测的趋势分析;(2) 相关程序规定不详细、不清晰。
监测标准操作规程和异常程序处理规程中存在部分规定不明确或不合理的情况。(1) 规定沉降菌结果采用平均值与标准限度进行对比,存在潜在污染风险批次放行的可能;(2) 缺少详细说明环境监测异常时的处理、记录与调查要求的程序规定。
此外,还存在监测计划的制定程序缺少对较低级别区域监测的考虑、环境监测操作的监督,以及潜在风险评估不足等问题。
3.2洁净环境监测计划的典型问题
洁净区环境监测计划中,取样位置、监测项目与监测点数量是相互关联的,具体如下。
首先,取样位置的问题主要是未对关键风险区域进行取样监测,以及现有取样位置不具有代表性,典型问题如下。(1) 无菌连接处、延展层流下方、加塞后的传输轨道等位置,未设置取样点;B 级区的生产培养室未进行取样监测;监测位置远离无菌操作或人员干预区域;环境监测风险评估文件中未明确具体的取样位置。(2) 悬浮粒子监测中,与A级区直接相连的B 级区房间未进行监测;隧道烘箱出口处的小瓶转盘、胶塞料斗、隧道烘箱冷却段等位置,未设置监测点;悬浮粒子采样器位置不合理,如正对着玻璃门、安装位置高于冻干机门等。(3)表面微生物监测中,A 级区人员操作手套手指(包括RABS 上的手套)、灌装区域人员和物料频繁接触的表面(包括延展层流的塑料帘、RABS 门内外表面、B 级区操作面板、胶塞料斗、灌装针头等)、无菌操作人员侵入灌装线、分装线靠墙的位置与墙壁等位置未进行监测;仅针对固定位置进行监测,未采用表面擦拭法随机检查难以清洁的点;B 级区地面未进行表面微生物监测;原液车间C 级区,仅要求对设备面板和层流罩保护帘外表面进行微生物监测。
其次,监测项目的问题主要是仅对一些关键性区域进行了监测,典型问题如下。(1)A 级区小瓶缓冲区域、冻干机装置位置等未进行浮游菌监测;(2)A 级区加塞位置缺少悬浮粒子监测或微生物监测;(3)B 级区更衣室及灌装间未进行表面微生物监测;(4) 生产培养室未进行沉降菌监测;(5)C 级区均未进行表面微生物监测;(6)D 级区未监测悬浮粒子;(7) 未设置在线悬浮粒子监测。
另外,监测点数量方面的问题主要是洁净区内监测点数量过少,与生产操作和洁净区面积等不匹配,典型问题如下。(1)B 级区只有1 个悬浮粒子采样点;(2) 生产线有16 个灌装针头且覆盖了较长的表面,但灌装位置只有1 个采样点。
风险评估计划制定相关问题的频次居于环境监测计划方面的第二,典型问题如下。环境监测计划标准作业程序(SOP) 中无正式的风险评估报告,包括取样位置、取样频次等均未基于正式的风险评估开展,例如层流设备A 下的悬浮粒子监测点的设置未基于风险评估,2 个监测点高于操作水平面并靠墙安装。
监测时间与频次方面的问题主要是环境监测频次过低,以及监测期间未能覆盖关键操作区间,典型问题如下。(1) 无菌操作最开始,即分装器具组装时未进行环境监测;(2) 培养基模拟灌装试验中,微生物环境监测未覆盖物料转入RABS 的过程;(3)灌装线组装结束后,未进行浮游菌及表面微生物监测;(4) 原液配制过程中未进行浮游菌监测,而是在人工无菌操作开始前进行监测;(5) 浮游菌检测仅在生产活动结束后进行;(6)B 级区的微生物监测频次未考虑操作的差异性,统一规定每3 个月进行1 次( 包括对涉及人员操作的无菌灌装间) ;(7)上游无菌生产工艺的常规环境监测(包括微生物)每周仅进行1 次;(8) 对灌装线B 级区和C 级区的表面微生物(如设备面板、门把手和工作台表面),仅在性能确认时进行监测;(9) 规定所有C 级区、D 级区,每年仅进行1 次环境监测;(10)B 级灌装间未规定浮游菌取样监测的具体时间要求;(11) 分装过程中,未连续监测干热灭菌柜和手套箱之间的A 级层流罩的悬浮粒子。
限度标准方面的主要问题集中在环境监测警戒限和行动限制定不合理,以及对个别区域环境标准适用不当,典型问题如下。(1) 未制定环境监测的警戒限和行动限;(2) 未基于历史数据制定环境监测的警戒限和行动限;(3) 制定的警戒限与行动限仅适用于动态条件,未制定静态监测的警戒限与行动限;(4) 对于悬浮粒子的报警限度,未考虑超过5 μm 粒子的连续低计数情况;(5) 仅针对固定采样点制定了悬浮粒子的警戒限,未对B 级区的移动计数器采样点设置警戒限;(6) 对于紧邻A 级区RABS 层流的延展层流区域(其下人员会打开RABS 门进行个别干预操作) 的微生物限度采用B级标准,未能基于工艺、环境和产品的潜在风险进行充分评估。
监测方法的问题主要涉及空气采样量和表面擦拭取样方法2 个方面,典型问题如下。(1) 对于表面微生物,未建立针对不规则表面的擦拭取样方法,或未建立并确认擦拭取样面积的方法;(2) 环境监测方案中未补充用于检测特定微生物(产多糖细菌) 存在的方法;(3) 冻干机开门处空气采样量均为1 m3,未考虑冻干机门打开时间延长或者操作员靠近冻干机开门的时间。
3.3洁净环境监测实施的典型问题
洁净环境监测在实施阶段存在的问题,从发生频次的高低来看,依次为监测报告、培养基、异常情况识别与调查处理、取样操作、监测记录、微生物培养与计数、监测设备、菌落鉴定等方面。
监测报告的问题集中在未能对环境监测数据开展有效的趋势分析,典型问题如下。(1) 企业未能提供环境监测报告及趋势分析。(2) 缺少环境监测部分项目(如灌装线A 级区的悬浮粒子、人员表面微生物等) 的趋势分析。(3) 趋势分析不充分,未考虑同一位置重复发现微生物的情况;每年仅进行1 次环境监测趋势分析,不利于及时发现并识别无菌区的潜在偏移。(4) 趋势分析中仅限于将结果与标准进行比较,而未其转化为信息,并调查根本原因。
培养基相关的问题主要包括表面接触平皿中和剂的添加、培养基促生长试验及自制培养基的包装这3 个方面,典型问题如下。(1) 表面监测用培养基成分中未包括任何中和剂,未评估设备及洁净服表面残留消毒剂的影响;(2) 培养基促生长试验存在不足,如未对环境监测培养基进行促生长试验、未使用企业实际环境中的典型菌、仅使用了金黄色葡萄球菌1 种代表菌等,或未对暴露4 h 的沉降菌监测用培养基进行促生长试验;(3) 自制培养基的包装方式难以保证转入A 级区后的表面无菌;(4)未对进行了接触平皿采样后的表面清洁与消毒情况进行研究。
异常情况识别与调查处理方面的问题主要是对环境监测中的异常趋势未能进行有效识别、分析、调查与处理,典型问题如下。(1) 对操纵环境监测数据的情况,未启动任何偏差调查;(2) 针对环境监测异常的根本原因分析不合理,且未进行记录;(3) 针对B 级区发现的2 次芽孢杆菌,未按其程序规定启动偏差调查;(4) 预充式灌装线B 级区生产期间多次发现芽孢杆菌,但由于未超过警戒限,仅对其进行了鉴定,未采取其他针对性的消毒措施;(5)A 级区、C 级区的多个环境监测平皿超出了行动限,但未启动调查。
取样操作存在不规范的行为,典型问题如下。(1) 操作人员未按程序规定进行环境监测取样;(2)沉降菌取样时平皿盖遮挡了部分平皿暴露区域;(3)操作人员使用喷壶喷洒手臂消毒液时,紧邻沉降菌监测平皿且喷洒方向朝向平皿;(4) 擦拭法取样时,未使用面积模具,难以保证有效的取样面积。
监测记录的问题主要是记录信息不完整、不同步、不真实等,典型问题如下。(1) 存在操纵环境监测结果记录的情况;(2) 环境监测样品未标记采样日期和时间,监控显示样品实际采样时间与批记录存在差异;(3) 环境监测记录中未记录悬浮粒子、浮游菌和沉降菌的具体监测时间;(4) 监控显示,操作人员未按程序规定进行表面微生物监测,但记录中却显示了对应项目的监测。
微生物培养与计数方面的问题主要涉及操作的规范性,典型问题如下。(1) 培养平皿计数仅用人工肉眼计数,难以保证对细小菌落的有效识别;(2)未对培养基平皿观察计数情况进行复核;(3) 对沉降菌监测平皿计数结果的折算方式不合理;(4) 企业规定在30 ~ 35 ℃培养至第5 天时观察结果,进行培养基促生长试验时真菌是在20 ~ 25 ℃培养,未评估30 ~ 35 ℃对真菌监测结果的影响;(5) 在使用封口膜密封平皿、采用多层塑料袋对培养基平皿装袋等方式的状态下进行培养,未评估该操作可能对需氧菌生长产生的影响;(6) 缺少培养期间的计数观察与记录。
监测设备的问题主要集中于悬浮粒子监测仪,如对悬浮粒子监测仪前部管道的半径与形状未作要求,现场发现个别管道较长,且呈U 形,导致无法有效监测实际悬浮粒子数量;又如,采用同一个便携式悬浮粒子计数器,对阳性区域和非阳性区域进行环境监测,存在交叉污染风险。
菌落鉴定方面的问题主要是未对A 级区、B 级区环境监测中发现的微生物进行鉴定。
4、结语
药品生产洁净环境监测是药品生产污染控制策略的重要组成部分[11],显示出药品生产企业在无菌保证、质量风险管理、统计分析等方面的能力,也体现了企业对其药品生产工艺与步骤、厂房设施与设备、清洁与消毒等方面潜在风险情况的理解程度,是无菌药品检查的关键内容[12]。特别是对于参数放行的无菌药品,洁净环境监测更是影响药品能否放行上市的直接因素之一[13]。
药品生产企业(特别是无菌药品生产企业) 必须高度重视洁净环境监测。本研究对药品生产洁净环境监测各阶段的要点进行了探讨,并对近年来国内外检查中针对洁净环境监测各方面的典型问题进行了分析与举例,内容涵盖药品生产洁净环境监测的核心内容。药品生产企业可以借鉴本研究的相关内容,结合实际情况,对洁净环境监测工作进行全面评估,进一步完善相关措施,确保对洁净环境监测的有效性与适宜性,进而更好地保证药品质量。
在各类药品检查(包括企业自检与外部审计)中,可以将药品生产洁净环境监测质量风险评估报告作为切入点,结合企业现场厂房设施与设备布局、生产工艺与实际操作等,评估生产洁净环境监测计划的合理性,并对相关程序规定与环境监测实施情况进行抽查。参考本研究列举的要点与典型问题,可进一步提高检查工作的有效性。
参考文献
[1] 武雅文, 王 莹, 车 阳, 等.国际微生物污染相关药品召回回顾分析(2013—2019)[J].中国现代应用药学, 2021,38(15): 1870-1877.
[2] 中华人民共和国卫生部.药品生产质量管理规范(2010年修订)[EB/OL].(2011-01-17)[2023-03-04].http://www.linjec.com/download/2013121838310173.pdf.
[3] EMA.The rules governing medicinal products in the european unionvolume 4 EU guidelines for good manufacturing practice for medicinal products forhuman and veterinary use [EB/OL].(2022-08-22)[2023-03-04].h t t p s : / / h e a l t h.ec.europa.eu/system/files/2022-08/20220825_gmp-an1_en_0.pdf.
[4] WHO.TRS 1010-annex 8: guidelines on heating, ventilation and air-conditioning systems for non-sterile pharmaceutical products [EB/OL].(2018-10-10)[2023-03-04].https://www.who.int/publications/m/item/Annex-8-trs-1010.
[5] FDA.Guidance for industry: sterile drug products produced by aseptic processing——current good manufacturing practice [EB/OL].(2020-05-04)[2023-03-04].https://www.fda.gov/regulatory-information/search-fdaguidance-documents/sterile-drug-products-produced-asepticprocessing-current-good-manufacturing-practice.
[6] WHO.Good practices for pharmaceutical microbiology laboratories [EB/OL].(2011-06-10)[2023-03-04].https://www.who.int/docs/default-source/medicines/norms-and-standards/guidelines/quality-control/trs961-annex2-goodpractices-pharmaceutical-microbiologylaboratories.pdf?sfvrsn=ebd1845e_0.
[7] PDA.Technical report No.13(revised 2014) fundamentals of an environmental(2022 R)[EB/OL].(2022-05-05)[2023-03-04].https://849364ddf2a1c16b9b3c-d2fc8da97f4d917d0e12a6d71ff7e4b1.ssl.cf2.rackcdn.com/PDA/Technical%20Report%20Portal/index.html.
[8] 任杏珠.医药洁净厂房空调系统确认和环境监测取样点选取探讨[J].煤炭与化工, 2022, 45(1): 144-150.
[9] 黄慧思, 崔碧玲, 洪嘉敏.药品洁净区环境微生物监测分析报告[J].广东化工, 2021, 48(23): 154-156.
[10] 颜若曦, 曹 轶.药品生产企业数据可靠性缺陷分析[J].中国药物警戒, 2018, 15(1): 20-23.
[11] 李国琼, 翁贤坤, 梁玉琴.冻干粉针剂生产过程的污染控制策略[J].中国医药工业杂志, 2022, 53(1): 155-162.
[12] 颜若曦.世界卫生组织生物制品检查要点与典型问题研究[J].中国医药工业杂志, 2022, 53(7): 1049-1055.
[13] 尚 悦.无菌药品参数放行国际实施历程及我国现状浅析[J].中国医药工业杂志, 2021, 52(9): 1248-1252.
本文作者颜若曦,国家药品监督管理局食品药品审核查验中心,来源于中国医药工业杂志,仅供交流学习。