一、概述
自2019年12月1日MAH制度在中国正式施行以来,药品共线生产的普遍性和药品质量安全监管的紧迫性成为药企和药监部门亟需面对和重视的问题。为了规范和指导药品共线生产管理,避免产品间的污染和交叉污染,NMPA在2021年11月发布了《药品共线生产质量管理指南(征求意见稿)》,并于2023年03月正式颁布了《药品共线生产质量风险管理指南》。指南的颁布不仅为国内药品生产企业的共线生产管理和风险评估提供了法规指导,而且为企业提供了相对系统的评估策略、方法和标准。在本文中,本人结合自己的经验和理解,重点剖析和阐述了上述指南中关于药品共线生产的基本原则和要求,以期共同提升对该问题的认识,同时也欢迎同仁补充和指正。
二、药品共线生产的基本原则
根据《药品共线生产质量风险管理指南》的定义,药品共线生产是指多种药品共用生产线进行生产,包括共用生产厂房、设施和设备,但不包括共用质量控制实验室、库房、取样间等辅助设施和仪器。指南中关于药品共线生产的基本原则共计5条,见表1。
表1 药品共线生产的基本原则
三、药品共线生产评估
药品共线生产范围涵盖商业化产品、非商业化规模的试制样、临床试验药品等,涉及共线情况比较多样,例如:①临床试验用药品与商业化药品共线;②中药产品共线;③生物制品共线;④最终灭菌产品与非最终灭菌产品共线;⑤某些激素类、细胞毒性类、高活性化学药品共线;⑥基因治疗与细胞治疗产品共线;⑦麻醉药品、精神药品和药品类易制毒化学品共线;⑧青霉素类及β-内酰胺结构类产品共线等。以上哪些情况可以共线生产?哪些不可以就需要具体分析和评估。
共线生产评估包括两部分,共线可行性分析和共线生产风险管理,其基本逻辑关系见图1。
图1 共线可行性分析和共线生产风险管理
共线生产风险管理(风险识别、评估和控制)是消除或降低共线生产风险并确保药品质量和安全的关键环节,共线生产企业必须严格执行和强化管理。
3.1共线可行性分析
在实施多产品共线生产时,我们必须意识到完全消除产品间的交叉污染风险是不现实的。在GMP条件下,需要将交叉污染的控制程度与确定的患者风险水平相匹配。生产企业应遵守国家法规条例的基础上,根据企业质量体系特点,结合科学知识及经验实施风险管理。共线可行性分析是第一步,相关内容请参见图2。
图2 共线可行性分析
如果通过分析发现不可以共线生产(参见 表1药品共线生产的基本原则中相关描述),则终止共线或改为专线生产。如果通过共线可行性分析,可以共线生产,则启动共线生产风险管理-风险评估(识别、分析、评价)和控制,进而消除或降低共线生产风险,最终保障药品的质量和安全。
3.2 共线生产风险管理
药品共线生产风险管理的目的是确保在共线生产过程中不同药品之间不会相互污染或影响产品质量。共线生产风险管理的关键措施如下:
风险识别:确定潜在风险,包括交叉污染、设备故障、人为错误等。
风险评估:评估各种潜在风险的可能性和影响程度,以确定应对重点。
控制措施:制定控制措施,如采取物理隔离、清洁程序、不同工艺区域间的限制等,以防止交叉污染。
有关共线生产评估和控制的基本要求,请参见表2。
表2 共线生产评估和控制基本要求
3.3 案例分析
背景:以某公司XX生产车间拟共线A、B品种小规格最终灭菌注射剂为例。
流程:药品共线生产评估致流程包括:1)组建评估小组;2)收集产品信息;3)共线可行性分析;4)风险识别;5)风险评估;6)风险控制;7)风险回顾。
1)组建评估小组
建立一个评估小组,使相关领域有经验有技术的人员参与到风险评估中来,最大限度抵消主观行为偏见的影响。公司选择的评估团队,一般来自于各部门(车间、质量、设备部、研发、仓储)部长、主管或技术骨干,他们经验丰富,在自己的领域小有成就并能独当一面。
2)收集产品信息
共线生产的注射剂产品应有相似或相近的产品特性,应对具体的产品特性进行分析,包括毒性、致敏性、活性、溶解度、性状和配伍禁忌或相互反应等,以确定多品种共线生产的可行性。
3)共线可行性分析
① 法规要求
根据《药品共线生产质量风险管理指南》(2023年3月)和《药品生产质量管理规范》(2010年修订)相关规定,评估共线产品是否满足相关法规要求,见表3。
表3 法规要求符合性分析
②厂房、设施和设备的适用性
表 4 厂房、设施和设备的适用性分析
③ 工艺可行性分析
最终灭菌小容量注射剂生产为例,其主要工序包括如图3所示。
图3 最终灭菌小容量注射剂一般工艺流程
通过工艺流程分析,需要考虑每道工序的生产过程中可能发生混淆和交叉污染的风险点。考虑到人、机、料、法、环、测等六个方面,以确保不遗漏任何风险点。重点分析关键生产工艺是否容易受共线生产的另一产品的干扰,而最终灭菌小容量注射剂的关键生产工艺包括配制、灌封和灭菌。
4)风险识别
多产品共线生产中产生危害的主要原因,可以从人、机、料、法、环、测几个角度来分析,常见的原因与示例,见表 5。
表5 多产品共线生产主要风险常见原因分析
5)风险评估
① 风险等级评价表
评价每项风险要素的失效影响,用S(严重度)、O(可能性)、D(可探测度)三个指标,每个指标划分5级,对应分数均为1~5分,每级设定评价标准(限于篇幅,此处省略分级和评价标准的具体内容)。最后计算风险系数RPN=S*D*P。RPN值在1~125之间,根据公司抗风险能力及公司实际情况,将风险水平等级设定为低风险、中等风险、高风险,见表6。
表6 风险等级评价表
② 风险评估表
表7 A、B品种最终灭菌小容量注射剂风险评估表
6)风险控制
针对表7中及以上风险的各风险要素需制定针对性控制措施,并重新进行风险评估,直至风险水平降至可接受水平(低风险),见表8。
表 8 最终灭菌小容量注射剂A、B品种共线生产采取措施后的风险评估结果表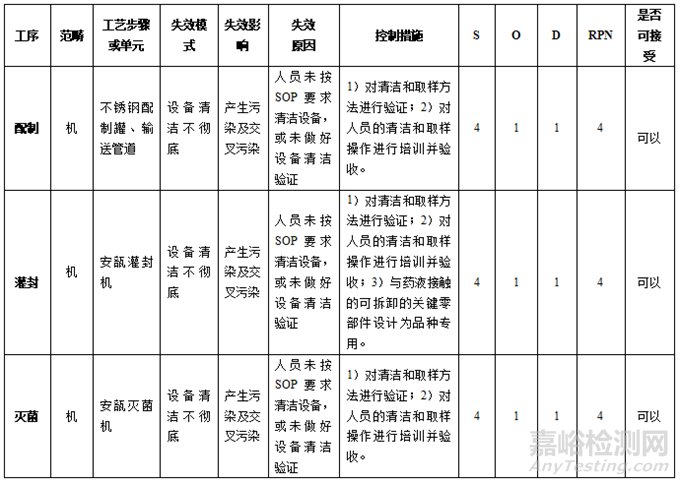
经过风险评估,要降低XX车间最终灭菌小容量注射剂A、B品种共线生产的风险,必须确保涉及到的各项风险控制措施都得到落实,并且能够达到预期效果后才能放行所生产的产品。
7)风险回顾
完成风险评估后,应定期回顾风险管理过程的结果,回顾频率应与相应的风险水平相适应。建立定期的风险审查机制,分析产品各项指标控制情况,总结偏差特点和趋势,并制定风险降低改进计划。
此外,企业还应在以下情况下重新评价风险:①当原辅料、直接接触药品的包装材料、质量标准、检验方法、操作规程、厂房、设施、设备、仪器、生产工艺、计算机软件等发生变更时;②当法律法规及技术要求发生变更时;③在现有生产线增加品种时;④当企业的管理层或客户提出对质量管理更高的要求时。
8)结论
通过对某公司XX车间的最终灭菌小容量注射剂A、B的共线可行性分析(法规要求、厂房、设施和设备、工艺等),经过风险识别和评估,发现客观上存在交叉污染、混淆和人为差错的风险,针对中高风险要素通过风险控制措施改进后,这些要素的风险等级降低至可接受水平,故最终认为XX车间针对上述品种共线生产是可行的,共线生产期间需要对控制措施进行有效的维护,定期对风险进行回顾。
四、结束语
药品生产企业多品种共线能够整合资源、降低成本、提高效率。自《药品管理法》及“药品上市许可持有人制度”执行后,产生了大量的MAH和CMO/CDMO企业,持有人与药品生产的分离,对药品共线生产的需求也在增加。药品是特殊的商品,药品的质量和安全直接影响患者的生命健康,故药品生产企业在实施药品共线生产时必须严格遵守国家的药政法规规定,结合企业自身特点,运用科学知识和经验,做好药品共线生产风险管理。首要是进行共线生产可行性评估,经过评估可以共线生产的前提下,需进一步做好风险管理(风险识别、评估、控制),制定适合企业的SMP和SOP制度规范,做好人员培训工作,完善清洁验证等质量管理工作,最终确保共线生产过程的高效和合规。
参考文献
[1] 《药品共线生产质量风险管理指南》国家药品监督管理局,2023-03-06.
[2] 《药品生产质量管理规范》卫生部令第79号,2011-01.01.
[3] 《中华人民共和国药品管理法药品管理法》.国家市场监督管理总局,2019-08-26.
[4] 楼双凤, 曹辉, 张闯. 药品共线生产问题分析及建议[J].中国医药工业杂志, 2022, 53(7):4.
[5] 田文淼,梁毅.小容量注射剂共线生产的质量风险控制研究[J].中国医药工业杂志, 2020, 51(6):6.















