干粉吸入(DPI)通常用于肺部药物递送,通常是包含活性药物和载体辅料的混合物。为了获得最佳的肺部沉积,API的粒径必须减小至可吸入的粒径(如1μm-5μm),通常需要通过高能喷射研磨达到所需粒径。高能喷射可能会在颗粒表面引起缺陷,并会对稳定性产生影响。原料药无序的表面位点促进相邻颗粒的团聚和融合,导致整体粒径增加。
减少颗粒团聚倾向的一种方法是用辅料稀释API。辅料与API的比例越高,接触越少。想反,大规格的制剂会引起更大的相互作用并增加API颗粒团聚的频率。这是粘合力(API-辅料)或内聚力(API-API)之间的平衡。已经研究了高载药量对无定形制剂的不良影响,但对结晶体系影响的记录较少。即使不考虑稳定性,内聚力也会增加团聚,从而影响空气动力学性质。相反,较大的粘合力会抑制API结晶。这些只是高载药量产品处方面临的一些挑战。虽然长期以来低载药量一直受干粉吸入的青睐,但探索高剂量在肺部达到有效浓度的趋势正在兴起。因此,了解高载药量对产品稳定性的影响至关重要。
API一旦与辅料混合,由于辅料的干扰,API颗粒的定量检测变得非常困难。使用扫描电镜(SEM)和原子力显微镜(AFM)测定粒径受到剂量的限制,并且检测的少量样品可能不具有代表性。激光衍射是测定纯颗粒粒度分布的常用方法,并且能够在稳定性研究过程中检测API粒径的变化。激光衍射的主要挑战是API与粒径相近的载体颗粒混合时缺乏特异性。该工作展示了一种使用标准激光衍射设备和试剂测定吸入胶囊中API粒径的新方法。证明这种新方法对于研究加速条件下剂量规格和API粒径稳定性的关系非常重要。
试剂
Dobson等人之前将疏水性微粉化的API用于稳定性研究,并在室温下包装在带有干燥剂的铝箔袋中,热封;API在Aptuit混合并灌装胶囊;乳糖(DFE,ML001级乳糖);硬脂酸镁MF-2-PREMIUM(购自Peter Greven);吸入3号胶囊(Quali-V-I)(购自Qualicaps)。
最终混合物重量为20mg,剂量为1%、5%和50%(w/w),分别与每个胶囊含0.2mg、1mg和10mgAPI相对应。剩余的混合物由0.15%w/w硬脂酸镁和乳糖组成。同时以100% API为对照组进行研究。将胶囊和API对照样品热封于铝箔袋中。加速6个月时研究样品的稳定性。将额外的加速样品放置在105℃下打开的闪烁瓶中,在不受控制相对湿度条件下放置1天、2天、6天和10天。Dobson等人之前报道了105℃高温条件显著高于API的Tg且低于熔点。因此,在标准应力条件下,可在几天内加速粒径变化,同时产生类似的结果。
所有实验均在适当的防护设备下进行。试剂和样品在通风天平安全罩中制备和检测。
方法
拉曼显微镜
共聚焦拉曼显微镜仅用于不同载药量下的API分布和干粉内聚界面的差异进行成像。使用配备532nm DPSS激光器的Horiba LabRAM HR800共聚焦显微镜收集拉曼图谱;CCD相机(iDus,Andor)和衍射光栅(600格/mm)。使用这种配制的光谱分辨率约为4cm-1。使用Olympus 50X物镜(0.5N.A.)聚集激光束。样品上的激光功率约为10mW。以1μm的步长和每点0.2s的积累时间采集图片信息。通过对各个API和乳糖光谱进行常见的最小二乘法拟合,对拉曼图谱进行定量分析,并通过绘制拟合分数进行可视化。图片尺寸为150×150μm,步长为1μm。
通过激光衍射测定粒径
使用配备HydroMV附件的Malvern Mastersizer 3000进行混合API的粒径测定,并使用Mastersizer软件进行分析。使用软件中的光学性能优化器优化光学性质。测定三次并计算平均值。将样品粉末直接添加到附件中,并在测定解团聚之前以2500RPM、100%超声功率搅拌3分钟。分散剂是5%v/v异丙醇溶液。打开胶囊并导入样品室。短暂等待一段时间(约30s)后开始测量,使辅料溶解并让遮光度稳定在目标范围内。Dobson等人之前在庚烷中测定API的粒径。
结果与讨论
拉曼图像
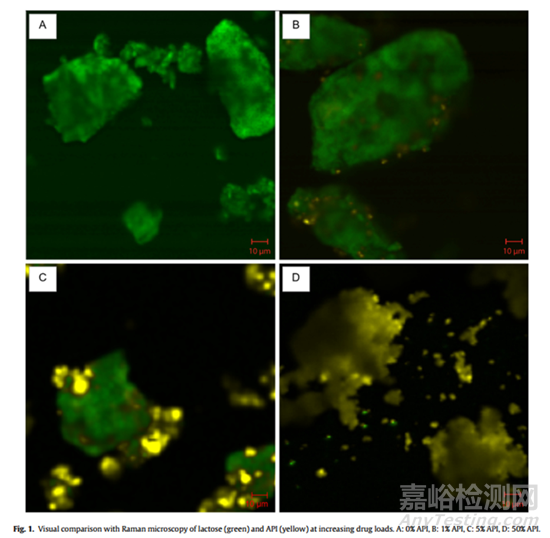
每个规格混合物代表性拉曼光谱图像见图1。API载量为1%时,乳糖占比较高,API颗粒彼此分离,如图1B所示。虽然乳糖占主导地位,但与API为0%的乳糖对照相比,API为1%(图1A)。随着API负载量的增加,使用5%API可以观察到团聚(图1C),但API颗粒之间的间距以及内聚定位仍可见。如预期的那样,最大载药量为50%API(图1D),由于内聚相互作用的定位显著增加,无法观察到游离的乳糖表面。此外,API的拉曼散射占主要地位,乳糖难以可视化。预计API含量为50%时,乳糖大部分或完全被覆盖,因为API仅粘附在较大乳糖颗粒的表面。
水相法研究
产品粒径检测方法开发重点关注API和辅料溶解度的差异。API在水中不溶(25℃时<0.01mg/ml)允许使用水性分散剂进行粒径测定。然而,在开始时使用纯水不足以分散API。检测使用水和表面活性剂时,所有表面活性剂由于产生泡沫和高背景干扰而不适用。
为了促进API分散而不增加API的溶解度,将异丙醇以0.5%v/v和5%v/v加至水中(表1)。0.5%v/v的异丙醇不足以分散API,而与使用0.2% Span 85分散剂的庚烷中的原始方法比,5%v/v的异丙醇产生了一致的结果。加入异丙醇后,未观察到由于API溶解引起遮光度降低。API的光学特性、搅拌速度和超声处理调价均源自Dobson等人文献中的粒径测定方法。D(v,0.5)显示出良好的重现性,之前的研究表明其在评估稳定性变化方面获得测信息最丰富。超声处理后重新团聚可能是水性溶液中测定D(v,0.9)较大的原因,表明分散剂中的5%v/v异丙醇与庚烷中0.2% Span 85相比不太合适。
使用新的粒径测定方法对100% API样品进行检测,稀释剂为5%v/v异丙醇水溶液,并且与原始方法一致(表1)。Dobson等人之前的研究中通过SEM捕获了颗粒变化,这证实了激光衍射中看到的变化。因此,对100%API粒径的控制,在庚烷中和新的水性分散剂之间的结果一致,这证实了使用新方法测定稳定性的任何变化都可归因于颗粒的增长,而不是分散剂的影响。
采用同一批API制备用于验证的混合物,制成5%w/w API和0.15%w/w硬脂酸镁(MS)的样品(其余成分为乳糖)。结果显示与100% API样品具有一致性,表明乳糖或MS几乎没有干扰测定。乳糖易溶于水,MS在分散池中溶解度较低,但其含量较低,未影响测定。与之前相比,发现D(v,0.9)变异性最大。
105℃条件下稳定性结果
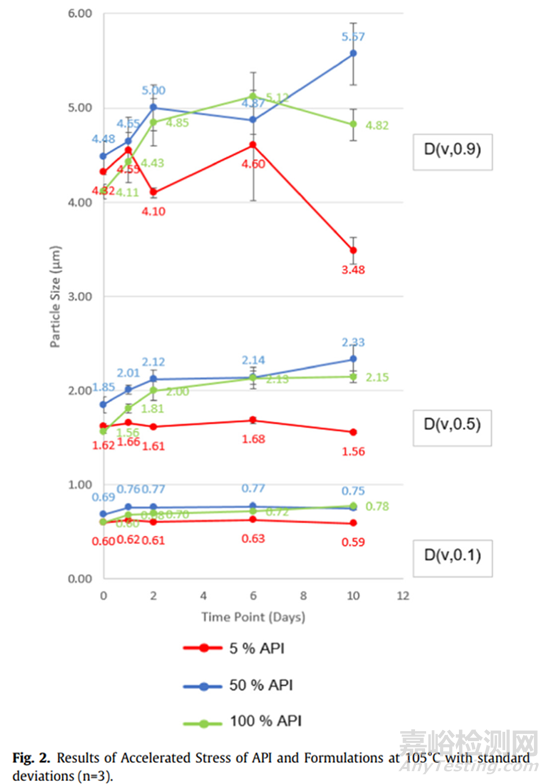
图2显示了在105℃下不同载药量下混合物的加速稳定性结果。载药量和稳定性之间存在明显的相关性。50%API的胶囊中颗粒在10天内显著增长,与100%的API类似。由于达到最小遮光度所需的1% API胶囊数量显著增加,因此无法获得1% API胶囊的数据。含5%API的胶囊同样变化不大。怀疑药物浓度增加会由于内聚相互作用的增加而导致更大的不稳定性(与图1中观察到的颗粒密度一致)。在低载药量下,API在乳糖颗粒表面更好地分散,从而降低内聚力并防止团聚。在50%高载药量下,乳糖的影响大大降低,API粒径增长与纯API大致相同。负载50%的API时API的粒径增加与内聚力的增加相关,这是由于仅API研究中观察到内聚相互作用的所致。
40℃/75%RH条件下稳定性结果
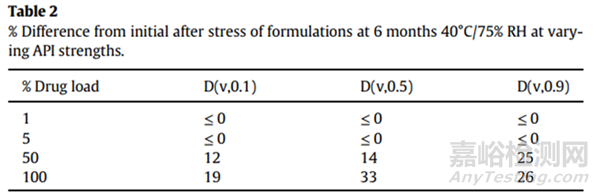
在40℃/75%RH条件下放置6个月后测定每种规格制剂的粒径。表2中显示的不同规格的制剂稳定性差异趋势符合预期,但与105℃下的稳定性结果相比,50%和100%API之间的粒度更大,差异很小。结果进一步支持较大载药量导致稳定性降低。制定和检测其他规格的样品可以阐明该API或任何单个API可能的“最大稳定载药量”。规格的确定与本研究无关,并且未研究5%至50%规格之间的载药量。结果表明,对于该API,5%的载药量足以保证制剂的长期稳定性,即使纯API不稳定。已证明制剂中原料药粒径的不稳定性与API的规格和固有的内聚性质有关。开发干粉吸入药品时应考虑这些因素。即使API不稳定,考虑规格也有可能降低粒径不稳定的风险。
这项工作研究了载药量对吸入制剂的影响。Ruden等人描述了混合状态的概念,可用于表征本研究不同规格的混合物。40℃/75%RH和105℃条件下的稳定性研究表明,由于混合状态的差异,较低载药量可能更稳定。除了空气动力学性质降低的风险外,可能认为载药量是影响含结晶研磨API稳定性的因素。
结论
利用亲水性辅料和难溶性药物之间的溶解度的固有差异,开发了一种新型湿法激光衍射方法类分析混合制剂中API的粒径。该方法用于了解API制成产品后规格对粒径稳定性的影响。由于内聚相互作用的差异,在低载药量时对API粒径稳定性更有利。所提出的这种方法将适用于任何含有难溶性药物和水溶性辅料的吸入制剂。该方法可以使用各种分散剂进行扩展研究,并利用API和辅料的物理差异对分散剂进行选择。