您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-02-18 08:49

更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
百济神州CDK2抑制剂启动Ⅰ期临床。百济神州细胞周期蛋白依赖性激酶2(CDK2)抑制剂BG-68501在Clinicaltrials.gov网站上注册一项美国Ⅰ期临床试验,计划入组108例晚期实体瘤患者,评估BG-68501的安全性、耐受性与初步疗效数据。CDK2对细胞周期调控至关重要,在多种癌症中经常高度激活。百济神州计划开发CDK2抑制剂与CDK4抑制剂形成补充,改善目前CDK4/6抑制剂在一些乳腺癌患者中的应用。
国内药讯
1.亚盛Bcr-Abl抑制剂获批国际Ⅲ期临床。亚盛医药第三代BCR-ABL抑制剂奥雷巴替尼(耐立克;HQP1351)获FDA批准开展国际Ⅲ期临床,评估用于治疗伴有或不伴有T315I突变的慢性髓细胞白血病(CML)慢性期(-CP)经治患者的有效性与安全性。该项研究预计2024年上半年启动。在Ⅰ期研究中,奥雷巴替尼在CML-CP患者中达到100%的完全血液学缓解率。去年11月,该新药上述适应症已在中国获批上市。
2.武汉滨会溶瘤病毒获胶质瘤孤儿药资格。滨会生物溶瘤病毒药物BS001(OH2)注射液获FDA授予孤儿药资格,用于治疗恶性脑胶质瘤。OH2是一款重组人粒细胞-巨噬细胞集落刺激因子(GM-CSF)溶瘤II型单纯疱疹病毒产品,具有直接溶瘤、诱导局部和全身性抗肿瘤免疫应答、广谱抗肿瘤的效果。此前,该产品已获FDA授予孤儿药资格,用于治疗IIb期至IV期黑色素瘤。
3.丹诺抗幽门螺杆菌新药早期研究见刊。丹诺医药多靶点偶联分子rifasutenizol(TNP-2198)在《柳叶刀–感染病学》上发表用于治疗幽门螺杆菌感染的Ⅰ/Ⅱ期临床试验结果。数据显示,rifasutenizol能剂量依赖性提高对幽门螺杆菌的根除率;rifasutenizol(400mg)与雷贝拉唑(20mg)和阿莫西林(1g)联合治疗14天后,对幽门螺杆菌根除率达到95%:rifasutenizol单药或联合用药均具有良好的耐受性,未出现严重不良事件。
4.瑞吉康AAV基因疗法报渐冻症IND。上海瑞吉康自主研发的AAV基因治疗药物RJK002的临床试验申请(IND)获CDE受理,拟开发用于治疗肌萎缩侧索硬化(ALS,也称“渐冻症”)。该公司RJK系列多肽药物可在生理层面实现聚集蛋白的“溶解”,恢复这类聚集蛋白的生理功能,有望为神经退行性疾病提供新的治疗选择。去年10月,FDA已授予RJK002用于治疗ALS患者的孤儿药资格。
5.腾盛博药收购乙肝新药BRII-179知识产权。腾盛博药宣布与VBI Vaccines(VBI)达成协议,以确保扩大并掌控乙肝(HBV)免疫疗法BRII-179(VBI-2601)的未来临床开发和商业供应。去年7月,腾盛博药已将BRII-179的独家许可扩展至全球市场;该疗法目前已处于Ⅱ期临床开发。根据协议,腾盛博药最初将向VBI开具250万美元的本票,这将取消乙型肝炎疫苗PreHevbri相关的特许权使用费和里程碑费用。在满足特定条件后,票据将增加至1,000万美元,以获得VBI在BRII-179的所有知识产权,BRII-179相关付款也都将被取消。
国际药讯
7.吉利德购进肝病突破性PPARδ激动剂。吉利德宣布以总金额达43亿美元收购CymaBay公司,并获得该公司拟开发用于治疗原发性胆汁性胆管炎(PBC)的突破性疗法--过氧化物酶体增殖物活化受体(PPARδ)激动剂seladelpar。目前,FDA已受理Seladelpar的上市申请,并授予优先审评资格,PDUFA日期为今年8月14日。在Ⅲ期试验RESPONSE中,与安慰剂相比,seladelpar治疗达到血清碱性磷酸酶和胆红素相关的主要复合终点的患者比例显著更高(61.7%vs20.0%)。
医药热点
1.俄罗斯癌症疫苗即将面世。近日,俄罗斯总统普京宣布,俄罗斯科学家在癌症疫苗研发方面取得了重要进展,已接近成功研制出一种新型癌症疫苗。这种疫苗属于新一代免疫调节药物,能针对不同类型的癌症进行治疗。这意味着,患者在接受治疗时将更有针对性,能减少不必要的痛苦和风险。同时,每个患者都能根据自身情况和癌症类型,制定最适合的治疗方案。
2.云南省儿童医院揭牌成立。近日,“云南省儿童医院”揭牌仪式在昆明市儿童医院举行,标志着云南省构建整合型儿童健康服务体系迈出关键步伐,将进一步建强儿科高地,辐射带动儿童医疗保健服务不断提质增效。昆明市儿童医院是该省唯一集急救、医疗、教学、科研、康复、保健、预防为一体的大型儿童综合性专科医院,承担儿童医学中心、儿童重大疾病研究重点实验室、儿童健康与疾病临床研究中心、儿科疾病临床医学中心、儿科研究所、新生儿疾病研究中心等重要职责。
评审动态
1. CDE新药受理情况(02月09日)

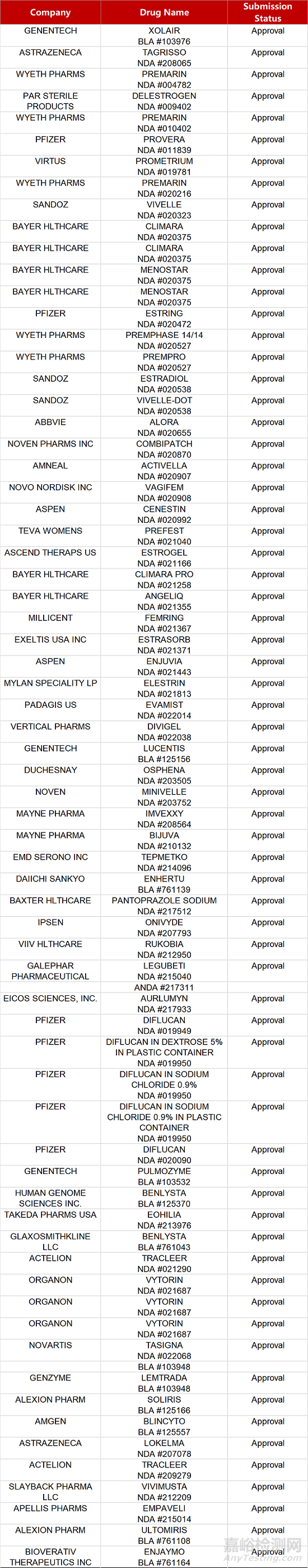
2. FDA新药获批情况(北美02月18日)

来源:药研发


