您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-02-18 09:57
黑色素瘤是一种产生于黑色素细胞的恶性皮肤肿瘤,易转移,侵袭性强,存活率低。因此,一种简单、可行、高效的治疗策略仍是该领域的一项艰巨挑战。最近,智能可穿戴生物贴片通过外部刺激引发不可逆的肿瘤细胞损伤,为皮肤肿瘤治疗提供了一种前景广阔的辅助方法。迄今为止,已开发出多种用于皮肤肿瘤治疗的自供电电贴片和基于焦耳热的热疗贴片。然而,大多数已报道的电热贴结构复杂、制作工艺复杂、设备要求高、制备难度大,因此制备成本高、耗时长。这些缺点限制了其潜在的临床应用,因此迫切需要开发一种简单、多反应和可穿戴的贴片来有效治疗黑色素瘤。一种能够对光和电产生多种反应而又不影响日常活动的可穿戴生物贴片是皮肤癌治疗的殷切希望,但仍是一项关键挑战。
来自中国科学院长春应用化学研究所的Guohua Qi和金永东团队开发了由透明离子凝胶和掺杂 MXene(Ti3C2Tx)组成的可安装在皮肤上的电刺激增强型光热贴片(eT-patch),并将其应用于 0.5 W/cm2 光刺激下的黑色素瘤治疗。由于掺杂了 MXene 的离子凝胶具有很高的光热转换效率和作为介质的导电性,因此所设计的 eT 补丁具有优异的光热和导电特性。同时,基于离子凝胶的 eT 贴片具有极佳的光学透明度,可在光热和电刺激(PES)联合疗法下实时观察皮肤反应和黑色素瘤治疗过程。通过系统的细胞研究发现,在光热电刺激治疗下,eT-patch 能协同触发癌细胞凋亡和热休克,共同导致黑色素瘤细胞死亡。所开发的 eT-patch 具有相对安全、对健康器官副作用小等明显优势,为皮肤肿瘤提供了一种经济有效的治疗策略,并将为离子凝胶的生物医学应用开辟一条新途径。相关工作以题为“A wearable electrostimulation-augmented ionic-gel photothermal patch doped with MXene for skin tumor treatment”的文章发表在2024年01月26日的国际顶级期刊《Nature Communications》。
1. 创新型研究内容
本研究开发了一种基于透明离子凝胶的可穿戴生物电热贴片(eT-patch),它掺杂了MXene,具有更好的导电性和光热特性,可用于生物医学应用。所开发的 eT 贴片具有良好的光学透明性,可在 PTT 和 ES(PES)联合治疗黑色素瘤的过程中实时观察治疗效果。如图 1 所示,PES 治疗后肿瘤得到了明显的抑制。本研究从细胞水平揭示了 eT-patch 的抗肿瘤机制。由于PES治疗相对安全,对移植黑色素瘤小鼠的主要器官无明显损伤,eT贴片在皮肤肿瘤治疗方面具有潜在的临床应用前景。
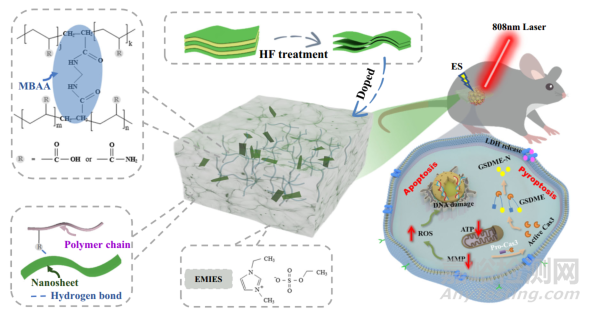
图1 基于离子凝胶的皮下肿瘤治疗电子贴片
【eT-patch 的制备和表征】
首先,在氟化锂和盐酸的混合溶液中蚀刻 Ti3AlC2 粉末(MAX),然后离心分离并分散到水中,得到 Ti3C2Tx 的纳米片胶体,冷冻干燥后得到 MXene 粉末。如图 2a、b 所示,以纳米孔阵列阳极氧化铝为载体,通过扫描电子显微镜(SEM)和透射电子显微镜(TEM)成像,可以清晰地观察到样品的超薄二维层状结构,表明化学剥离 Ti3C2Tx 纳米片的制备成功。如图 2c 所示,用原子力显微镜测量的 Ti3C2Tx 纳米片的厚度约为 2 nm,这与之前报道的结果一致。随后,利用 X 射线衍射(XRD)测量了 Ti3C2Tx 纳米片的晶体结构。如图 2d 所示,MAX 粉末与 Ti3C2Tx 的 XRD 图样中,(002) 峰明显从 9.5°移至较小的 6.5°角,与 MAX 相关的 (101)、(104) 和 (105) 三个峰消失了,这是因为 Ti3C2Tx 从 Ti3AlC2 转变而来,实现了插层,并在表面引入了 -O、-OH 和 -F 端基团。
为了进一步了解 Ti3C2Tx 纳米片的表面基团,本研究用 X 射线光电子能谱(XPS)对其进行了检测。纳米片的 XPS 光谱显示了 0 至 1000 eV 范围内 Ti2p、C1s、O1s 和 F1s 的典型峰值,这些峰值分别位于 33、284、454、531、563、682、827 和 976 eV。结果证实制备的纳米片表面主要含有-O、-OH 和-F等表面端基。图 2e显示了 Ti3C2Tx 纳米片的 Ti 2p 光谱,其中 454.3 和 460.5 eV 对应于 Ti-C 键。455.5 和 461.6 eV 处的峰主要归因于 Ti2+,而 Ti3+ 的峰则位于 457.8 和 464.3 eV 处,在 488.8 eV 处没有检测到峰,这表明 Ti3C2Tx 纳米片在分层过程中没有发生氧化。蚀刻得到的 Ti3C2Tx 纳米片可以很好地分散在水中,并表现出显著的廷德尔效应(如图 2f 插图所示)。同时,利用紫外吸收光谱检测了水中胶体 Ti3C2Tx 纳米片的光学特性(图 2f),观察到在 768 纳米处有一个明显的吸收峰,可以很好地与 808 纳米激光耦合,用于后续的癌症 PTT。本研究选择了来自 C57BL/6J 小鼠自发性肿瘤细胞的 B16F10 细胞进行下一步实验。使用标准的 MTT 试验进一步检测了 Ti3C2Tx纳米片的生物相容性,结果表明在与 45 μg/mL 的纳米片培养后,B16F10 细胞具有良好的存活率。与纯 H2O 相比,经 808 纳米激光照射的 MXene 培养基温度明显升高。用 MXene 培养的 B16F10 细胞的存活率随着激光功率的增加而逐渐降低。此外,根据计算,Ti3C2Tx 纳米片的光热转换效率约为 30%,高于金纳米棒(21%)和 Cu9S5NCs(25.7%)。因此,在接下来的实验中,MXene 纳米片作为一种理想的光热剂被用于离子凝胶贴片的掺杂。
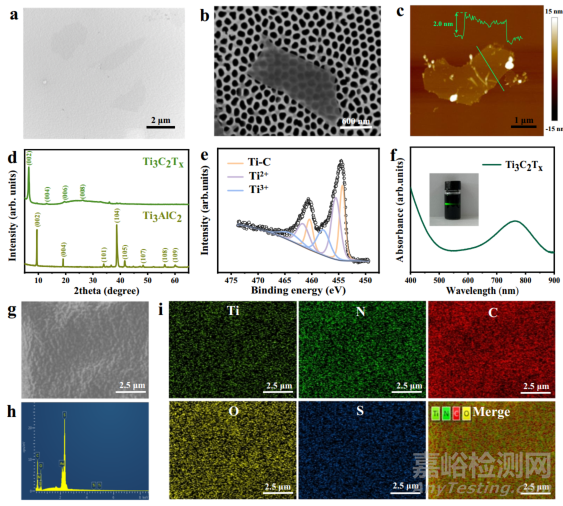
图2 光热剂 MXene 和离子凝胶的特性
本研究在模具中通过紫外灯聚合制备出掺杂了 MXene 纳米片的离子凝胶贴片。如图 2g 所示,从扫描电镜图像中可以观察到贴片相对平坦的表面和内部多孔的层状结构。扫描电镜能谱和元素图谱清楚地显示了钛元素在离子凝胶中的均匀分散(图 2h,i),表明 MXene 在离子凝胶中的成功掺杂。由于添加 Ti3C2Tx 后与聚合物网络相互作用形成氢键,与纯离子凝胶制成的补丁相比,掺杂 Ti3C2Tx 后的复合补丁具有很好的延展性。用万能测试仪测试了贴片的应力-应变曲线(图 3a)。从图 3b 和 c 中可以看出,随着 Ti3C2Tx 掺杂含量的增加,离子凝胶的断裂伸长率和韧性都有所提高。掺入 0.8 毫克/毫升 Ti3C2Tx 的离子凝胶的断裂伸长率(5.75 兆帕)约为 745%。随着振动频率的增加,eT-patch 的存储模量(G')和损耗模量(G")都得到了提高。随着频率的增加,在较高频率下 G" 的值高于 G',表现为粘性材料。值得注意的是,掺杂 MXene 后,贴片的光热转换性能显著提高,在 808 纳米激光照射下 10 分钟,贴片的温度随着 MXene 浓度的升高而逐渐升高。同时,随着激光功率和贴片厚度的增加,贴片的温度也明显升高。有趣的是,在同一贴片的不同区域测得的温度基本相同,这意味着离子凝胶贴片内的 MXene 掺杂基本均匀。在随后的实验中,使用了掺杂了 0.8 mg/mL MXene 的离子凝胶贴片,在 0.5 W/cm2 的 808 纳米激光照射 10 分钟后,其温度高达约 62.4 ℃。值得注意的是,即使用 808 纳米激光照射贴片,每次 10 分钟,循环五次,该贴片也能显示出卓越的热稳定性(图 3d)。此外,本研究还通过热成像监测了不同组(凝胶中掺杂 MXene(GM)和纯凝胶(G),分别与电刺激(E)、激光照射(L)以及 ES 和激光同时处理(EL))的温度变化,并绘制成曲线(图 3e,f)。结果表明,纯离子凝胶贴片在经过激光和 ES 处理后温度变化不大,ES 对掺杂了 MXene 的离子凝胶贴片的温度转换影响较小,而掺杂了 MXene 的离子凝胶贴片的温度则随着照射时间的延长而明显升高。
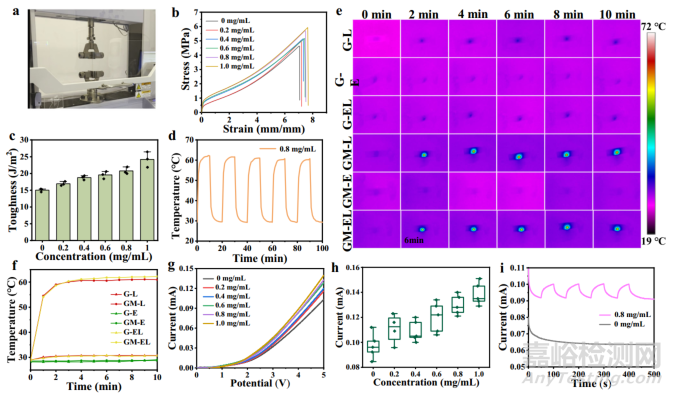
图3 eT-patch 性能测量
【PES 处理过程中细胞死亡的机制】
在将 eT 贴片应用于皮肤肿瘤治疗之前,本研究系统地关注并揭示了光电刺激对 B16F10 细胞的影响和细胞死亡机制。首先用不同的电流处理在 ITO 玻璃上培养的 B16F10 细胞 10 分钟,然后用活/死荧光染色法和 MTT 法检测细胞存活率,结果表明,随着刺激电流的增大,细胞存活率逐渐降低,说明电流的增大提高了对癌细胞的杀伤率。于是,本研究选择了 5 μA 的电流值进行后续实验。随后,用不同的方法处理了 B16F10 细胞(图 4a、b),结果表明:PES 处理对细胞的杀伤效果明显强于其他处理方法。显然,PES 实验组的激光照射(同时应用电刺激和光热刺激)不仅具有增强电流效应,还具有光热效应,这两种效应都有利于杀死癌细胞。此外,本研究还选择了小鼠成纤维细胞 L929 作为正常细胞,以检验该方法对正常细胞的损伤是否较小。与 B16F10 细胞相比,受测的 L929 细胞有更高的细胞存活率。因此,肿瘤细胞更有可能在处理过程中受损。显然,本研究注意到 ES 诱导的死亡细胞显示出明显的细胞肿胀,这是典型的热凋亡特征,而 PTT 引发的细胞死亡是细胞凋亡,因为细胞形态明显起皱。因此,在 PES 治疗过程中,细胞热解和凋亡都能被触发,这两种现象都有利于癌症治疗。为了验证 PES 能诱导癌细胞热解和凋亡,本研究使用 RT-PCR(反转录聚合酶链反应)对 PES 处理前后的相关基因表达进行了检测。如图 4c 所示,与对照组相比,PES 处理后 B16F10 细胞内的热解标志物(GSDME、Caspase-3、IL-1β)和凋亡标志物(Bax、c-Jun、Cyt-c)的基因表达明显升高。为了进一步证实 ES 引发了细胞凋亡,使用商用 LDH 检测试剂盒检测了乳酸脱氢酶(LDH)作为经典的细胞凋亡生物标志物在不同处理后的释放水平。如图 4d 所示,PES 和 ES 组 B16F10 细胞的 LDH 释放水平明显高于其他组。同时,PES 处理后 B16F10 细胞内的 ATP 水平也低于其他处理(图 4e)。这些结果表明,PES 策略诱导了细胞的强热休克。此外,如图 4f 所示,从生物透射电子显微镜(Bio-TEM)图像中观察到明显的线粒体破坏,并伴有明显的空化和肿胀,这表明 PES 导致了线粒体功能障碍。此外,还使用 2,7-二氯二氢荧光素二乙酸酯(DCFH-DA)检测了 B16F10 细胞内的 ROS 水平,DCFH-DA 可水解生成 DCFH 防渗膜,在内部扩散并被非特异性氧自由基氧化生成绿色荧光 DCF。

图4 PES诱导细胞死亡的机理研究
【eT-patch 治疗黑色素瘤的疗效评估】
为了评估 eT 贴片在 PES 下对皮肤肿瘤的治疗效果,通过皮下移植肿瘤细胞建立了 B16F10 肿瘤 C57BL/6J 小鼠模型,治疗方案如图 5a 所示。首先将体积约为 100 mm3 的肿瘤小鼠随机分为五组,包括对照组、激光组、PTT 组、ES 组和 PES 组。随后,小鼠连续两天接受不同方法的治疗,每次治疗 10 分钟,然后观察 13 天。15 天后估计不同方法的治疗效果。为了揭示电流的流向,检测并计算了 eT 贴片覆盖肿瘤前后流过肿瘤的电流值。经计算,在 5 V 电压下,通过独立贴片的电流值(记为I0)约为 9.3 × 10-5 A。值得注意的是,贴片附着到肿瘤上后,在 5 V 下记录到的电流值(I1)增加到 ~1.7 × 10-4 A,这表明肿瘤和 eT 贴片之间存在并联电阻关系。电流可以通过贴片流经肿瘤表层。为了更好地理解,本研究分别绘制了两种情况的电路图,并相应标注了治疗过程中的电流流向。为了估算治疗的有效深度,对小鼠经 PES 治疗后的肿瘤组织进行了 H&E 和 TUNEL 染色。该方法消融肿瘤的有效深度可达约 5 毫米。特别是,PTT 组和 PES 组肿瘤小鼠的实时红外热图像显示,在治疗过程中局部温度迅速升高,这意味着 PTT 和 PES 治疗非常适合消除肿瘤(图 5b)。肿瘤热成像和肿瘤及周围温度曲线显示,肿瘤周围温度约为 40 ℃,肿瘤治疗过程中对周围正常组织的损伤较小。通过光学照片记录了不同处理后小鼠的肿瘤大小(图 5c),证明 PES 处理对肿瘤的抑制效果显著。对不同处理后的肿瘤组织进行解剖和称重,如图 5d、e 所示,eT 贴片的抗肿瘤效果更优。根据相对肿瘤体积计算出的平均抑制率分别为 ~17.80、17.70、14.13、14.98 和 1.96,如图 5f 所示。
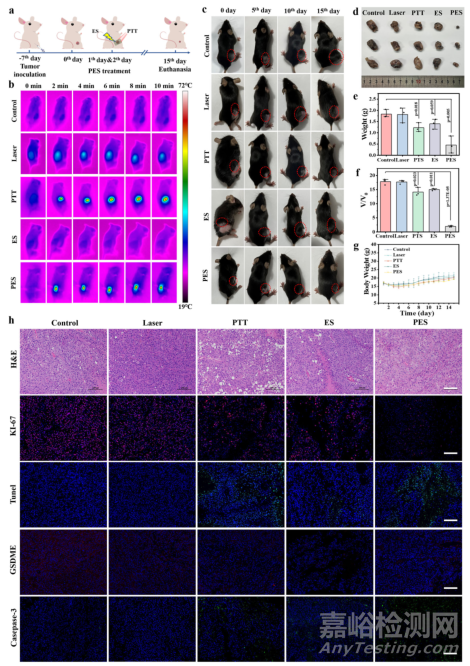
图5 黑色素瘤模型的体内治疗
2. 总结与展望
综上所述,本研究研制出了一种由掺杂了MXene的离子凝胶组成的可穿戴双响应eT贴片,并将其应用于光热和电刺激(PES)联合疗法对黑色素瘤的高效治疗。eT-patch 具有良好的透明性,可以实时目测皮肤反应,评估皮肤肿瘤的治疗效果。本研究初步揭示了 PES 治疗的潜在细胞机制,即凋亡和热凋亡均被触发,并与 ROS 诱导的 MMP 减少和 DNA 损伤相关联。令人印象深刻的是,利用易于制造的 eT 贴片进行皮肤癌 PES 治疗具有生物安全性高、稳定性好、副作用少和调控灵活等特点。这项研究为探索有效治疗黑色素瘤、避免手术风险的贴片材料提供了新的机遇,并将拓宽离子凝胶的生物医学应用。
文章来源:
https://doi.org/10.1038/s41467-024-45070-z

来源:EngineeringForLife


